Острые респираторные вирусные инфекции (ОРВИ) являются наиболее распространенными в структуре инфекционных болезней [1]. При обычных ежегодных сезонных эпидемиологических вспышках ОРВИ, в т. ч. гриппа, заболевает 10 % населения. На территории России ежегодно регистрируется 30–40 млн случаев инфекционных заболеваний, в структуре которых 70 %, а в некоторые годы 90 % приходится на ОРВИ и заболевания неуточненной этиологии. Столь частые заболевания респираторного тракта объясняются многообразием этиологических факторов: вирусы гриппа, парагриппа, адено-, рино-, корона-, РС-вирусы и т.д., а также легкостью передачи возбудителя и его высокой изменчивостью. Среди детей с аллергией, особенно с бронхиальной астмой, значительную группу составляют больные, склонные к частым ОРВИ. Клинические наблюдения свидетельствуют, что респираторные вирусные и бактериальные инфекции у детей с атопией могут быть причиной обострения аллергического процесса. Некоторыми авторами высказывается предположение о возможной роли персистирующей вирусной и микоплазменной инфекций в развитии аллергии у детей раннего возраста.
Повторные грипп, острые респираторные заболевания (ОРЗ) у детей с аллергией способствуют формированию хронической бронхолегочной патологии, предрасполагают к появлению гайморитов, тонзиллитов, отитов и другой ЛОР-патологии; формируют, приводят к возникновению вторичного иммунодефицитного состояния и т.д. [2].
Чаще практические врачи ставят диагноз гриппа и ОРВИ на основании совокупности клинико-эпидемиологических данных [3]. Большое значение имеет эпидемиологическая ситуация в регионе: возникновение массовых однотипных заболеваний в организованных коллективах, особенно детских, являющихся своеобразным индикатором эпидемического процесса ОРВИ. Подтверждение диагноза инфекционного заболевания, вызванного респираторными вирусами, проводится лабораторными методами. Могут быть использованы методы иммуноферментного анализа, иммунофлюоресценции, иммуноэлектронной микроскопии, вирусологические, серологические и др.
При безусловно важном значении для клинических проявлений заболевания массивности инвазии различных возбудителей, их цитопатогенных свойств, репродукционной интенсивности, а также способности индуцировать выработку провоспалительных цитокинов решающая роль принадлежит активности специфического иммунитета и неспецифической резистентности организма [4].
На внедрение возбудителя организм отвечает сложной системой защитно-приспособительных реакций, направленных на ограничение его репликативной активности с последующей элиминацией и в конечном итоге – на полное восстановление структурно-функциональных нарушений, возникающих в ходе инфекционного процесса.
Ход инфекционного процесса определяется быстротой и характером взаимодействия возбудителя с клетками-мишенями в месте его проникновения и репликации и множественными факторами иммунной защиты, локализованными в интраэпителиальном и внутриклеточном пространстве слизистых оболочек респираторного тракта и региональных лимфоузлах [5]. В тех случаях, когда система защиты совершенна, инфекционный процесс может прерываться или, оставаясь локализованным, не сопровождаться развитием выраженных клинических проявлений. Таким образом, адекватные защитные реакции способствуют быстрой инактивации возбудителя, восстановлению нарушенных функций организма и выздоровлению. Иная картина возникает в организме, высоковосприимчивом к данному возбудителю и не располагающем совершенным механизмом специфической и неспецифической защиты. В таких случаях возбудитель, продукты его взаимодействия с эпителиальными клетками, а также сами разрушенные клетки попадают в кровь, обусловливая тяжелое течение болезни, развитие осложнений и возможный неблагоприятный исход [6].
Поскольку входными воротами при ОРВИ является респираторный тракт, в первую очередь в иммунную реакцию вовлекаются местные факторы защиты, среди которых доминируют макрофаги и секреторный иммуноглобулин А, обладающий способностью предупреждать адгезию возбудителя к поверхности эпителиальных клеток слизистых оболочек с последующим его разрушением и элиминацией.

В случаях несовершенства местных факторов защиты первыми страдают клетки цилиндрического эпителия носовых ходов и трахеи, на которых возбудители фиксируются, проникают внутрь клеток и поражают их.
В чрезвычайно короткие сроки развиваются своеобразные патоморфологические изменения – как общие для всех возбудителей (внутриядерные и цитоплазматические изменения, деструкция клеток, слущивание эпителия, нарушение мукоцилиарного клиренса), так и специфические для каждого [7]. Доказано, что у детей с аллергией нарушение барьерной функции слизистой оболочки дыхательных путей под влиянием вирусной инфекции приводит к проникновению экзогенных аллергенов во внутреннюю среду организма и повышению реактивности ирритарных рецепторов подслизистого эпителия бронхов.
Все факторы иммунной защиты: неспецифические (тканевые барьеры, макрофаги, естественные киллеры, лизоцим, комплемент, острофазные белки, цитокины и т. д.) и специфические связаны между собой и дополняют друг друга. Чем выше активность воспаления, тем выше интенсивность защитной реакции, в т. ч. цитокино- (интерфероны, интерлейкины) и антителообразования. Значительная роль в противовирусной защите принадлежит системе интерферонов (ИНФ) – естественных цитокинов, обладающих универсальными антивирусными свойствами: способностью к подавлению репликации многих РНК- и ДНК-содержащих вирусов за счет ингибирования процессов транскрипции и трансляции вирусных матриц.
Известно, что в основе многих инфекций верхних дыхательных путей (фарингиты, тонзиллиты, риниты), как правило, лежит вирусная инфекция, однако они часто осложняются развитием бактериальной суперинфекции экзогенного или эндогенного происхождения. Экспериментальные исследования подтвердили эффективность использования иммунотерапии с помощью бактериальных лизатов с целью восстановления гуморальных и других иммунных реакций, формирования противовирусного и поствакцинального иммунитета.
Показано, что в ротоглоточном сегменте у часто и длительно болеющих детей с аллергией при формировании ЛОР-патологии и без нее выявляются следующие патогены: Streptococcus pneumoniae (25–30 %), Haemophilus influenzae (15–20 %), Moraxella catarrhalis (15–20 %), Streptococcus pyogenes (2–3 %), представители грамотрицательной микрофлоры, отмечается персистенция различных вирусов. Все это послужило основанием для использования бактериальных лизатов с целью увеличения продукции специфических антител, а также стимуляции неспецифических факторов защиты [8]. Были созданы различные препараты системного и местного действий.
Многочисленными исследованиями показано, что применение бактериальных лизатов местного действия при атопии у детей с рецидивирующими риносинуситами, трахеобронхитами позволяет нормализовать систему местного, т. е. мукозального, иммунитета слизистых оболочек верхних дыхательных путей, носа, околоносовых пазух и глотки, повысить устойчивость к вирусам и другим инфекциям, снижая вероятность развития бактериальных осложнений. Эффект местной иммунизации при использовании лизатов местного действия заключается в том, что сорбированные антигены стимулируют в слизистой оболочке синтез антител всех классов. В силу особенностей строения слизистых оболочек большая часть антител в виде IgA выделяется в просвет дыхательных путей и образует на поверхности барьер в виде пленки, специфически защищающей слизистую оболочку от проникновения патогенных возбудителей.
В период уже начавшегося воспалительного процесса применение бактериальных лизатов местного действия приводит к увеличению концентрации секреторных иммуноглобулинов, которые связываются с бактериальными и вирусными патогенами, блокируя возможность их эффективной адгезии к клеткам эпителия, препятствуя развитию системного воспаления и предотвращая развитие различных форм нарушения иммунорегуляции.
Местная иммунокоррекция на разных этапах заболевания при использовании лизатов осуществляется за счет следующих факторов:
Иммунопрофилактики – защиты слизистых от патогенов.
Предотвращения развития осложнений в начале заболевания, ускорения процессов выздоровления, уменьшения клинических проявлений воспалительного процесса, снижения потребности в антибиотикотерапии.
При наличии атопии – повышения активности Th2-иммунного ответа за счет формирования иммуномодулирующего эффекта [9].
Применение противовирусных препаратов в педиатрической практике резко снижено из-за их высокой токсичности, т. к. метаболизм размножающихся вирусов тесно связан с таковым клеток человека и воздействие на вирус почти неизбежно оказывает влияние на клетки растущего и развивающегося организма ребенка.
При гриппе применяют римантадин и амантадин, препятствующие адсорбции, проникновению в клетку хозяина и «раздеванию» вируса. Римантадин и амантадин обладают активностью не только по отношению к вирусу гриппа А. Поэтому показанием к их назначению является установленная или высоковероятная гриппозная этиология болезни. При тяжелой респираторно-синтициальной инфекции, протекающей в форме бронхиолита или пневмонии, используется нуклеозидный аналог гуанозина – рибавирин [10]. Следует помнить, что рибавирин, так же как римантадин и амантадин, способен вызывать различные побочные эффекты, в т. ч. анемию, поражение печени и почек. Поэтому назначение этих препаратов детям с аллергией может быть оправданно только тяжелым течением вирусной инфекции и высоким риском неблагоприятного исхода болезни.
Детям первого года жизни с пищевой аллергией можно использовать интраназальное введение нативного лейкоцитарного α-ИНФ, или препаратов ИНФ α-2β. Указанные препараты продемонстрировали высокую клиническую безопасность.
В последние годы проводилось множество исследований, посвященных изучению изменений иммунологической реактивности у детей с аллергическими заболеваниями при развитии ОРИ. Было убедительно показано, что у большинства больных регистрируется определенное снижение факторов местного иммунитета на фоне дисбаланса клеточного и гуморального звеньев. В связи с этим становится очевидным, что наиболее оправданным средством лечения и профилактики ОРИ у детей с аллергическими заболеваниями являются препараты, оказывающие противовирусное и иммуномодулирующее действия [11]. Клинические наблюдения свидетельствуют о том, что выбор лекарственных препаратов для лечения и профилактики ОРИ у детей, страдающих атопическими заболеваниями, весьма труден. Доказано, что эти дети подвержены частой респираторной заболеваемости из-за функциональных нарушений иммунного ответа, за счет преобладания Th2-хелперов, проявляющегося повышенной выработкой IgE и снижением синтеза ИНФ-γ. Кроме того, эпизоды ОРВИ, а также персистенция различных вирусов в рото- и носоглотке способствуют обострению атопической нозологии. Клиническая эффективность лечения острых респираторных вирусных инфекций у детей с атопией изучалась в ходе двойного слепого плацебо-контролируемого исследования, проведенного в различных медицинских центрах России, при этом оценивалась способность Анаферона детского влиять на заболеваемость ОРВИ среди детей 2–7 лет, страдающих бронхиальной астмой. Согласно полученным результатам, количество ОРВИ в группе детей, получавших препарат, было статистически значимо меньше (р < 0,05), нежели в контрольной группе [12]. Аналогичная закономерность была выявлена в отношении числа обострений бронхиальной астмы в основной и контрольной группах. Согласно другим исследованиям, на фоне профилактического применения иммуномодулятора с противовирусными свойствами детского заболеваемость ОРВИ снижалась в 3,3 раза, уменьшалась частота обострений атопических болезней (аллергический ринит – в 2 раза, бронхиальная астма – в 3,8, атопический дерматит – в 3,2) [13].
Профилактика ОРВИ до настоящего времени по-прежнему актуальна. Основным препаратом остается вакцина против гриппа. Как показали исследования последних лет, прививки против гриппа не только снижают заболеваемость этой инфекцией, но и сокращают частоту ОРВИ другой этиологии [1]. Есть несколько объяснений этого феномена. Вакцины против гриппа являются мощными индукторами интерфероногенеза, поэтому их введение не только приводит к формированию специфической иммунной защиты, но и может способствовать неспецифической профилактике других вирусных заболеваний за счет повышения уровня ИНФ. Играет роль и поликлональная активация иммунной системы: заражение тем или иным респираторным патогеном способно не только вызывать специфический иммунный ответ, но и активировать механизмы иммунологической памяти в отношении других возбудителей, с которыми организм встречался ранее. Можно предположить, что введение вакцины против гриппа может активировать сниженный иммунитет к другим вирусам. Вероятно, все вышеизложенное и объясняет тот факт, что иммунизация детей с аллергическими болезнями от гриппа даже в период подъема респираторной заболеваемости сопровождается снижением частоты не только этой инфекции (в 4–5 раз), но и других ОРВИ (в 2 раза). Нельзя не отметить и активно обсуждающуюся возможность позитивного влияния гриппозных вакцин на направленность иммунного ответа. Так, высказывается предположение, будто основным механизмом положительного неспецифического протективного эффекта таких вакцин против других респираторных вирусов является переключение иммунного ответа с Th2 на Th1, что показано, например, в отношении больных детей с бронхиальной астмой.
Для иммунизации предпочтительнее использовать современные инактивированные гриппозные сплит- и субъединичные вакцины, обладающие равной высокой иммуно- и очень низкой реактогенностью (табл. 1).
Перспективным для часто болеющих ОРВИ детей с атопией следует считать использование иммуномодуляторов растительного происхождения, основой которых является сок травы Echinacea. Широкое применение препарата Echinacea в педиатрии базируется на данных экспериментальных работ, в которых была доказана его способность стимулировать процессы фагоцитоза, антигензависимую пролиферацию Т-лимфоцитов, увеличивать синтез фактора некроза опухоли α, пропердина, α- и β-ИНФ и т.д. [14]. Доказано противомикробное действие препаратов Echinacea в отношении ряда возбудителей (Escherichia coli, Proteus mirabilis, Pseudomonas aeruginosa, Staphylococcus aureus) и различных вирусов (вирусы герпеса, цитомегаловирус, вирус Эпштейна–Барр и др.) [9]. Препараты на основе Echinacea обладают адаптогенной направленностью действия в отношении факторов иммунной системы. Действие препаратов комплексное, сбалансировано, приближено к физиологическому, затрагивает практически все эффекторные иммунологические механизмы, лишено побочных эффектов. Иммунал используется в большей степени как профилактическое средство, особенно среди детей раннего возраста, только начинающих посещать детские учреждения.
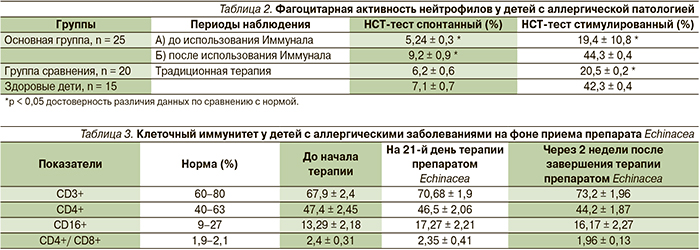
Доказанными эффектами препаратов Echinacea являются сокращение сроков течения респираторно-вирусных заболеваний, уменьшение интоксикации и лихорадки у детей с бронхиальной астмой. Кроме того, иммуномодулирующая терапия с использованием препаратов Echinacea позволяет снижать частоту бактериальных осложнений ОРВИ. Это влияние особенно ярко проявляется у детей с аллергией, которые, как известно, наиболее склонны к частым ОРВИ. Снижение частоты ОРВИ было зафиксировано при применении Иммунала детьми с заболеваниями кожи (экзема, псориаз), инфекциями мочевыводящей системы, аутоиммунными и другими заболеваниями. Очевидно, этот результат основан на способности растительных иммуномодуляторов вызывать неспецифический ответ по отношению к различным респираторным вирусам. Скорее всего, имеет значение увеличение синтеза ИНФ, как фактора противовирусного иммунитета, так и интенсификация фагоцитарных реакций (табл. 2).
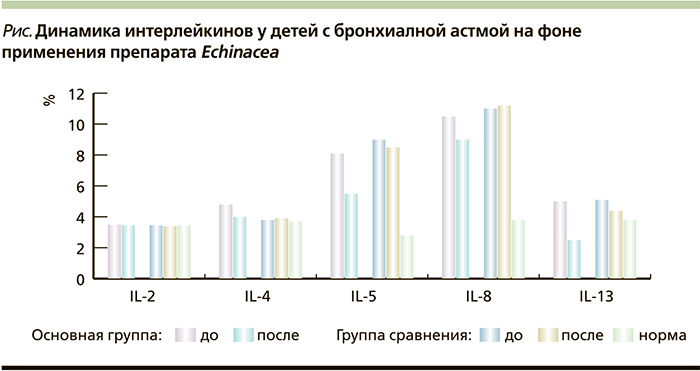
Как свидетельствуют проведенные исследования, применение препаратов Echinacea при ОРВИ детьми с аллергическими заболеваниями приводило к уменьшению сроков заболевания, уменьшению симптомов интоксикации за счет иммуномодулирующего и адаптогенного эффекта. Иммунный ответ этих детей характеризовался увеличением интенсивности фагоцитарных реакций, уменьшением продукции провоспалительных цитокинов Th2-профиля и сбалансированностью иммунорегуляторных взаимодействий (табл. 3, см. рисунок).
Суммируя результаты применения Иммунала детьми с аллергическими заболеваниями, можно сделать следующие выводы:
- профилактическое использование препаратов Echinacea детьми с аллергическими заболеваниями позволяет снижать заболеваемость ОРВИ в 1,4 раза;
- длительность ОРВИ при применении препаратов Echinacea уменьшается на 2 дня;
- на фоне применения препарата уменьшается выраженность симптомов интоксикации;
- иммуномодулирующий эффект препаратов Echinacea проявляется в увеличении фагоцитарной активности нейтрофилов, показателей клеточного иммунитета и цитокинов;
- применение препаратов Echinacea позволяет снижать развитие бактериальных осложнений в 1,2 раза, а также уменьшать использование антибактериальных препаратов.
Результаты различных исследований, в т.ч. и иммунологических, посвященных проблеме затяжных и рецидивирующих респираторных инфекций, показали, что в основе подавляющего большинства этих состояний лежат приобретенные в ходе инфекционного процесса нарушения иммунного реагирования, причем, как правило, временного, корригируемого характера. Поэтому назначение иммунотропного препарата при развитии заболевания осуществляется врачом на основании клинических и иммунологических данных. Поскольку многие из иммуномодулирующих препаратов имеют строго направленное воздействие на иммунную систему, их применение требует серьезного обследования пациента с целью уточнения уровня, характера и степени выраженности иммунного нарушения. Кроме того, ряд препаратов имеет серьезные побочные и нежелательные эффекты. Некоторые лекарства недостаточно изучены или не допущены к применению в педиатрической практике. В связи с этим выбор лекарственного препарата для иммунокоррекции является чрезвычайно ответственным мероприятием и должен проводиться специалистом. Наиболее оправданным следует считать применение иммунотропного средства в целях профилактики ОРЗ без обязательного иммунологического обследования. Процесс создания и внедрения новых, все более эффективных и безопасных средств этой группы идет постоянно.
Таким образом, проблема эффективного использования иммуномоду-лирующей терапии у детей с аллергическими заболеваниями остается крайне актуальной. Основные совместные усилия клинических иммунологов, педиатров и аллергологов должны быть направлены на снижение неоправданных назначений иммунотропных средств, т.к. последствия этих назна-чений по тяжести осложнений и побочных эффектов могут превосходить тяжесть самого заболевания. Думается, у иммуномодулирующих средств профилактической направленности большое будущее, т.к. их применение позволяет снижать частоту развития респираторных заболеваний и связанных с ними различных осложнений.


