Введение
Практически каждый врач в своей практике решает вопросы, связанные с применением антибактериальной терапии. В современных условиях это очень непростая задача в связи с наличием массы доступных антибиотиков и динамически изменяющейся резистентностью к ним бактерий. Это приводит к неадекватному выбору стартовой антибиотикотерапии и как следствие – к селекции полирезистентных штаммов бактериальных возбудителей. Для педиатра выбор антибактериального препарата представляет особенную проблему. Оптимальный антибиотик должен не только иметь необходимый антимикробный спектр для данной клинической ситуации, но и быть высокобезопасным, а для пероральной формы желательно обладать хорошими вкусовыми свойствами.
Наиболее востребованными в клинической практике, в т.ч. в педиатрии, остаются β-лактамные антибактериальные препараты (пенициллины, цефалоспорины, карбапенемы). Цефалоспорины – наиболее обширный и разнородный по спектру антимикробной активности класс антибиотиков, в связи с чем принято разделять их на пять поколений. Первые три включают препараты парентерального и перорального применения, четвертое и пятое представлены только в парентеральных формах. В целом от первого к третьему поколению цефалоспоринов характерно расширение спектра действия в отношении грамотрицательных бактерий, но некоторое понижение активности в отношении грамположительных бактерий. Цефалоспорины четвертой-пятой генераций относятся к антибиотикам резерва и применяются при тяжелом течении инфекций, прежде всего госпитальных [1]. Цефалоспорины имеют высокий профиль безопасности и обладают широким терапевтическим диапазоном. У пациентов с аллергией на пенициллины может присутствовать перекрестная аллергия на цефалоспорины, но чаще она отмечается на цефалоспорины I поколения [2].
Антибиотик цефиксим – полусинтетический цефалоспориновый антибиотик III поколения перорального применения. Цефиксим активен в отношении ряда грамположительных бактерий: Streptococcus pneumoniae, Streptococcus pyogenes, Streptococcus agalactiae. Препарат обладает высокой активностью в отношении многих грамотрицательных бактерий: Haemophilus influenzae, Moraxella catarrhalis, кишечных бактерий (Escherichia coli, Proteus spp., Klebsiella spp., Salmonella spp., Shigella spp. и др.), Neisseria spp. К цефиксиму устойчивы большинство штаммов Staphylococcus spp., Pseudomonas spp., Enterococcus spp., Enterobacter spp., внутриклеточные и анаэробные бактерии. Цефиксим обладает хорошей биодоступностью (после приема внутрь абсорбируется 40–50 % препарата независимо от приема пищи), создает высокие концентрации в крови и тканях. Пиковая концентрация в сыворотке крови достигается приблизительно через 2–6 часов после приема, а в тканях – через 6–7 часов. К важным отличиям цефиксима от большинства других пероральных цефалоспоринов относится длительный период полувыведения (3–4 часа), что дает возможность применять препарат 1 раз в сутки [1–3].
В соответствии со спектром антимикробной активности и фармакокинетическими параметрами основными показаниями к применению цефиксима являются инфекции верхних дыхательных путей и ЛОР-органов (тонзиллофарингит, острый средний отит), инфекции мочевых путей.
Цефиксим в лечении инфекций верхних дыхательных путей и ЛОР-органов
Тонзиллофарингит является одним из наиболее частых поводов для обращения за медицинской помощью к педиатру. В большинстве случаев острый тонзиллофарингит – проявление острой вирусной инфекции и не требует назначения антибиотиков. В 15–36 % случаев острый тонзиллофарингит вызывается β-гемолитическим стрептококком группы А (БГСА, Streptococcus pyogenes) [4–5].
В 2012–2013 гг. мы обследовали 119 детей с острым тонзиллофарингитом с помощью экспресс-теста на БГСА (Стрептатест) – положительный результат был получен от 19 % больных. В систематическом обзоре Кокрановского сотрудничества (2013), включившем десятки исследований, показано, что назначение антибиотиков при боли в горле существенно снижает вероятность осложнений – как поздних (острая ревматическая лихорадка), так и ранних (средний отит, синусит, перитонзиллярный абсцесс) [6].

Бактерии рода Streptococcus, в т.ч. БГСА, не способны продуцировать β-лактамазы, сохраняют абсолютную чувствительность к пенициллинам и цефалоспоринам. В то же время наблюдаются случаи резистентности БГСА к макролидам, линкозамидам, фениколам, тетрациклинам, сульфаниламидам [7–8]. С учетом стабильной активности в отношении БГСА пенициллины (феноксиметилпенициллин, амоксициллин) остаются препаратом выбора в терапии стрептококкового тонзиллофарингита [9–12].
Отмечаемая в 1980-х гг. нарастающая клиническая и микробиологическая неэффективность пенициллина при стрептококковом тонзиллофарингите [13] объясняется наличием в небных миндалинах пациентов ко-патогенных бактерий (стафилококки, анаэробы), которые продуцируют β-лактамазы, разрушают природные пенициллины и аминопенициллины [14–16]. Поэтому пациентам, недавно получавшим β-лактамные антибиотики, а также в случае рецидивирования тонзиллофарингита рекомендуется назначение ингибиторозащищенных аминопенициллинов и цефалоспоринов [9, 12].
В случае аллергии на β-лактамные препараты рекомендуется применение макролидов или линкозамидов [9–11]. Рекомендации по антибактериальной терапии при стрептококковом тонзиллофарингите, по данным современных руководств, можно представить в виде алгоритма (табл. 1).
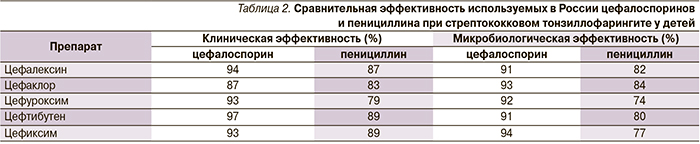
Большой интерес представляет применение цефалоспоринов в лечении стрептококкового тонзиллофарингита у детей. Препараты данной группы устойчивы к действию многих β-лактамаз [2], они оказывают меньшее по сравнению с пенициллинами влияние на α-гемолитические стрептококки, что способствует более эффективной эрадикации БГСА [16]. Данные мета-анализа эффективности 10-дневного курса различных цефалоспоринов по сравнению с пенициллином при стрептококковом тонзиллофарингите у детей (более 7000 пациентов) показали, что цефалоспорины значительно превосходят пенициллин по клинической и микробиологической эффективности (p < 0,00001) (табл. 2) [17]. Одним из препаратов, показавших существенно большую, чем пенициллин, эффективность, является пероральный цефалоспорин III поколения цефиксим.
Еще одной причиной неэффективности пенициллина при стрептококком тонзиллофарингите служит комплаентность 10-дневного курса лечения, необходимого для эрадикации БГСА. В мета-анализе Кокрановского сотрудничества (более 13 тыс. пациентов) показана сопоставимая эффективность коротких курсов ряда антибиотиков по сравнению с 10-дневным курсом пенициллина при остром стрептококковом тонзиллофарингите у детей [18]. В частности, установлена сопоставимая эффективность 10-дневного курса пенициллина и 5-дневного курса цефиксима в рандомизированном исследовании, включившем 160 детей [19]. Удачная фармакокинетика препарата, позволяющая принимать его 1 раз в сутки, способствует повышению приверженности к лечению [20].
В отношении пневмококка цефиксим сохраняет активность только к пенициллин-чувствительным штаммам. Поэтому антибиотик не рассматривается в качестве препарата выбора для эмпирической терапии при инфекциях, часто вызываемых пневмококком (острый средний отит, риносинусит) [3]. По данным российского исследования антимикробной резистентности ПеГАС-III, цефиксим сохраняет высокую активность в отношении 93,2 % штаммов S. pneumoniae [21]. Результаты данных исследований свидетельствуют в пользу возможности использования цефиксима при внебольничных инфекциях дыхательных путей.
Исследования последних лет, проведенные в разных странах, показывают, что цефиксим является наиболее активным пероральным препаратом в отношении H. influenzae и M. catarrhalis [22–24], что позволяет рассматривать этот антибиотик в качестве альтернативного препарата антибактериальной терапии инфекций верхних дыхательных путей [25]. Показано, что по клинической эффективности при остром среднем отите препарат не уступает ко-амоксиклаву и цефаклору [26, 27]. В ряде российских исследований также была показана эффективность цефиксима в лечении респираторных инфекций у детей [20, 28, 29].
Цефиксим в лечении инфекций мочевой системы
Инфекции мочевой системы (ИМС) широко распространены в детском возрасте [30–32], при этом в раннем детском возрасте эти заболевания нередко представляют диагностические трудности вследствие недостаточно характерной клинической картины. Нередко единственным симптомом служит лихорадка [32]. По зарубежным данным, ИМП страдают приблизительно 5 % лихорадящих младенцев [31].
Эффективность лечения и благоприятный прогноз ИМС определяются прежде всего проведением рациональной антибактериальной терапии. Основными возбудителями острых ИМП у детей являются представители семейства Enterobacteriaceae.
В педиатрической практике имеются определенные сложности при выборе антибактериальных средств лечения ИМС, что связано как с высоким уровнем резистентности основных возбудителей к аминопенициллинам, ко-тримоксазолу и цефалоспоринам I поколения [30], так и с ограничением к применению фторхинолонов (препаратов выбора для взрослых). При выборе препарата, режима и длительности его применения необходимо учитывать, что у детей изолированная инфекция нижних мочевыводящих путей встречается редко, особенно в первые годы жизни. В связи с этим во многих случаях лечения ИМС у детей недопустимо назначение антибактериальных препаратов, не создающих необходимых концентраций в паренхиме почек: нитрофураны, хинолоны, фосфомицин, нитроксолин. Таким образом, в современных условиях выбор антимикробных препаратов лечения ИМС ограничивается ингибиторозащищенными пенициллинами и цефалоспоринами II–III поколений. При тяжелых формах заболевания могут быть также использованы цефалоспорины IV поколения и карбапенемы (в виде монотерапии или в комбинации с аминогликозидами), а в отдельных случаях – фторхинолоны по витальным показаниям [1, 30].
Цефиксим активен в отношении многих клинически значимых бактерий; в частности, обладает высокой активностью в отношении подавляющего большинства представителей семейства Enterobacteriaceae [1, 2, 33]. Цефиксим обладает способностью накапливаться в моче, создавая очень высокие концентрации, которые многократно превышают минимальную подавляющую концентрацию большинства микроорганизмов, вызывающих ИМС. Согласно результатам российского мультицентрового исследования АРМИД-1, проведенного в 2000–2001 гг., основными возбудителями внебольничных ИМС у детей до 18 лет в России являются бактерии семейства Enterobacteriaceae (80,6 %), главным образом E. coli (в среднем в 53,0 % случаев) [30]. В данном исследовании было показано, что цефалоспорины III поколения имеют высокую активность в отношении ряда грамотрицательных возбудителей.
Многие исследования показали высокую чувствительность (> 96,6–99,9 %) E. coli, выделяемых при неосложненных внебольничных ИМС, к цефиксиму (меньшая резистентность отмечена только к фосфамицину) [34, 35]. В ряде доказательных клинических исследований показано, что цефиксим высокоэффективен в качестве стартовой терапии при ИМС у детей [36–38]. Показана сходная клиническая эффективность цефиксима и амоксициллина/клавуланата при ИМС у детей (84,2 и 82,4 %), при этом выявлена большая микробиологическая эффективность цефиксима – 100 и 69 % соответственно (р < 0,0001) [36].
Продемонстрирована эффективность и экономическая выгода пероральной терапии цефиксимом перед ступенчатой терапией. В многоцентровом рандомизированном клиническом исследовании показано, что у детей первых двух лет жизни при ИМС эффективность терапии цефиксимом (в течение 14 дней) не уступает ступенчатой терапии цефотаксимом внутривенно и цефиксимом (3 и 11 дней соответственно). При этом стоимость ступенчатой терапии была почти в 2,5 раза больше [37]. Схожие результаты получены при сравнении 10-дневного курса цефиксима и ступенчатой терапии – цефтризоксим (первые 2 дня внутримышечно) [38]. В научной литературе изложены также данные, будто ступенчатая терапия, при которой на втором этапе применяется цефиксим, по эффективности не уступает курсу парентеральной антибактериальной терапии [39].
В пилотном клиническом исследовании показано, что цефиксим в низких дозах (2 мг/кг в сутки) может быть успешно использован в качестве длительной (6–12 месяцев) профилактики рецидивов у детей с хронической ИМС. При этом эффективность и переносимость цефиксима не уступали нитрофурантоину [40].
Заключение
Таким образом, оральный цефалоспорин третьего поколения цефиксим занимает широкую нишу в антибактериальной терапии в педиатрии. Антибактериальный спектр цефиксима позволяет успешно применять его при лечении инфекций верхних дыхательных путей и ЛОР-органов, неосложненных инфекций мочевых путей.
В российских и зарубежных клинических исследованиях показано, что цефиксим является высокоэффективным и безопасным антибактериальным препаратом. Большое значение имеет то обстоятельство, что цефиксим принимается однократно в сутки, что положительно влияет на приверженность лечению. Для педиатрической практики также важно наличие на рынке специальной формы для детей. Препарат цефиксима Панцеф® выпускается в виде таблеток, покрытых пленочной оболочкой, для детей старше 12 лет и гранул для приготовления суспензии, что дает возможность использовать его детям раннего возраста (с 6 месяцев).



