Острые заболевания ЛОР-органов занимают ведущую позицию среди болезней в педиатрии [1]. В основном это связано с колоссальной распространенностью острых вирусных инфекций респираторного тракта как среди взрослых, так и среди детей, что в свою очередь сопровождается воспалением слизистой оболочки полости носа, околоносовых пазух (ОНП), полостей среднего уха, глотки, небных и глоточной миндалин. С учетом известных социальных, анатомических и иммунологических причин дети склонны к более длительному течению воспалительного процесса с присоединением бактериальной инфекции. Именно у детей воспалительные заболевания ЛОР-органов служат основной причиной назначения антибактериальной терапии и как следствие – избыточного применения антибиотиков. Отчасти это связано с тем, что респираторные инфекции у детей, как правило, сопровождаются высокой лихорадкой, что в свою очередь вызывает крайнее беспокойство со стороны как родителей, так и врачей, заставляет их принимать любые меры борьбы с лихорадкой, включая, к сожалению, назначение антибиотиков [2].
Кроме того, распространено заблуждение, будто антибактериальная терапия при вирусном заболевании предотвращает присоединение бактериальной инфекции. Еще одна причина избыточного системного лечения заключается в следующем: длительное течение насморка, появление боли в ухе или налетов на небных миндалинах, а тем более кашля (что у детей младшего возраста чаще является следствием «заднего» ринита) сами по себе служат поводом для проведения «серьезного лечения». Чрезмерное назначение антибиотиков до сих пор остается одной из наиболее существенных проблем врачей общей практики, отоларингологов, педиатров [3].
Настоящий обзор имеет целью привлечение внимания педиатров к проблеме острых инфекций ЛОР-органов у детей, их диагностике и лечению в соответствии с позициями ведущих международных согласительных документов.
Ринит у детей – наиболее типичное клиническое состояние. В большинстве случаев он разрешается самопроизвольно. Однако неумение сморкаться или неадекватное, недостаточно частое отсмаркивание, сопротивление при попытке промыть нос или закапать лекарство приводят к длительному нахождению слизи в полости носа, отеку и обструкции устьев ОНП, дисфункции слуховой трубы, «заднему» риниту с риском затяжного течения острой респираторной вирусной инфекции и таких осложнений, как острый бактериальный риносинусит (ОБРС), острый средний отит (ОСО) и т.д. Поэтому подход к лечению ребенка должен быть деликатным и направлен не столько на скорейшее выздоровление, поскольку длительность течения вирусной инфекции определяется свойствами патогена и скоростью иммунного ответа организма, сколько на облегчение симптомов заболевания и профилактику возможных осложнений.
Привлечение к консультации специалистов-отоларингологов, а также использование дорогостоящего оборудования для диагностики ОБРС или ОСО экономически неоправданны. Поэтому в соответствии с международными руководствами в настоящее время диагностика наиболее частых воспалительных заболеваний ЛОР-органов основывается на сборе анамнеза, а также на применении достаточно простых методов визуализации, доступных помимо отоларингологов аллергологам, пульмонологам, врачам общей практики, педиатрам [4]. Большинство острых заболеваний верхних дыхательных путей требует таких навыков, как передняя рино-, орофаринго- и отоскопия, проводимых как с помощью рефлектора, лампы и соответствующих инструментов, так и отоскопа, который становится инструментом работы педиатра практически наравне с фонендоскопом. Очевидно, что анализ полученных данных требует от любого врача знания анатомии уха, горла и носа, а от педиатра – и анатомо-физиологических особенностей этих органов у детей.
Острый риносинусит
В силу единства эпителия, выстилающего полость носа и ОНП, изолированное течение ринита и синусита практически невозможно, поэтому общепринятым термином становится «риносинусит», что отражается в большинстве международных руководств и согласительных документов.
Согласно классификации, предложенной авторами Европейского руководства по риносинуситу и назальному полипозу (EPOS – European Position Paper On Rhinosinusitis and Nasal Polyps, 2012), острым называется течение риносинусита менее 12 недель. Эта классификация включает острые вирусные риносинуситы, т.е. обычную острую респираторную вирусную инфекцию и острые поствирусные риносинуситы. Лишь у небольшой части пациентов с поствирусным острым риносинуситом (ОРС) развивается ОБРС. Вирусный риносинусит предполагает течение симптоматики менее 10 дней, а поствирусный – усиление симптоматики после 5-го дня болезни или сохранение симптомов после 10-го дня, но менее 12 недель [4].
Эпидемиология
Распространенность ОРС в популяции очень высока и достигает 6–15 %.
Частота случаев ОРС зависит от сезона, увеличивается в зимнее время, обусловлена климатом и влажностью воздуха. По европейским данным, за 2002–2008 гг. описано 18 случаев ОРС на 1000 детей в год в возрасте 12–17 лет и 2 случая на 1000 детей в возрасте 0–4 лет. Взрослые переносят от 2 до 5 эпизодов в год, дети школьного возраста – от 7 до 10.
Основная причина ОРС – вирусная инфекция. К наиболее частым вирусным возбудителям относятся рино-, аденовирус, респираторно-синцитиальный вирус, коронавирус [5]. Примерно у 0,5–2,0 % пациентов вторично развивается ОБРС, чему в первую очередь способствует снижение мукоцилиарного клиренса. По более ранним данным, у детей эта цифра достигает 5–10 % [6].
Наличие аллергического ринита, анатомических особенностей (клетки Галлера, искривление перегородки носа, увеличение глоточной миндалины и др.), цилиарная дискинезия, одонтогенные источники инфекции, а также табакокурение или экспозиция табачного дыма предрасполагают к развитию и рецидивированию ОРС.
На протяжении длительного времени основной спектр бактериальных возбудителей ОРС остается неизменным, его составляют Streptococcus pneumoniae, Haemophilus influenzae, Streptococcus pyrogenes, Moraxella catarrhalis и Staphylococcus aureus. Однако в связи с применением конъюгированной пневмококковой вакцины при сохранении прежней частоты ОРС S. pneumoniae несколько теряет позиции с повышением значения H. Influenzae [4, 7]. Анаэробная флора чаще приводит взрослых к ОРС.
Диагностика
У детей ОРС называется воспаление слизистой оболочки полости носа и околоносовых пазух, характеризующееся острым началом с двумя или более симптомами, одним из которых должны быть заложенность носа или отделяемое (из носа или по задней стенке глотки), а также боль или чувство давления в областях проекции ОНП и/или кашель.
Кроме того, могут учитываться эндоскопические признаки и компьютерно-томографическая картина.
Проведение дифференциальной диагностики между острым поствирусным и бактериальным РС часто достаточно затруднительно. В EPOS (European position paper on rhinosinusitis and nasal polyps, 2012) выделены следующие признаки потенциально ОБРС.
Для постановки такого диагноза необходимо наличие трех или более симптомов:
- отделяемое из носа (с преобладанием одной половины носа) и гнойное содержимое в полости носа;
- выраженная локальная боль (с преобладанием одной стороны);
- лихорадка (> 38 °C);
- повышение СОЭ/уровня С-реактивного белка;
- «ухудшение после улучшения» или «вторая волна болезни».
С учетом возможности возникновения изначально тяжелого острого бактериального РС Американское общество по инфекционным болезням (IDSA – Infectious Diseases Society of America) [8] выделяет следующие три варианта клинического течения потенциально бактериального РС:
- начало с персистирующих симптомов ОРС в отсутствие какой-либо положительной динамики ≥ 10 дней;
- дебют с изначально тяжелой симптоматики (лихорадки ≥ 39 °С и гнойного отделяемого из носа или лицевой боли), продолжающейся 3–4 дня подряд;
- «ухудшение после улучшения» или «вторая волна болезни».
В подавляющем большинстве случаев ОРС разрешается спонтанно. Сохранение клинических признаков РС более 12 недель свидетельствует о хроническом процессе. Гнойные осложнения достаточно редки, но клиницист должен иметь настороженность в отношении таких симптомов, как периорбитальный отек или другие симптомы, требующие срочной консультации специалиста. К сожалению, несмотря на самопроизвольное разрешение большинства ОРС и редкость гнойных осложнений, на долю ОРС приходится до 20 % случаев назначения антибиотиков в педиатрической практике. Методы дополнительной визуализации, лабораторные исследования (уровень маркеров воспаления, бактериология), эндоскопия при ОРС не используются рутинно. Их следует применять при ухудшении состояния на фоне лечения, к пациентам групп риска, а также с исследовательской целью. Неосложненные случаи ОРС, диагностированные клинически, не требуют дополнительных методов исследования [4].
Такие методы визуализации, как рентгенография ОНП и ультразвуковое исследование, для диагностики ОРС неинформативны и не рекомендованы из-за большого числа как ложноположительных, так и ложноотрицательных результатов. Компьютерная томография имеет хорошую разрешающую способность для визуализации анатомии и патологических изменений со стороны ОНП, но не рекомендуется для рутинного применения при неосложненном течении ОРС в силу экономических причин и низкой чувствительности при дифференциальной диагностике вирусного и бактериального воспаления [9, 10].
В многочисленных исследованиях доказано, что применение системного антибиотика при неосложненном течении ОРС не ускоряет выздоровления и не рекомендовано [11]. Обзор базы данных Cochrane показал, что антибактериальная терапия ОРС (без уточнения этиологии) не намного превышает эффект по сравнению с плацебо. Более того, эффективность антибактериальных препаратов разных групп была практически одинаковой, что свидетельствует о низком терапевтическом эффекте антибактериальной терапии пациентов с неосложненным течением ОРС длительностью более 7 дней. У 80 % пациентов, не получавших системного лечения, симптомы заболевания купировались самостоятельно в течение 2 недель [12]. Антибиотик следует назначать детям с тяжелым и осложненным течением ОРС; ниже будет приведена схема выбора групп препаратов.
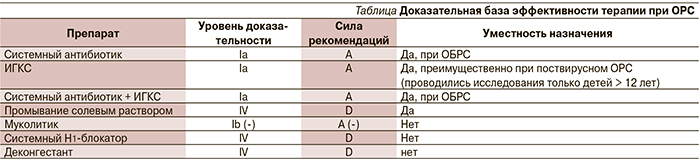
Доказано, что интраназальные глюкокортикостероиды (ИГКС) эффективны в качестве вспомогательной терапии при ОРС, они значительно ускоряют редукцию кашля, назальную обструкцию. Эти препараты рекомендовано использовать как при легком течении ОРС в качестве монотерапии, так и при тяжелом течении вместе с антибиотиком. Если течение ОРС не сопровождается аллергическим ринитом, не рекомендуется назначения как топических, так и системных антигистаминных препаратов. Обсуждается эффективность топических и пероральных деконгестантов. Большинство авторов отдают предпочтение топическим α2-адреномиметикам (окси-, ксилометазолин) в терапевтических дозах. Осторожное дозирование этих препаратов необходимо детям грудного и раннего возраста из-за возможности развития токсического эффекта. В отношении эффективности использования назального душа выяснено, что изотонический раствор температуры тела ускоряет элиминацию слизи и отека слизистой оболочки носа (см. таблицу) [4].
Острый средний отит
Еще одним частым осложнением респираторной вирусной инфекции является острый средний отит, определяемый как остро развившееся воспаление полостей среднего уха, которое проявляется одним или несколькими характерными симптомами (боль в ухе, лихорадка, наличие отделяемого из уха, снижение слуха; у детей – возбуждение, раздражительность, рвота, диарея) [13].
Наиболее подвержены развитию ОСО дети. По европейским данным, 90 % детей в возрасте до 5 лет переносят ОСО хотя бы однократно [14].
Помимо анатомо-физиологических особенностей к развитию ОСО могут предрасполагать вдыхание табачного дыма, сосание пустышки, а также кормление из бутылки в положении лежа.
На сегодняшний день в соответствии с мировыми тенденциями, подразумевающими, что педиатры также должны владеть навыками отоскопии, меняются и критерии постановки диагноза ОСО.
Диагностика основывается на наличии следующих признаков:
- умеренного или выраженного выбухания барабанной перепонки или появления отореи, не связанной с наружным отитом;
- легкого выбухания барабанной перепонки и недавнего (менее 48 часов) появления ушной боли или выраженной гиперемии барабанной перепонки. У грудных детей признаками ушной боли могут быть прижимание, подергивание или потирание ушной раковины [15].
Лечение ОСО
ОСО у детей в большинстве случаев возникает при наличии дисфункции слуховой трубы на фоне или после перенесенной острой респираторной вирусной инфекции, именно устранение этой причины должно быть обязательным условием лечения отита.
В связи с этим необходимо проведение таких мероприятий, как туалет полости носа с регулярным отсмаркиванием или при невозможности – аспирацией слизи, а также применение назальных деконгестантов. При наличии оталгии системно можно применять парацетамол или ибупрофен и как дополнение – теплые ушные капли, содержащие бензокаин, прокаин или лидокаин.
Системная антибактериальная терапия назначается в следующих случаях:
- детям старше 6 месяцев с тяжелым течением ОСО (умеренная или выраженная оталгия на протяжении как минимум 48 часов, лихорадки ≥ 39 °С);
- детям младше 2 лет с нетяжелым течением двустороннего ОСО при наличии умеренной оталгии длительностью менее 48 часов и температурой ниже 39 °С;
- у детей от 6 до 23 месяцев жизни с односторонним ОСО с теми же симптомами возможна двоякая тактика: либо назначение системного антибиотика, либо наблюдение ребенка с контролем отоскопической картины и назначением антибиотика при ухудшении или отсутствии улучшения состояния в период от 48 до 72 часов;
- та же тактика возможна у детей с 2 лет с одно- или двусторонним ОСО и теми же симптомами [15].
Тактика 72-часового наблюдения предлагается как американскими, так и японскими, а также канадскими национальными рекомендациями [16, 17].
Антибактериальная терапия ОРС и ОСО
С учетом основного, относительно постоянного спектра бактериальных возбудителей ОРС и ОСО (S. pneumoniae, H. influenzae и M. catarrhalis) [18] для их лечения предлагается одинаковая схема выбора антибактериального препарата. Стартовым антибиотиком служит амоксициллин в дозе 45 мг/кг/сут, в большинстве случаев стандартная доза амоксициллина эффективна.
Применение незащищенных аминопенициллинов ограничено в следующих ситуациях:
- предшествующая антибактериальная терапия в течение последних 6 недель;
- рецидив заболевания;
- посещение детских дошкольных учреждений или наличие в семье другого ребенка, посещающего детские дошкольные учреждения;
- антибиотикопрофилактика;
- отсутствие клинического эффекта
- в течение 72 часов;
- тяжелое и осложненное течение;
- подозрение на анаэробную инфекцию при ОРС.
Наличие приведенных ограничений или неэффективность стартовой терапии амоксициллином в течение 72 часов являются поводом к назначению амоксициллин/клавуланата в той же дозе по амоксициллину, активного в отношении микроорганизмов, продуцирующих β-лактамазу (36 и 38 % случаев при ОРС и ОСО соответственно) [19].
Постоянный рост циркуляции резистентных штаммов S. pneumoniae заставляет быть постоянно настороже в плане их этиологической значимости для ОРС и ОСО. В случае высокой вероятности наличия резистентного пневмококка доза как амоксициллина, так и амоксициллин/клавуланата (с использованием формы ЕС) должна быть увеличена до 80–90 мг/кг/сут. В России в этом плане ситуация более благоприятна по сравнению с США и Западной Европой. Рекомендации AAP (American Academy of Pediatrics, 2013) уже предполагают стартовую дозу амоксициллина не менее 80–90 мг/кг/сут [15].
В случае доказанной аллергической реакции на пенициллины приоритет отдается цефалоспоринам (цефуроксим/цефуроксим аксетил в дозе 30 мг/кг/сут или цефтриаксон в дозе 50 мг/кг/сут), т.к. перекрестная аллергия на пенициллины и цефалоспорины встречается крайне редко.
При наличии противопоказаний к применению обеих групп препаратов лечение может проводиться макролидами.
Длительность антибактериальной терапии
Длительность антибактериальной терапии ОБРС в случае впервые возникшего заболевания составляет 7–14 дней [4].
При ОСО возраст до 2 лет, а также тяжелое течение заболевания предполагают курс лечения не менее 10 дней. Детям от 2 до 5 лет показан 7-дневный курс антибактериальной терапии, который может быть сокращен при применении азитромицина и цефтриаксона, а также у детей старше 6 лет (5–7 дней) [15].
Острый тонзиллит
Острым тонзиллитом (ОТ) называется острое воспаление преимущественно небных миндалин, а также окружающей их ткани, которое протекает с гиперемией, наличием экссудата на миндалинах или без него и обычно сопровождается лихорадкой и реакцией регионарных лимфатических узлов.
Распространенность ОТ чрезвычайно высока, а боль в горле служит ведущей причиной обращения к врачу [20].
Наиболее частым этиологическим фактором ОТ является вирусная инфекция, и главную роль играют адено- и вирус Эпштейна–Барр. Значительно реже встречается бактериальный тонзиллит, при этом ключевой возбудитель – β-гемолитический стрептококк группы А – БГСА (15–30 %). Большинство случаев ОТ также заканчивается самопроизвольным разрешением. Однако стрептококковая инфекция является причиной тяжелых гнойных и негнойных осложнений, к которым относятся абсцессы глотки различной локализации, а также острая ревматическая лихорадка, ревматические болезни сердца, постстрептококковый гломерулонефрит и др. Возможность подобных осложнений привела к тому, что большинство авторов выделяют именно стрептококковый тонзиллит как повод к назначению системной антибактериальной терапии [21].
С учетом необходимости этиологической диагностики ОТ для правильного выбора лечения (т.е. назначения системного антибиотика при БГСА-инфекции и избегания нерационального использования антибиотика в других ситуациях) в принятой в настоящее время Международной классификации болезней 10-го пересмотра выделяют следующие формы заболевания в зависимости от этиологии: стрептококковый фарингит (J02.0), стрептококковый тонзиллит (J03.0), острый тонзиллит, вызванный другими неуточненными возбудителями (J03.8), и острый тонзиллит неуточненный (J03.9).
Проведение дифференциальной этиологической диагностики на основании клинической симптоматики крайне затруднительно. В большинстве случаев как вирусные, так и бактериальные тонзиллиты сопровождаются лихорадкой, налетами на небных миндалинах и увеличением шейных лимфатических узлов. Отсутствие налетов и легкое течение заболевания не исключают наличия стрептококковой инфекции. Однако для вирусных форм тонзиллита характерно наличие катаральных явлений, а гепатоспленомегалия патогномонична для инфекционного мононуклеоза. Сопутствующая вирусная ко-инфекция затрудняет диагностику стрептококкового тонзиллита. Еще одним помощником в дифференциальной диагностике может быть возраст ребенка. БГСА крайне редко вызывает ОТ у детей до 3 лет и практически никогда не выделяется в возрасте до 2 лет, а у детей старше 12 лет почти половина случаев ОТ обусловлена стрептококком [22].
Высокий уровень маркеров бактериального воспаления также не позволяет достоверно судить о причине заболевания, т.к. вирусные тонзиллиты нередко сопровождаются значительным повышением уровня лейкоцитов, С-реактивного белка и даже прокальцитонина, в то время как стрептококковый тонзиллит может протекать без каких-либо изменений со стороны гематологических показателей [21, 23].
Практически единственным достоверным методом этиологической диагностики ОТ является культуральное исследование материала с небных миндалин и задней стенки глотки благодаря высокой чувствительности и специфичности. Тем не менее проведение бактериологического исследования требует определенного времени. Для выделения БГСА необходимо около 24 часов, однако на практике это занимает несколько дней. Поэтому в настоящее время большое распространение получили экспресс-тесты для определения стрептококка группы А, основанные на латекс-агглютинации, которые рекомендуются большинством специалистов с целью диагностики стрептококкового тонзиллита благодаря скорости (результаты могут быть получены уже через 5–15 минут), их точности и невысокой стоимости [24].
Современные рекомендации по ведению пациентов с ОТ предполагают назначение симптоматической терапии в случае исключения БГСА и обязательное назначение системного антибиотика при диагностированной или с высокой долей вероятности подозреваемой стрептококковой инфекции [25].
С учетом 100 %-ной чувствительности S. pyogenes к пенициллину препаратом выбора при стрептококковом тонзиллите остаются феноксиметилпенициллин или амоксициллин при условии исключения Эпштейна–Барр вирусной инфекции. Амоксициллин назначают в дозе не ниже 45 мг/кг/сут. В случае клинической неэффективности незащищенных аминопенициллинов, что чаще обусловлено выработкой β-лактамаз флорой полости рта, лечение должно быть продолжено амоксициллин/клавуланатом в той же дозе. Наличие в анамнезе аллергической реакции на пенициллины должно быть поводом к назначению цефалоспоринов I–III поколений. Только в случае непереносимости обеих групп препаратов лечение должно проводиться макролидами. С учетом быстрого роста резистентности пиогенного стрептококка к 14- и 15-членным макролидам на сегодняшний день предпочтение должно отдаваться 16-членным [26].
Ошибками терапии ОТ могут быть необоснованное назначение/отказ от антибактериальной терапии, неадекватный выбор антибиотика, недостаточная длительность курса антибактериальной терапии (5,4 ± 2,8 дня), неадекватный путь введения, переоценка роли топической терапии и необоснованная госпитализация [27].
Таким образом, подавляющее большинство острых инфекций ЛОР-органов имеет вирусное происхождение и не требует назначения системного антибиотика. В настоящее время именно квалификация врача и хорошее владение мануальными навыками рино-, ото- и орофарингоскопии с правильной оценкой видимых изменений и назначением достаточно узкого спектра необходимых инструментально-лабораторных исследований позволяет назначать правильное лечение каждому конкретному пациенту и вносить лепту в решение проблемы современной медицины – глобального роста антибиотикорезистентности микробной флоры.
Амоксициллин/клавуланат является сегодня одним из важнейших препаратов, используемых для лечения бактериальных инфекций ЛОР-органов, его рекомендуют все ведущие руководства, основанные на позициях доказательной медицины. Для сохранения активности этого препарата в отношении большинства значимых микроорганизмов необходим тщательный анализ показаний к системному лечению того или иного заболевания, а также его назначение в адекватной дозе для достижения максимальной эффективности при минимальном риске побочных эффектов.
Первым отечественным препаратом амоксициллина/клавуланата для перорального приема стал Арлет® компании ОАО «Синтез». Более 50 лет ОАО «Синтез» выпускает широкий ассортимент антибактериальных лекарственных средств. Продукция компании соответствует международным стандартами производства и отвечает современным требованиям качества. Арлет® выпускается в форме таблеток, покрытых оболочкой в дозировках: 250 мг +125 мг; 500 мг + 125 мг, 875 мг + 125 мг.


