Понятие острого риносинусита, классификация, патогенез
Риносинусит (код Международной классификации болезней 10-го пересмотра – J 01) – одна из самых распространенных инфекций дыхательных путей, с одинаковой частотой встречается как в поликлинике, так и в стационаре [1]. В настоящее время считается, что любое воспаление слизистой оболочки носа (ринит) сочетается с воспалением слизистой оболочки околоносовых пазух (синуситом), поэтому все большее распространение получает термин «риносинусит». В соответствии с традиционной классификацией риносинуситов (РС), принятой в РФ и США, в целях оптимизации лечебной тактики выделяют острый РС (длительность < 4 недель): острый вирусный РС и острый бактериальный РС; подострый РС (длительность симптомов от 4 до 12 недель); хронический РС (длительность симптомов > 12 недель); острый рецидивирующий РС (более 4 эпизодов за год). Современные Европейские рекомендации EPOS (European position paper on rhinosinusitis and nasal polyps) 2012 г. выделяют острый РС, который подразделяется на острый вирусный и острый бактериальный; хронический РС с полипозом или без полипоза околоносовых пазух (продолжительностью симптомов более 12 недель) [2].
Острый риносинусит (ОРС) – острое воспаление слизистой оболочки носа и как минимум одной из околоносовых пазух (ОНП). ОРС обычно вызывается вирусами, иногда осложняется присоединением бактериальной инфекции. Такое состояние называется «острый бактериальный риносинусит» (ОБРС). Согласно рекомендациям EPOS (2012), ОРС у взрослых пациентов определяется как острое воспаление слизистой оболочки полости носа и ОНП (появившееся внезапно и продолжающееся не более 12 недель), характеризующееся наличием двух или более симптомов, из них обязательным симптомом является заложенность носа или наличие выделений из носа или по задней стенке глотки, а дополнительными признаками – боль или давление в области лица и гипо- или аносмия [3]. В Руководстве по ведению взрослых и детей с ОБРС Американского общества по инфекционным болезням IDSA (Infectious Diseases Society of America) предложены сходные, но более детализированные клинические критерии постановки диагноза риносинусита (табл. 1) [2]. Диагноз считается правомочным при наличии не менее двух «основных» или одного «основного» и не менее двух «дополнительных» симптомов [2].
На основании представленных критериев постановки диагноза становится очевидным, что понятие «острый риносинусит» охватывает широкий спектр различных нозологических состояний – от банальной острой респираторной вирусной (ОРВИ) до тяжелой бактериальной инфекции. При ОРВИ почти в 90 % случаев поражаются ОНП [4]. Это подтверждается данными рентгенологических исследований, при которых выявляется отек слизистой оболочки и застой секрета. Под воздействием вируса на мерцательный эпителий полости носа и ОНП эпителиальные клетки теряют реснички, эпителий становится рыхлым, развивается отек слизистой оболочки. Следствием этого становятся нарушение аэрации синусов, инактивация мукоцилиарного клиренса и скопление серозного экссудата в просвете синусов. Снижение скорости мукоцилиарного транспорта позволяет продлевать время контакта патогенных бактерий с клетками и способствует бактериальному инфицированию ОНП [5]. Таков механизм развития синусита.
Распространенность ОРС
Распространенность ОРС, несомненно, весьма велика. Считается, что каждый взрослый человек ежегодно переносит от 2 до 5 эпизодов ОРВИ, из которых 0,5–2,0 % осложняются ОБРС [5]. В США ежегодно регистрируется до 32 млн случаев РС, что соответствует поражению данной патологией 16 % взрослого населения страны [6]. Риносинуситы в значительной степени ухудшают качество жизни пациентов; например, только в США ежегодные прямые затраты составляют 5,8 млрд долл., при этом 30,6 % экономических издержек связаны с лечением риносинусита у детей в возрасте до 12 лет. Ежегодно число пациентов с воспалением ОНП увеличивается в среднем на 1,5–2,0 %. ОРС составляет от 9 до 20 % всех ЛОР-заболеваний детского возраста. Следует помнить, что ОРС может иметь серьезные осложнения, особенно в группе часто и длительно болеющих детей. В 10–22 % случаев синуситы могут приводить к орбитальным и в 1,4–2,1 % к внутричерепным осложнениям [7]. Большое опасение вызывают орбитальные осложнения ОРС, наиболее частые у детей, и составляют порядка 90 % всех осложнений.
Роль антибактериальной терапии при ОРС
Несмотря на обусловленность подавляющего большинства случаев ОРС вирусной инфекцией, антибактериальные препараты (АБП) назначаются почти в 80 % случаев при обращении пациента к врачу, что составляет более 20 % всех назначений антимикробных препаратов и делает ОРС пятой по частоте причиной назначения антибиотиков в амбулаторной практике [8]. В рекомендациях IDSA (2012) особо подчеркивается, что частота назначения АБП при ОРС представляется явно избыточной, с учетом того что, по данным плацебо-контролируемых исследований, около 70 % случаев ОРС заканчиваются выздоровлением без применения антибиотиков [9]. Поэтому одной из основных задач при ведении пациентов с ОРС считается выделение групп пациентов, которым показаны АБП.
Пациентам с ОБРС показана антибактериальная терапия (АБТ). Таким образом, основное место в дифференциальной диагностике вирусного и бактериального РС отводится анализу клинической картины заболевания.
На основании классической работы J.M. Gwaltney и соавт. [10], в которой было изучено естественное течение риновирусной инфекции, в качестве суррогатных критериев для постановки диагноза ОБРС были предложены:
- Сохранение симптомов заболевания более 7–10 дней.
- Появление «второй волны» симптомов после 5-го дня заболевания [2, 7].
К несомненному достоинству руководства IDSA (2012) относится включение третьего критерия для диагностики ОБРС и назначения АБТ с начала заболевания при выраженности симптомов (лихорадки ≥ 39 °C и гнойных выделений из носа), сохраняющихся в течение 3–4 дней от начала заболевания [2].
Основаниями выбора АБП для эмпирической терапии ОБРС должны служить прежде всего:
- высокая активность антибиотика in vitro в отношении основных возбудителей ОБРС и отсутствие клинически значимой антибиотикорезистентности;
- подтвержденная эффективность и безопасность в рандомизированных клинических исследованиях.
В РФ ведущими препаратами амбулаторного лечения ОБРС у взрослых и детей на сегодняшний день остаются аминопенициллины, однако не следует также забывать и о цефалоспоринах, которые мало чем отличаются, а по некоторым параметрам превосходят пенициллины.
Выбор цефалоспоринов для терапии ОРС
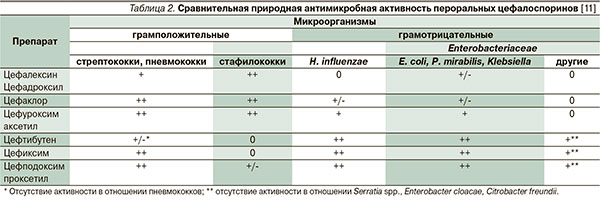
Цефалоспорины наравне с пенициллинами занимают ведущее место в практике врача-оториноларинголога. Цефалоспориновые антибиотики применяются в клинической практике с начала 1960-х гг., и за эти годы синтезировано более 50 препаратов этой группы. В настоящее время цефалоспорины могут выступать на первый план при лечении ОБРС как в стационаре, так и в амбулаторной практике; в большинстве случаев им отдается предпочтение в схемах начальной эмпирической терапии взрослых и детей. Сравнительная природная антимикробная активность цефалоспоринов в отношении основных патогенов ОБРС представлена в табл. 2 [11].
Успех терапии цефалоспоринами объясняется наличием широкого спектра их антимикробной активности, бактерицидным механизмом действия, лучшей защищенностью препаратов от β-лактамаз по сравнению с некоторыми другими группами антибактериальных средств; хорошей переносимостью, простотой и удобством дозирования.
В последние годы внимание врачей привлечено к полусинтетическому пероральному цефалоспориновому антибиотику III поколения цефиксиму. Цефиксим – первый пероральный цефалоспорин III поколения, применяемый в медицине с 1987 г. Цефиксим (Панцеф®, АЛКАЛОИД АО, Республика Македония) является высокоэффективным и безопасным препаратом при применении у детей с 6 месяцев, характеризуется удобным приемом дозирования – 1 раз в сутки. Цефиксим предназначен для перорального применения, характеризуется среднепролонгированной фармакокинетикой. Действует бактерицидно. Механизм действия обусловлен угнетением синтеза клеточной мембраны возбудителя. Он характеризуется широким спектром действия и высокой активностью в отношении Moraxella catarrhalis, Haemophilus influenzae, в т. ч. β-лактамазообразующих, при этом к цефиксиму чувствительны и штаммы H. influenzae, устойчивые к аминопенициллинам и цефалоспоринам I поколения. Препарат обладает также активностью в отношении широкого круга микроорганизмов, представляющих семейство Enterobacteriaceae. In vitro цефиксим активен в отношении грамположительных бактерий: Streptococcus agalactiae; грамотрицательных бактерий: Haemophilus parainfluenzae, Proteus vulgaris, Klebsiella pneumoniae, Klebsiella oxytoca, Pasteurella multocida, Providencia spp., Salmonella spp., Shigella spp., Citrobacter amalonaticus, Citrobacter diversus, Serratia marcescens. In vitro и в условиях клинической практики цефиксим активен в отношении грамположительных бактерий: Streptococcus pneumoniae, Streptococcus pyogenes; грамотрицательных бактерий: H. influenzae, M. (Branhamella) catarrhalis, Escherichia coli, Proteus mirabilis, Neisseria gonorrhoeae.
Панцеф® устойчив к действию β-лактамаз, продуцируемых большинством грамположительных и грамотрицательных бактерий. Антибиотик имеет замещающую гидроксиимино-аминотиазоловую боковую цепь в 7-й позиции. По сравнению с представителями I–II поколений цефалоспоринов это обеспечивает высокую стабильность к β-лактамазам широкого спектра действия – хромосомным (BRO-1 и BRO-2, продуцируемым M. catarrhalis) и плазмидным (TEM-1 и ROB-1, H. influenzae). Введенная метоксииминогруппа определяет дополнительную устойчивость к β-лактамазам грамотрицательных бактерий. Винильная группа в 3-й позиции обеспечивает улучшенную абсорбцию, но резко снижает антистафилококковую активность цефалоспорина. Именно благодаря введению винильной группы цефиксим не имеет кислого вкуса и характеризуется хорошей интестинальной переносимостью [12].
При приеме внутрь биодоступность препарата Панцеф® составляет 40–50 % независимо от приема пищи, максимальная концентрация достигается через 4 часа (табл. 3).
При приеме цефиксима вместе с пищей максимальная концентрация в сыворотке достигается быстрее на 0,8 часа. Связывание с белками плазмы, главным образом с альбуминами, составляет 65 %. Около 50 % дозы выводится с мочой в неизменном виде в течение 24 часов, около 10 % дозы выводятся с желчью. Период полувыведения зависит от дозы и составляет 3–4 часа. У пациентов с нарушениями функции почек (при клиренсе креатинина 20–40 мл/мин) период полувыведения увеличивается до 6,4 часа, при клиренсе креатинина 5–10 мл/мин – до 11,5. С фармакодинамической точки зрения эффективность цефиксима определяется временем, в течение которого концентрация несвязанного препарата в 4–5 раз превышает значение минимальной подавляющей концентрации (МПК) в очаге инфекции (ft > МПК). Для оптимального бактерицидного эффекта β-лактамного антибиотика необходимо, чтобы этот показатель перекрывал интервал между введениями не менее чем на 50–60 %.
С этой точки зрения цефиксим даже при однократном суточном приеме обеспечивает требуемые показатели в отношении основных респираторных возбудителей: H. influenzae (МПК для чувствительных штаммов ≤ 1 мкг/мл) [13], чувствительного к пенициллину S. pneumoniae (PSSP) (МПК ≤ 1 мкг/мл) и M. сatarrhalis.
Панцеф® характеризуется хорошей переносимостью. Побочные эффекты встречаются относительно редко в виде диареи, тошноты, кожной сыпи. Клинически значимых лекарственных взаимодействий препарата Панцеф® с другими лекарственными средствами не определяется.
У взрослых и детей старше 12 лет с массой тела более 50 кг суточная доза составляет 400 мг 1 раз в сутки или по 200 мг 2 раза в сутки. Детям в возрасте от 6 месяцев до 12 лет препарат назначают в виде суспензии в дозе 8 мг/кг массы тела 1 раз в сутки или по 4 мг/кг каждые 12 часов. Продолжительность курса лечения определяется лечащим врачом, однако применение АБП более 10 дней пациентам с неосложненным ОБРС не рекомендуется.
Пациентов с тяжелыми формами ОРС обычно госпитализируют и проводят ступенчатую терапию: вначале внутривенное введение (в течение 3–4 дней) амоксициллина/клавуланата или цефалоспоринов II–IV поколений, а затем пероральный прием того же или сходного по спектру активности препарата, например цефиксима. Длительность АБТ обычно составляет 7–10 дней [4].
Доказательства эффективности цефиксима при ОРС
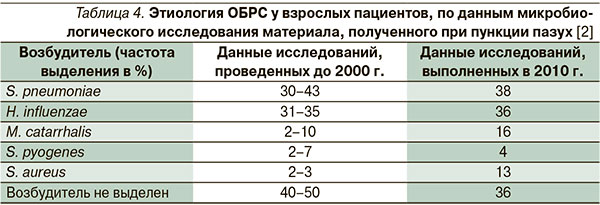
Цефиксим высокоэффективен в отношении основных возбудителей ОБРС. По данным многочисленных исследований, ОБРС вызывают т. н. респираторные патогены – S. pneumoniae, H. influenzae и M. catarrhalis, выявляемые у взрослых пациентов в 20–43 %, 22–35 и 2–10 % случаев, соответственно (табл. 4) [2, 12].
Наиболее значим из этих микроорганизмов, несомненно, пневмококк S. pneumoniae, т. к. частота спонтанной эрадикации данного патогена при ОБРС составляет всего 30 %, в то время как для H. influenzae и M. catarrhalis – 60 и 80 % соответственно, а для других возможных возбудителей (анаэробов, стрептококков, включая S. pyogenes и Staphylococcus aureus) вероятность спонтанной эрадикации составляет 50/50 [14].
Имеющиеся на сегодняшний день данные по антибиотикорезистентности перечисленных возбудителей существенно разнятся не только в различных странах мира, но даже в отдельных областях внутри страны [14–17]. В частности, по данным зарубежных исследований, в США отмечается высокая частота резистентности респираторных возбудителей к пенициллинам и макролидам [14, 15, 18]. Крайне высокие цифры резистентности отмечены в странах Юго-Восточной Азии (Китай, Корея, Тайвань). В частности, в многоцентровом исследовании P.R. Hsueh и соавт. [19] показали, что частота выделения пневмококков, не чувствительных к пенициллину, достигала 60 %; распространенность изолятов S. pneumoniae, резистентных к макролидам, составляла 91 %; а штаммов H. influenzae, вырабатывающих β-лактамазы и устойчивых к ампициллину, – 70 %.
В Европе отмечаются значительные географические различия в частоте резистентности респираторных патогенов к пенициллинам и макролидам: более благополучная картина наблюдается в скандинавских странах, в то время как в Испании, Греции и Франции частота выделения пневмококков, устойчивых к пенициллину и макролидам, составляет 25 % и более [20]. Сходная ситуация отмечается и с резистентностью штаммов H. influenzae [21]. Именно эти различия в распространенности антибиотико-резистентных штаммов объясняют отсутствие консенсуса между Европейскими и Американскими рекомендациями по терапии РС.
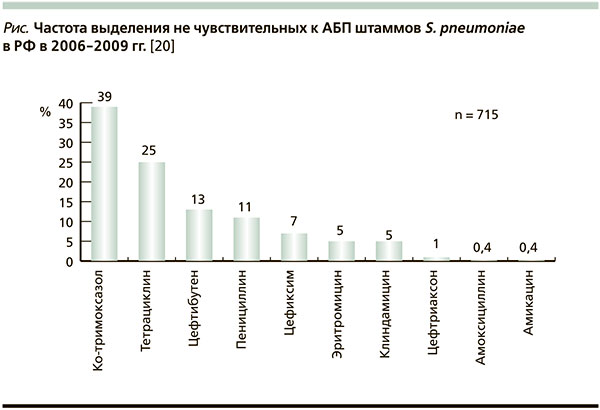
В РФ ситуацию с антибиотикорезистентностью респираторных возбудителей можно рассматривать как относительно благополучную [16, 17]. Частота выделения пневмококков, не чувствительных к пенициллину, в России в среднем составляет 11,2 %, причем основную массу (9,1 %) – штаммы с умеренной резистентностью к пенициллину (с МПК пенициллина 0,125–1,000 мг/л) [16]. Частота выделения пневмококков, не чувствительных к макролидам, в РФ также составляет около 10 % [16, 17]. В нашей странеотмечается, кроме того, высокая резистентность S. pneumoniae к тетрациклинам и ко-тримоксазолу. У штаммов гемофильной палочки, выделенных в РФ, частота продукции β-лактамаз, по данным различных исследований, варьируется от 5 до 9 % [17]. Среди изолятов H. influenzae также распространены штаммы, резистентные к ко-тримоксазолу. Активность цефиксима в отношении пневмококка достаточно высока. Цефиксим по уровню антипневмококковой активности превосходит цефтибутен. Цефиксим эффективно подавляет жизнедеятельность исключительно чувствительных к пенициллину штаммов [22]. Активность цефиксима в отношении пневмококка представлена на рисунке: только 6,8 % штаммов в 2006–2009 гг. были нечувствительными, при этом его МПК90, составившая 1 мг/л, находилась в диапазоне чувствительности [17].
При лечении больных ОБРС, вызванным H. influenzae, следует иметь в виду, что спонтанная эрадикация патогена (при применении плацебо) достигает 50 %. На этом фоне активность амоксициллина (38–63 % эрадикации при приеме в дозах 40–80 мг/кг/сут) не достаточна для подавления возбудителя. Если H. influenzae продуцирует β-лактамазы, эффективность амоксициллина составляет лишь 62 % случаев. Высокая активность цефиксима в отношении H. influenzae установлена довольно давно [23]. C течением времени антигемофильная активность цефиксима в отличие от ряда других β-лактамов не уменьшилась, что связывают с эффективным преодолением распространенных механизмов устойчивости и высокой степенью сродства к пенициллинсвязывающим белкам.
О высоком потенциале цефиксима свидетельствуют многие исследования, утверждающие, что в 2002–2004 гг. по антигемофильной активности цефиксим не уступал респираторным фторхинолонам, войдя в группу лидеров. Активность цефиксима в 32 раза превышает таковую цефуроксима и в 128 раз – цефаклора [12].
Цефиксим является эффективным АБП для терапии ОБРС, вызванного редкими возбудителями, такими как стрептококки группы А и С, зеленящие стрептококки, пептострептококки, другие моракселлы и Eikenella corrodens. Около 90–98 % клинических штаммов M. catarrhalis синтезируют β-лактамазы, преимущественно хромосомные BRO-1, BRO–2. Цефиксим эффективно противостоит гидролизу, сохраняя неизменно высокую активность в отношении возбудителя [12].
Данные клинических исследований цефиксима
Результаты российских и зарубежных исследований подтверждают высокую эффективность цефиксима при лечении ОБРС как у взрослых, так и у детей [24–27]. Проведенное в Индии открытое многоцентровое исследование оценки эффективности, переносимости и безопасности цефиксима для 209 взрослых пациентов с диагнозом ОБРС или обострения хронического синусита, продемонстрировало в 90 % случаев хорошую эффективность препарата. Около 89,5 % пациентов сообщили об очень хорошей его переносимости. Клиническое выздоровление было достигнуто в 99,9 % случаев. Таким образом, данное исследование подтверждает отличную эффективность цефиксима в лечении пациентов с синуситом. Эти результаты сопоставимы с таковыми лечения цефиксимом в дозе 400 мг перорально в 2 приема [24].
Аналогичная работа по эффективности и безопасности цефиксима была показана в США в многоцентровых клинических исследованиях с участием 118 взрослых пациентов с ОРС или обострением хронического синусита. Пациенты получали цефиксим в суточной дозе 400 мг однократно в течение 10 дней. Завершили исследование 106 пациентов. Клиническое выздоровление и улучшение были достигнуты 90 % пациентов после проведенного лечения. При повторной оценке состояния здоровья пациентов спустя 2 недели после завершения лечения у 91 % наблюдалось длительное клиническое выздоровление или улучшение. До приема препарата всем пациентам были выполнены пункции верхнечелюстных пазух: патогены были выделены из 76 (66 %) синусов, наиболее распространенными возбудителями оказались гемофильная палочка, α-гемолитический стрептококк, пневмококк. Данная терапия цефиксимом привела к эрадикации возбудителя в 86 % случаев. Цефиксим был эффективным АБП при лечении ОБРС у взрослых и хорошо переносился ими [25].
В рамках открытого исследования, включившего 73 взрослых пациента с подтвержденным ренгенологически диагнозом ОБРС, которые получали цефиксим 400 мг/сут в течение 10 суток, клиническая и бактериологическая эффективность составила 84 %. Гемофильная палочка, пневмококк и Branhamella (Moraxella) стали основными возбудителями ОБРС, что составило 65 % от всех бактериальных изолятов. Микробиологическая эрадикация составила 84 % после лечения. При последующих контрольных визитах пациентов после завершения АБТ цефиксимом рецидивов ОБР не наблюдалось [26].
По данным исследования, проведенного в Венгрии, эффективность лечения цефиксимом инфекций дыхательных путей при приеме 1 раз в сутки составила 100 % у детей, страдавших ОБРС, 92,6 % у больных острым тонзиллофарингитом, 96,0 % у пациентов с острым гнойным средним отитом, 98 % при обострении хронического бронхита, 100 % при пневмонии [27].
Отечественные авторы продемонстрировали высокую эффективность цефиксима в лечении больных различными формами синуситов, в т. ч. на фоне бронхиальной астмы [28]. Частота положительных результатов терапии цефиксимом превышала таковую при лечении амоксициллином и цефазолином и была сопоставимой с таковой для амоксициллина/клавуланата [29].
Заслуживает внимания исследование, проведенное М.А. Панякиной и соавт. по оценке эффективности и безопасности применения препарата цефиксим (Панцеф®) больными ОБРС. Под наблюдением находились 83 пациента (49 женщин и 34 мужчины) в возрасте от 18 до 56 лет (средний возраст – 34,5 ± 6,2 года) с диагнозом ОБРС, подтвержденным клинико-анамнестическими данными и результатами лабораторно-инструментальных методов исследования. В группе 1 (38 пациентов) схема лечения предусматривала применение амоксициллина/клавуланата перорально в дозировке 875/125 мг 2 раза в сутки, в группе 2 (45 пациентов) назначали цефиксим перорально в дозировке 400 мг 1 раз в сутки. Согласно полученным результатам, в основной группе выраженность симптомов ОБРС достоверно уменьшилась к 3-м суткам терапии, положительная динамика клинических проявлений прогрессировала к 5-м суткам и стабильно сохранялась к 7-му дню лечения. Для пациентов группы сравнения динамика клинических данных была аналогичной, что позволило достичь сравнимой итоговой эффективности лечения в обеих группах (р > 0,05). Вместе с тем цефиксим характеризовался лучшим профилем безопасности за счет меньшего числа побочных эффектов со стороны желудочно-кишечного тракта по сравнению с амоксициллином/клавуланатом. Высокая приверженность лечению цефиксимом обеспечивается возможностью однократного приема препарата и не влияет на итоговую эффективность лечения [30]. Возможность однократного приема – важное свойство препарата Панцеф®, обеспечивающее высокую приверженность пациентов к лечению, что несомненно обеспечивает его эффективность. Последнее заключение исходит из фармакокинетической/фармакодинамической концепции, к основному требованию которой относится надежное перекрытие тканевой концентрацией препарата МПК для возбудителя в течение определенного времени [31].
Таким образом, важнейшее значение при ОРС имеет немедленно начатое лечение и правильно подобранная терапия с высокой клинической и бактериологической эффективностью. Пероральные цефалоспорины III поколения существенно расширили возможности лечения ОРС в стационаре и амбулаторной практике, позволили разработать более экономичную систему лечения за счет резкого сокращения сроков парентерального введения антибиотиков путем перехода на пероральные формы цефалоспоринов того же ряда. АБП в оториноларингологической практике должны быть высокоэффективными, безопасными и хорошо переноситься пациентами. Рациональное использование антибиотиков предупреждает развитие резистентности, уменьшает продолжительность заболевания и предупреждает развитие осложнений. Высокая бактериальная эффективность, хорошая переносимость, удобство перорального приема позволяют рекомендовать цефиксим, в частности препарат Панцеф®, к использованию в оториноларингологической практике лечения ОРС.