Термин «синдром раздраженной толстой кишки» приписывается У.К. Альваресу, в 1915 г. в своей оригинальной статье описавшему локальное повышение тонуса кишки и изменение характера перистальтики кишечника, приводящие к изменению транзита в ответ на раздражающие стимулы [3].
Впоследствии общепринятым названием заболевания стало «синдром раздраженного кишечника» (СРК). Этот термин подчеркивает тот факт, что суть заболевания выходит далеко за рамки ободочной кишки. Как видно, название стало долговечным, потому что оно довольно неспецифично и не указывает, какая часть кишечника является раздраженной или что вызывает это раздражение, а формулировка «синдром» предполагает полисимптомность [1].
Мысль о единстве патогенеза определенного набора кишечных симптомов и необходимости выделения их в самостоятельный синдром впервые возникла у N.A. Chaudhary и S.P. Truelove в 1962 г. [8]. Затем в 1978 г. A.P. Manning постарался выделить наиболее достоверные для клинической диагностики синдрома симптомы и их сочетания, в дальнейшем получившие название «критерии Маннинга», которые в течение двух десятилетий использовались для отбора пациентов с СРК в многочисленных эпидемиологических и клинических исследованиях, включая интервенционные [17]. Затем была череда пересмотров критериев синдрома, получивших название Римских, последний из которых состоялся в 2006 г. И надо полагать, с учетом растущего количества публикуемых исследований, посвященных изучению патогенеза СРК, «не за горами» четвертый пересмотр Римских критериев.
Почему же, несмотря на почти вековую историю существования концепции СРК, у медицинского сообщества все еще возникают вопросы относительно его трактовки, диагностики и лечения?
Для специалиста, интересующегося функциональной патологией органов пищеварения, не секрет, что среди практикующих врачей, а порой и научных сотрудников, как это ни странно, до сих пор существует недостаточно четкое представление о СРК. Этот емкий и понятный даже для пациентов термин несет нечто большее, чем «раздражение в кишечнике». К сожалению, даже врачи разных специальностей понимают СРК по-разному. Главной причиной такого «расхождения во мнениях» служит отсутствие общепринятой тактики использования международных диагностических критериев, составленных интернациональными экспертными группами на основании данных эпидемиологических и клинических исследований.
Причин игнорирования диагностических критериев СРК немало, среди них следует отметить следующие [1]:
- несовершенство любых критериев (отсутствие 100 %-ной чувствительности и специфичности);
- модификация критериев во времени, адаптация к которой в системе вузовского и послевузовского образования запаздывает;
- отличия в программах преподавания и интерпретации критериев для клиницистов и врачей диагностических служб;
- вариабельность клинических проявлений СРК;
- схожесть проявлений разных функциональных заболеваний желудочно-кишечного тракта (ЖКТ), частое их сочетание (перекрест симптомов), что затрудняет дифференцирование отдельных форм;
- однотипность реакции кишечника на различные раздражающие стимулы, что лежит в основе похожих клинических проявлений при лимфоцитарном колите, язвенном колите в периоде эндоскопической ремиссии (т. н. СРК-подобный симптомокомплекс), клинически дифференцировать которые довольно сложно.
Все больше критики звучит и в отношении самих Римских критериев. Все чаще нам напоминают о неспецифичности набора симптомов СРК и призывают не пропускать органическую патологию ЖКТ, формально и шаблонно относясь к применению критериев в клинической практике. Известно, что СРК не сопровождается репрезентативным риском развития органической патологии. Однако, по данным 15-летнего наблюдения за 112 пациентами (Олмстед Каунти, Миннесота, США) с установленным диагнозом СРК, только у 10 из них впоследствии была выявлена органическая патология ЖКТ [23]: в 2 случаях – хронический панкреатит, у 4 больных – гастроинтестинальный рак различной локализации, у 2 – подострая кишечная непроходимость и у 2 – язвенная болезнь желудка.
Все это лишний раз подтверждает актуальность рассматриваемой проблемы, необходимость дальнейшего ее изучения и пересмотра легкомысленного отношения к ней со стороны большинства наших коллег.
Несмотря на широкую освещенность проблемы СРК в российских периодических изданиях, нам хотелось бы еще раз напомнить о Римских диагностических критериях и современном принципе классификации синдрома. Итак, согласно последнему определению, СРК – это функциональное расстройство кишечника, при котором боль или дискомфорт в животе связаны с дефекацией, изменениями частоты и характера стула или другими признаками нарушения опорожнения кишечника [10].
Диагностические критерии* СРК (Римские критерии III) представлены следующими положениями:
Рецидивирующая боль или дискомфорт ** в животе по крайней мере 3 дня в месяц за последние 3 месяца, связанные с 2 или более из нижеследующих признаков:
- улучшение после дефекации;
- начало связано с изменением частоты стула;
- начало связано с изменением формы стула.
Дополнительные симптомы:
- патологическая частота стула (менее 3 раз в неделю или более 3 раз в день);
- патологическая форма стула (комковатый/твердый стул или жидкий/водянистый стул);
- натуживание при дефекации;
- императивный позыв на дефекацию или чувство неполного опорожнения, выделение слизи и вздутие.
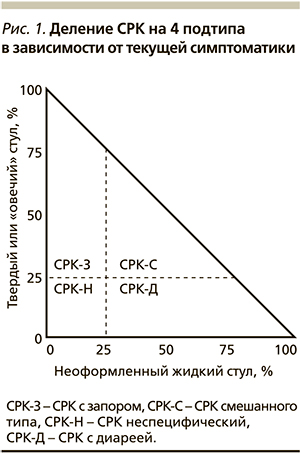 Хотелось бы отметить важность постулата о должном присутствии указанной симптоматики «в течение последних 3 месяцев с началом симптомов не менее 6 месяцев до того», что просто обязывает клинициста наблюдать пациента с предположительным диагнозом СРК в течение этого срока, оценивая доброкачественность течения заболевания, а также исключая симптомы «тревоги», хорошо известные врачам под названием «синдром малых признаков» (см. таблицу).
Хотелось бы отметить важность постулата о должном присутствии указанной симптоматики «в течение последних 3 месяцев с началом симптомов не менее 6 месяцев до того», что просто обязывает клинициста наблюдать пациента с предположительным диагнозом СРК в течение этого срока, оценивая доброкачественность течения заболевания, а также исключая симптомы «тревоги», хорошо известные врачам под названием «синдром малых признаков» (см. таблицу).
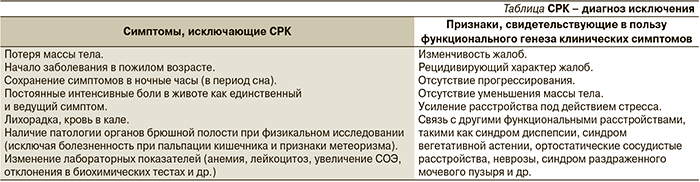
В предыдущих попытках классифицировать СРК упорно выделялся вариант с преобладанием боли, что, на наш взгляд, уже по определению противоречило формулировке дефиниции синдрома. Ведь СРК – это непременно совокупность боли или дискомфорта и кишечных расстройств, а следовательно, болевой синдром, если речь идет о СРК, должен присутствовать a priori при любом варианте.
В настоящее время предложена классификация СРК, основанная на Бристольской шкале формы стула, согласно которой выделяют четыре типа заболевания на основании преобладающего симптома:
- СРК с преобладанием диареи;
- СРК с преобладанием запора;
- СРК с чередованием этих симпто-мов – смешанный или альтернирующий тип;
- неспецифическая форма СРК (рис. 1) [10].
Связано это с тем, что именно форма стула, а не его частота объективно позволяет дифференцировать диарею от запора. Однако важным условием при этом является исключение приема больным каких-либо слабительных или, наоборот, антидиарейных препаратов, что может существенно исказить истинную картину заболевания.
Реальная распространенность каждого из этих типов не установлена, но, согласно эпидемиологическим исследованиям, вариант с преобладанием диареи встречается более часто, достигая 49 % [4, 15]. Смешанный вариант и вариант с преобладанием запора встречаются соответственно в 26 и 25 % случаев [15].
Таким образом, несмотря на несовершенство предлагаемых на сегодняшний день инструментов для постановки диагноза СРК, думающий и нежелающий навредить своему больному лечащий врач как минимум обязан строго следовать предлагаемому алгоритму действий, непременно оставляя за собой право на клиническую мысль.
Эпидемиология
По данным систематических обзоров, распространенность СРК в мире варьируется от 3 до 20 %, чаще колеблясь между 10 и 15 % [31]. Более 80 % обследованных пациентов находятся в возрасте 18–54 года, и 64 % из них составляют женщины. Интересно, что в США более чем для 3/4 пациентов с СРК-подобным симптомокомплексом окончательный диагноз долго остается неустановленным.
Негативное влияние симптомов СРК на ежедневную деятельность и качество жизни пациентов может быть весьма существенным. Исследование Real World [15], проведенное Международным фондом изучения функциональных расстройств ЖКТ (IFFGD – The International Foundation for Functional Gastrointestinal Disorders), показало, что почти половина пациентов с диагнозом СРК испытывают ежедневные симптомы. Среди респондентов 26 % пропустили по крайней мере 1 день работы или учебы в течение предшествующих 3 месяцев (в среднем 7,9 дня), и 68 % на день отказались от личных планов (в среднем 10,5 дней) из-за своей болезни. Почти 90 % пациентов с СРК с преобладанием диареи сообщали о появлении абдоминальной боли, метеоризма и других неотложных состояний, связанных с дисфункцией кишечника, и нарастании тяжести этих симптомов, мешающих повседневной деятельности и снижающих качество их жизни. Снижение качества жизни пациентов с тяжелыми симптомами СРК может быть сопоставимо или даже более выраженно, чем у лиц, страдающих сахарным диабетом, депрессией, даже воспалительными заболеваниями кишечника и хронической сердечной недостаточностью [14, 18].
Патофизиология СРК
Патофизиология СРК еще до недавнего времени рассматривалась как проблема, не имеющая структурного и анатомического объяснения. Какими фактами относительно патогенеза СРК и «раздраженности» кишечника мы располагаем на сегодняшний день?
Прежде всего, СРК демонстрирует семейную наследуемость. При углубленном генетическом исследовании близнецов в Вирджинии было показано, что у монозиготных близнецов (17 %) СРК выявляется чаще, чем у дизиготных (8 %) [16]. Однако в том же исследовании так же убедительно была продемонстрирована важность социальных факторов, в частности наличие матери, страдающей СРК, становится более сильным прогностическим фактором развития синдрома у ребенка, чем дизиготные близнецы с СРК. Исследования одиночных нуклеотидных полиморфизмов (SNP) также предполагают генетическое влияние. Бóльшая часть больных СРК по сравнению с контрольной группой (46 против 26 %) являются гетерозиготными – по -308 (G/A) SNP – и продуцируют более высокие уровни фактора некроза опухоли α [30].
Демонстрация того, что висцеральная гиперчувствительность встречается среди 94 % больных СРК, была основана на комбинации результатов низкого порога болевой чувствительности и завышенного висцеросоматического болевого ответа на растяжение прямой кишки при проведении баллонно-дилатационного теста [20]. Результаты этого исследования дали основание говорить о выявлении биологического маркера СРК, поскольку попытки выявить ректальную гиперчувствительность в группах больных другой патологией ЖКТ не приводили к таким же высоким результатам, достигая в среднем 50 % [6]. Это, собственно, и объясняет симптоматику синдрома, ассоциированную непосредственно с болью как ведущим симптомом заболевания.
Вторым толкованием «раздражительности» кишечника может служить нарушение его моторной функции. Так, по данным ряда исследований, примерно у половины пациентов с СРК с преобладанием диареи транзит по ободочной кишке значительно ускорен, а у каждого пятого больного с преобладанием запора – замедлен [7, 19]. До сих пор даже в условиях клинического исследования убедительно разделить эти два механизма в каждом конкретном случае не удается; кроме того, неоспоримой остается взаимосвязь кишечной дисфункции с психологическими факторами. Таким образом, в настоящее время по-прежнему общепринята т. н. биопсихосоциальная концепция патогенеза СРК, в соответствии с которой его клиническую картину формируют вышеупомянутые механизмы, тесно связанные с психологическими и физиологическими факторами.
Лишь в последние годы после выделения особой формы СРК, названной «постинфекционный СРК» (ПИ-СРК), когда особое внимание было уделено изучению морфологической картины биоптатов слизистой оболочки ободочной кишки, стало понятно, что говорить о СРК как о заболевании, не имеющем структурных изменений, уже не приходится [1].
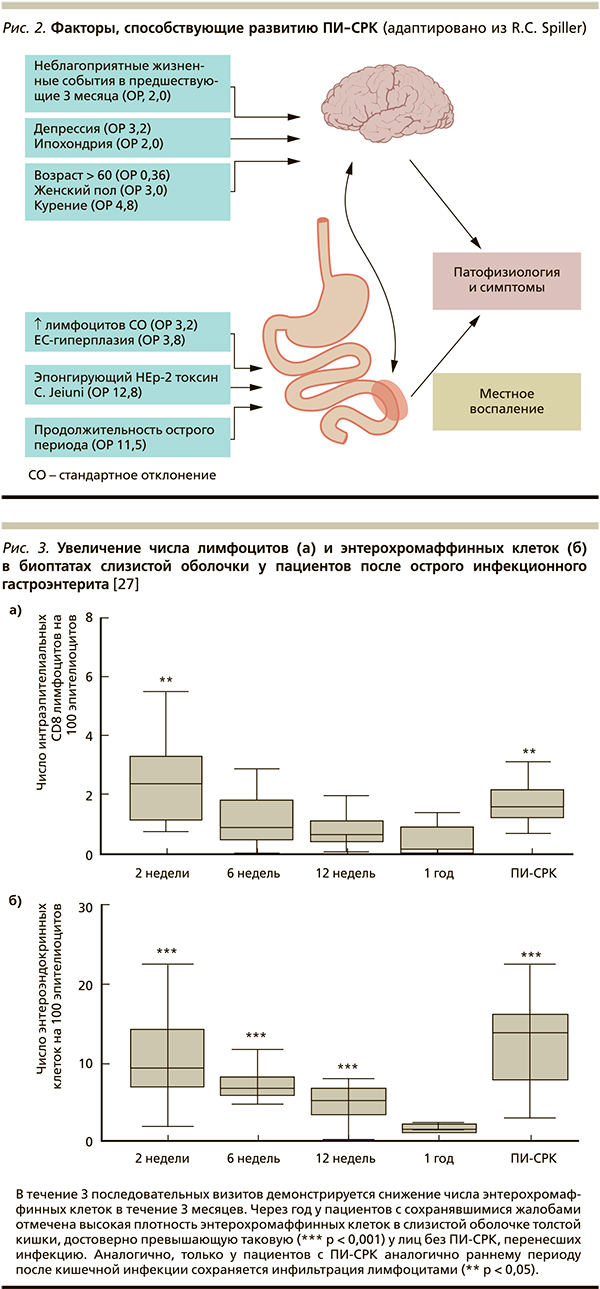
К факторам риска развития этой формы СРК относятся вирулентность возбудителя, молодой возраст, женский пол, длительность заболевания и наличие психологических расстройств (рис. 2) [28]. Результаты нескольких исследований подтверждают, что высокий уровень стресса, наличие депрессии (относительный риск [ОР] = 3,2) и ипохондрии (ОР = 2,0), неблагоприятные жизненные события в предшествующие 3 месяца (ОР = 2,0) – все это увеличивает риск развития ПИ-СРК. Факторы слизистой оболочки также важны, и каждое стандартное отклонение при увеличении числа Т-лимфоцитов и энтерохромаффинных (ЕС) клеток повышает риск развития ПИ-СРК в 3,2 и 3,8 раза соответственно. Возраст старше 60 лет «защищает» от формирования ПИ-СРК (ОР = 0,36), возможно, из-за возрастного снижения иммунного ответа, в то время как курение увеличивает риск в 4,8 раза, и этот факт пока остается без объяснений.
К наиболее частым возбудителям, после инфицирования которыми формируется устойчивый симптомокомплекс, получивший название ПИ-СРК, относятся Campylobacter, Salmonella, Shigella и Novovirus. Изучение серий биоптатов после перенесенного инфекционного гастроэнтерита продемонстрировало наличие воспалительного инфильтрата в cлизистой оболочке с увеличением числа ЕС, который в большинстве случаев уменьшался лишь спустя 6 месяцев (рис. 3) [27]. Кроме того, показано, что через 3 месяца после эпизода инфекционной диареи у больных с последующим развитием ПИ-СРК в биоптатах слизистой оболочки толстой кишки достоверно бóльшим было число ЕС, Т-лимфоцитов и тучных клеток по сравнению с теми пациентами, у которых ПИ-СРК не развился. Таким образом, для пациентов подгруппы ПИ-СРК характерно наличие диарейного синдрома и увеличение в слизистой оболочке толстой кишки числа ЕС, богатых серотонином. Помимо серотонин-опосредованного пути формирования ПИ-СРК в недавних исследованиях доказан и цитокиновый механизм. Суть его заключается в следующем: Th2-цитокины посредством влияния на уровни циклооксигеназы-2 и простагландина Е2 в гладкой мускулатуре кишечника вызывают ее повышенную сократимость. Этот факт находит свое отражение в новых подходах к лечению этой формы СРК.
Поскольку патофизиология СРК на протяжении последних десятилетий неразрывно рассматривалась как взаимодействие в системе «головной мозг–кишка», проводили исследования не только ЖКТ, но и периферической, а также центральной нервных систем. Прежде всего это касалось изучения механизма восприятия и центральной обработки болевых импульсов. Восприятие боли тесно связано с изменением эмоциональной модуляции афферентных сигналов и недостаточностью кортикальной активации системы, ингибирующей боль, и согласуется с классической теорией боли, согласно которой сенсорный и аффективно-когнитивный компоненты играют важную роль в ее ощущении.
При детальном исследовании влияния перенесенного эмоционального стресса оказалось, что его действие опосредуется через изменения, происходящие в рецепторном аппарате структур головного мозга. В частности, снижается количество глюкокортикоидных рецепторов в гипоталамусе, гиппокампе и фронтальной части коры головного мозга, уменьшается количество ингибиторных пресинаптических α2-адренергических рецепторов в locus coeruleus. Поскольку locus coeruleus тесно взаимосвязан с кортиколиберин-секретирующими нейронами, изменение количества α2-адренергических рецепторов может приводить к нарушениям в функционировании гипоталамо-питуитарно-адреналовой системы и как следствие – восприятия боли.
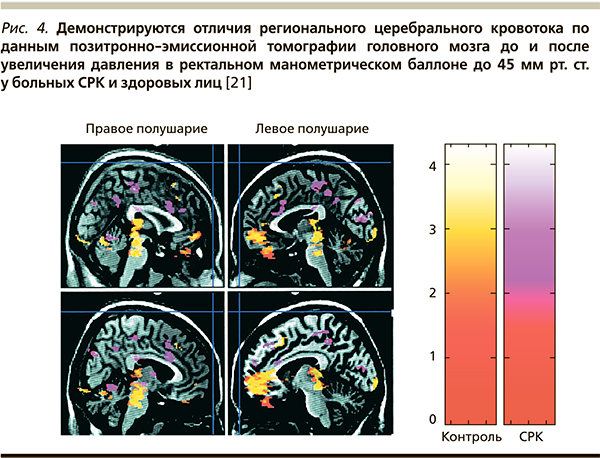
Так, при изучении изменения кровотока в головном мозге во время баллонно-дилатационного теста посредством позитронно-эмиссионной томографии выяснилось, что пациенты с СРК «иначе», чем здоровые добровольцы, воспринимают болевой стимул, причем как во время ожидания растяжения, так и в ответ на само растяжение баллоном [21]. Рис. 4 наглядно демонстрирует изменение кровотока в различных областях головного мозга у пациентов с СРК по сравнению с контрольной группой. Авторы исследования пришли к выводу, что измененные вегетативные и ноцицептивные ответы на болевую стимуляцию у больных СРК могут быть связаны с изменениями в центральной норадренергической системе.
Также следствием стресса, перенесенного в раннем возрасте, служит нарушение в серотонинергической системе в виде снижения чувствительности ингибиторных пресинаптических 5-HT1A-рецепторов фронтальной части коры, ответственных за снижение чувствительности к растяжению кишки [2].
Таким образом, из представленных данных видно, насколько близко подошли ученые к объяснению механизма висцеральной гиперчувствительности у больных СРК, которая проявляется не только снижением порога восприятия боли, но и более интенсивным ощущением боли на слабый стимул или даже восприятием боли в ответ на неболевой стимул. Последнее явление получило название «аллодиния». Предполагается, что висцеральная гиперчувствительность часто формируется в результате т. н. сенсибилизирующих факторов (например, перенесенной кишечной инфекции, психоэмоционального стресса, физической травмы и др.). Повторяющиеся стрессы сопровождаются, с одной стороны, моторной дисфункцией кишечника, с другой – на фоне повышенной рецепторной реакции в кишечнике вырабатываются афферентные стимулы, достигающие по чревному и блуждающему нервам центральных подкорковых и корковых отделов центральной нервной системы и в дальнейшем приводящие к развитию феномена спинальной гипервозбудимости. Последний характеризуется тем, что обычные по силе раздражители (например, растяжение кишечника небольшим количеством газа) вызывают усиленный болевой ответ. Формируется порочный круг, в котором стимуляция кишечных рецепторов, имеющих сниженный порог чувствительности, приводит к возникновению боли, вызывающей в свою очередь развитие стресса, способствующего высвобождению адреналина и энкефалинов в надпочечниках, которые обусловливают дальнейшую сенситизацию (снижение порога чувствительности) рецепторов и продолжение ощущения боли.
Подводя итог вышесказанному, надо заметить, что, несмотря на существенные достижения клинической медицины в области патофизиологии боли при СРК, диагностический поиск причин боли и оптимального их устранения до сих в реальной жизни представляет существенные трудности. Так, по данным Всемирной организации гастроэнтерологов и эндоскопистов, к началу XXI в. точность диагностики этиологических факторов абдоминальной боли составляла всего 50 %. При этом время, которое требовалось на верификацию диагноза от момента начала болевого синдрома, варьировалось от 8 до 37 недель [13]!
Лечение СРК
Переходя к вопросам терапии СРК, в частности воздействия на его главный симптом – боль, несмотря на описанные выше сложные механизмы ее возникновения, хочется вновь продемонстрировать, что нам предлагается в Римских критериях III для ее купирования. Необходимо также напомнить, что непрекращающиеся до настоящего времени попытки разработать эффективную схему терапии СРК с пролонгированным действием пока не дали результата ни для одного варианта течения заболевания. Очевидно, это связано с тем, что проблема поиска и объективной оценки эффективности того или иного препарата очень непроста из-за многофакторности патофизиологии СРК и достаточно высокого эффекта плацебо у этой группы пациентов.
Для купирования болевого синдрома при СРК (Римские рекомендации III) рекомендуются следующие группы препаратов:
- Миорелаксанты.
- Трициклические антидепрессанты.
- Селективные ингибиторы обратного захвата серотонина (СИОЗС)
Миорелаксанты при лечении СРК назначаются российскими врачами наиболее часто. Согласно рекомендациям Всемирной гастроэнтерологической организации, из этой группы лекарственных средств на сегодняшний день к безопасному и эффективному применению рекомендованы следующие миотропные спазмолитики: гиосцина бутилбромид (Бускопан), циметропиум, пинаве-риум [31].
Как известно, рекомендации различных научных обществ основаны на доступных доказательных фактах, добытых в различных клинических и/или экспериментальных исследованиях. На чем же основаны рекомендации по купированию болевого синдрома при СРК, какова их доказательная база? Ввиду недостаточного количества высококачественных исследований, проводимых во всем мире, посвященных изучению эффективности и безопасности специфических спазмолитиков, оценка использования препаратов этого класса при СРК сегодня возможна только на основании анализа результатов исследований в систематических обзорах и мета-анализах. Так, по результатам мета-анализа, опубликованного в 2001 г. и включившего 23 клинических исследования и 6 препаратов группы миорелаксантов, включая зарегистрированные и известные в нашей стране гиосцина бутилбромид, пинавериума бромид и тримебутин, было показано глобальное улучшение состояния и уменьшение боли у пациентов с СРК в 56 и 53 % случаев соответственно по сравнению с группой плацебо – 38 и 41 % соответственно, при этом разница в результатах оказалась статистически достоверной (p < 0,01 в обоих случаях) [24].
В другом мета-анализе, посвященном оценке эффективности спазмолитиков и ряда других лекарственных средств и опубликованном в 2008 г., A. Ford и соавт. пришли к следующему выводу: «псиллиум и спазмолитики (особенно гиосцина бутилбромид) значительно превосходят плацебо при лечении СРК; врачам следует рассматривать псиллиум и спазмолики (предпочтительно гиосцина бутибромид) как средство первой линии в лечении СРК» [11]. По данным этой работы, наиболее убедительные доказательства эффективности были получены для гиосцина бутилбромида (Бускопана), который получали более 400 пациентов, вошедших в исследование, и для того чтобы предотвратить сохранение симптомов у одного пациента, требовалось пролечить гиосцина бутилбромидом 3,5 больных (NNT – число пациентов, которых необходимо пролечить, чтобы получить эффект у 1 из них).
Вскоре после публикации этих данных к вышеописанным выводам присоединился Британский Национальный институт здравоохранения и клинического совершенствования (NICE – National Institute for Health and Clinical Excellence), который в своих официальных рекомендациях, касающихся ведения пациентов с СРК, указывал на необходимость применения «спазмолитических агентов, и в первую очередь гиосцина бутилбромида, на фоне изменения диеты и образа жизни».
Специальная комиссия Американской коллегии гастроэнтерологов также изучила этот вопрос, подвергнув анализу 22 клинических исследования [5]. Оказалось, что каждое из них содержало достаточно много методологических ошибок, включая используемые диагностические критерии, критерии включения, применяемый режим дозирования лекарственных препаратов, а также длительность терапии, оценку конечных точек исследования и число пациентов, включенных в исследование (лишь в 3 из них сообщалось более чем о 100 пациентах).
С учетом этих ограничений анализу были подвергнуты данные 1778 пациентов с СРК. Обобщение результатов показало, что коэффициент риска неэффективности спазмолитиков по сравнению с плацебо составил 0,68 (95 % доверительный интервал [ДИ] – 0,57–0,81), а NNT равнялось 5. При оценке риска развития побочных эффектов при приеме спазмолитиков выявлено, что они наблюдались у 1379 больных. С учетом значительной гетерогенности этой группы пациентов коэффициент риска развития побочных эффектов составил 1,62 (95 % ДИ – 1,05–2,50), а NNT – 18 (95 % ДИ 7–217). В 2009 г. комиссия Американской коллегии гастроэнтерологов, подведя итоги анализа, заключила: «некоторые спазмолитики (гиосцина бутилбромид, циметропиум и пинавериум) могут давать кратковременный эффект по купированию боли или дискомфорта при СРК (уровень доказательности 2С), доказательств длительной эффективности нет (уровень доказательности 2В), доказательства безопасности и переносимости ограничены (уровень доказательности 2С)».
Лишь в систематическом обзоре, посвященном оценке эффективности мебеверина при лечении СРК, включившем 8 рандомизированных клинических исследований, 6 из которых были плацебо-контролируемыми с общим числом участников 555 (63 % женщин), было показано, что мебеверин, пожалуй, единственный из миорелаксантов рассматриваемой группы не продемонстрировал статистически значимой разницы по сравнению с плацебо [9]. Подобные выводы прозвучали и в Кокрейновском систематическом обзоре, самом независимом источнике информации для медицинского сообщества, опубликованном в 2011 г., в котором также на основании изучения данных мета-анализа статистически сравнивалась эффективность использования различных представителей группы спазмолитиков с плацебо [25]. Главным критерием было влияние препаратов на абдоминальную боль и общее улучшение. В итоге группа спазмолитиков показала свою эффективность и в том, и в другом случае.
Как видно из представленных данных, клиническая польза от применения спазмолитических средств в борьбе с болевым синдромом при СРК неоспорима, но весьма далека от совершенства с точки зрения недостаточно высокого результата в достижении 100 %-ного эффекта. Вопрос о возможном влиянии препаратов этой группы на одно из основных звеньев СРК – висцеральную гиперчувствительность, на сегодня остается дискутабельным и скорее отрицательным, что опять же подтверждается их недостаточно высокой эффективностью.
В сложившейся ситуации практикующему врачу при лечении пациента с СРК среди прочих равных по эффективности остается выбрать спазмолитик, обладающий высоким профилем безопасности. К таким препаратам, без сомнения, можно отнести Бускопан, зарегистрированный на фармацевтическом рынке более 50 лет назад и в большинстве стран мира доступный к безрецептурному отпуску (OTC – over-the-counter). Не проникая через гематоэнцефалический барьер и в результате не оказывая влияния на центральную нервную систему, имея абсолютную биодоступность менее 1 % и одновременно к мускариновым и никотиновым рецепторам вследствие высокой аффинности, Бускопан распределяется главным образом в гладкомышечных клетках органов брюшной полости и малого таза, а также в интрамуральных ганглиях органов брюшной полости [29]. За счет таких фармакокинетических свойств он реализует свой спазмолитический эффект, практически не вызывая побочных реакций, частота возникновения которых сопоставима с плацебо [12, 22, 26].
В заключение хотелось бы еще раз отметить, что СРК, являясь междисциплинарной проблемой, сопровождается низким риском развития органической патологии и на пути к установке правильного диагноза требует строгого соответствия критериям и наблюдения в течение не менее полугода. Рассматриваемая группа спазмолитиков, и в частности гиосцина бутилбромид, безусловно эффективна и безопасна при лечении СРК. Однако большинству практических врачей, сталкивающихся с проблемой курации больных СРК, в настоящее время абсолютно понятно, что добиться успеха, назначая какой-либо один вид лечения, практически невозможно. Описанная выше многокомпонентность патофизиологии СРК «подсказывает» нам необходимость комбинации спазмолитиков с препаратами пребиотического действия, средствами, регулирующими работу кишечника и др., при недостаточной эффективности которых требуется присоединение трициклических антидепрессантов. При этом надо заметить, что контролируемых исследований с подобным дизайном пока нет. И поэтому, рассматривая тот или иной препарат для включения его в лечебную схему, необходимо опираться на доказательную базу его эффективности и безопасности применения в монотерапии.


