Неблагоприятные факторы окружающей среды – причина эпигенетической модификации, приводящей к экспрессии аллергии. Вполне закономерно, что распространенность пищевой аллергии, как и распространенность астмы, во всем мире растет по мере урбанизации.
В различных регионах распространенность аллергии к белкам коровьего молока варьируется, достигая 17 % [1], а по официальным статистическим данным, распространенность данной патологии составляет лишь 2–3 %. Возникновение столь значительной разницы статистических данных обусловлено различиями в популяционных исследованиях и отсутствием четких диагностических критериев аллергии к белкам коровьего молока. К сожалению, опубликованных исследований распространенности пищевой аллергии крайне мало, что осложняется также смешиванием понятий непереносимости лактозы и аллергии к белку коровьего молока, встречающихся в некоторых регионах. В дальнейшем использование четких диагностических критериев позволит своевременно ставить диагноз и оберегать детей от ненужной диеты [2].
Аллергия к белкам коровьего молока (АБКМ) может развиваться как у младенца, находящегося на грудном вскармливании, так и у ребенка, получающего адаптированную молочную смесь. При данной патологии развитие клинической картины может быть различным, а симптомы – непатогномоничными. Проявления в основном отмечаются на уровне желудочно-кишечного тракта (50– 60 %), кожи (50–60 %) и дыхательных путей (20–30 %) [3] и варьируются от легкой и умеренной степени до тяжелой.
Различают следующие клинические проявления АБКМ:
Тяжелые проявления:
Желудочно-кишечный тракт:
- железодефицитная анемия;
- энтеропатия;
- диарея;
- упорные срыгивания и рвота фонтаном.
Кожа:
- тяжелый атопический дерматит.
Дыхательные пути:
- отек гортани.
Генерализованные проявления:
- анафилаксия;
- отек Квинке;
- отставание в росте.
Проявления легкой и средней степеней тяжести:
Желудочно-кишечный тракт:
- запор;
- колит;
- колики/боль в животе.
Кожа:
- атопический дерматит;
- ангиоотек;
- крапивница.
Дыхательные пути:
- ринит;
- одышка и свистящее дыхание.
Глазные симптомы:
- конъюнктивит.
Общие симптомы:
- раздражительность.
Патогенез
Аллергия к белкам коровьего молока может быть как иммуноглобулинЕ(IgE), так и не-IgE-обусловленной [4]. Наиболее частой является IgEопосредованная реакция немедленного типа, которая может быть подтверждена обнаружением в сыворотке специфических IgE, а при наличии соответствующих аллергенов – с помощью прик-теста (по рекомендациям зарубежных исследователей проводятся у детей старше 6 месяцев).
Клеточный иммунный ответ и/или смешанная иммунная реакция, в которой и антитела, и иммунные клетки играют одинаково важную роль, обусловливают развитие не-IgEопосредованной реакции. Такой тип реагирования является наиболее трудным для диагностики.
Клинически выделяют два типа АБКМ: немедленного и отсроченного типа. Немедленный тип развивается сразу после приема белка коровьего молока (крапивница, ангиоотек, рвота, острое обострение атопического дерматита) и присутствует более чем у половины пациентов с АБКМ [5]. У таких детей наиболее вероятно выявление АБКМ с помощью определения титра специфических IgE.
Еще одной немедленной реакцией на пищу является индуцированный пищевыми протеинами синдром энтероколита, обусловленный клеточным иммунным ответом пациентов с отрицательным титром специфических IgE. Этот синдром выделяют отдельно у пациентов раннего возраста с тяжелыми желудочно-кишечными проявлениями и метаболическим ацидозом.
Объем коровьего молока, необходимый для возникновения немедленной реакции, варьируется от 1 капли до 150 мл и более, что свидетельствует о том, что некоторые пациенты переносят значительное количество молока до появления симптомов [6]. Отсроченные реакции: кожные или желудочно-кишечные проявления (проктоколит, энтеропатия), как правило, развиваются через неколько часов или дней.
Проявления АБКМ могут отражать участие в аллергическом процессе различных органов и систем. Гастроинтестинальная пищевая аллергия может сопровождаться повышенным газообразованием, срыгиванием, симптомами мальабсорбции и зачастую не-IgE-опосредованна. Воспалительный процесс обусловлен активацией Т-лимфоцитов, повышенным высвобождением интерферона-γ и фактора некроза опухоли-α. Среди клинических проявлений возможны индуцированные пищевыми протеинами энтероколит и проктоколит, что наиболее часто становится причиной ректального кровотечения в раннем возрасте. Также возможно развитие эозинофильного эзофагита. Длительный процесс приводит к развитию недостаточной обеспеченности микронутриентами, хронической диарее и задержке роста. Вторичная атрофия ворсинок кишечного эпителия ведет к дисахаридазной недостаточности. Сложность диагностики такого состояния состоит в крайне ограниченных диагностических возможностях и сходстве симптомов с патологией желудочно-кишечного тракта.
Достаточно часто наблюдается ситуация, когда у пациента атопический дерматит сопровождается пищевой аллергией либо эти заболевания составляют во времени этапы атопического марша. Особенно это характерно для пациентов с тяжелым персистирующим атопическим дерматитом. Понимание механизмов генетических изменений при кожных проявлениях аллергии пролило свет на механизм их взаимоотношений. Мутации гена филаггрина в хромосоме 1q21 ассоциируются с тяжелым персистирующим атопическим дерматитом (27 %), высоким риском возникновения астмы и аллергией к арахису. Необходимо помнить, что тяжелый кожный процесс в раннем возрасте – признак пищевой аллергии. Такие проявления могут быть как IgE-, так и не-IgEобусловленными. Вовремя скорректированный рацион, необязательно подкрепленный какими-либо тестами или обследованиями, помогает предотвращать развитие атопического дерматита в дальнейшем.
Диагностика
Полностью подтвердить или исключить наличие АБКМ ни один из диагностических тестов, доступных в обычных клинических ситуациях, не может [6]. Ключевыми элементами диагностического процесса являются анамнез, включая семейный анамнез атопии, а также тщательное клиническое обследование. По данным зарубежных исследователей, прик-тесты (даже со свежим коровьим молоком или экстрактом белков коровьего молока), специфические IgEили патчтесты могут просто указывать на сенсибилизацию к субстрату, что необязательно является доказательством аллергической реакции. По данным A.J. Costa и соавт. [7], чувствительность и специфичность прик-тестов к белкам коровьего молока составляют 31,8 и 90,3 % соответственно, а определение титров специфических IgE – 20,5 и 88,9 % соответственно. Таким образом, обязательным условием аллергодиагностики с определением специфических IgE является тщательный анализ клинико-анамнестических данных.
С возрастом АБКМ проходит в 30– 79 % случаев при IgE-опосредованном процессе [3]. В данной ситуации последовательное определение титров IgE может подтверждать угасание аллергического процесса. Если титр специфических IgE в сыворотке и/или приктесты на момент установления диагноза отрицательные, толерантность развивается в более раннем возрасте и риск острой реакции невелик. Напротив, стойкие высокие титры специфических IgE увеличивают риск развития других атопических болезней: таких как астма, риноконъюнктивит и атопический дерматит.
За рубежом стандартом диагностики АБКМ является двойной слепой плацебо-контролируемый провокационный тест [8]. Двойное слепое плацебо-контролируемое провокационное исследование – единственный объективный показатель определения диагноза. К сожалению, это дорого, требует серьезной подготовки, занимает много времени и трудновыполнимо, а тяжесть симптомов, которые могут возникнуть, предсказать довольно сложно.
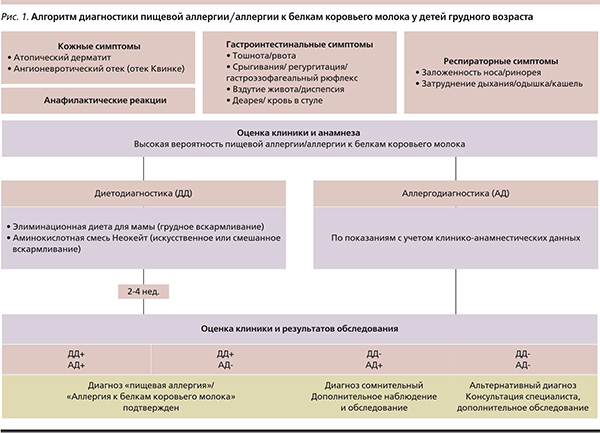
В связи с этим оптимальным методом диагностики в клинической практике считают диагностическую элиминационную диету. Разработан алгоритм [8] с использованием диетодиагностики (рис. 1): пациент с подозрением на АБКМ в течение 2–4 недель находится на безмолочной диете. Дети, находящиеся на искусственном вскармливании, получают аминокислотную смесь. Если ребенок находится на грудном вскармливании, из диеты матери исключают все продукты, содержащие белок коровьего молока. При наличии АБКМ клинические проявления со временем купируются. По данным некоторых исследователей, использование данного метода повышает риск переоценки диагноза [9], однако тщательно собранный анамнез, анализ рациона ребенка и кормящей матери исключают излишнее назначение элиминационной диеты.
Спустя некоторое время (до 6 месяцев) белок коровьего молока постепенно вводят в рацион ребенка.
Дифференциальная диагностика
Длинный список потенциальных дифференциальных диагнозов АБКМ включает рецидивирующие вирусные инфекции и преходящую непереносимость лактозы. В то же время такие симптомы, как беспокойство и срыгивание, наблюдаются среди 20 % всех детей как с АБКМ, так и в ее отсутствие. С другой стороны, гастроэзофагеальный рефлюкс может быть проявлением АБКМ, которая также может оказаться причиной кишечных колик; по данным некоторых исследований, сенсибилизация к белкам коровьего молока в 10 % случаев является причиной колик [3].
У части пациентов определяется корреляция АБКМ и атопического дерматита, хотя во многих случаях они не связаны между собой. Чем младше ребенок и/или более тяжелый атопический дерматит, тем сильнее связь. Однако реакция на другие продукты питания (в частности, яйца и соя, пшеница, рыба, арахис) происходят чаще, особенно в сочетании с АБКМ. Таким образом, следует избегать введения прикорма во время диагностической элиминационной диеты.
Ведение пациентов с АБКМ
Принципы ведения пациентов с АБКМ различаются у детей на грудном и искусственном вскармливании.
Грудное вскармливание является «золотым» стандартом кормления и рекомендуется по крайней мере в течение первых шести месяцев жизни [10]. Лишь около 0,5 % младенцев, находящихся на исключительно грудном вскармливании, имеют легкие или умеренные проявления АБКМ. Тяжелые и угрожающие жизни состояния у таких пациентов крайне редки и требуют дополнительного обследования для исключения сопутствующей патологии.
Матери рекомендуется соблюдать строгую безмолочную диету, что зачастую требует дополнительной консультации диетолога для обеспечения сбалансированности питания и адекватного потребления кальция (1000 мг в день). Клинический опыт показывает, что такие продукты, как яйца, арахис, рыба и пшеница, присутствуя в рационе матери, могут вызывать дополнительную сенсибилизацию ребенка и поддерживать симптомы пищевой аллергии.
Если после элиминационной диеты симптомы купировались, белок коровьего молока вводят в рацион матери через 2–4 недели (начиная с кисломолочных продуктов). В том случае когда проявления у ребенка АБКМ уже не отмечаются при переводе матери на обычную диету – мать может продолжать получать свой рацион. Однако если проявления пищевой аллергии возникнут вновь – белок коровьего молока следует исключить из рациона матери на весь период грудного вскармливания.
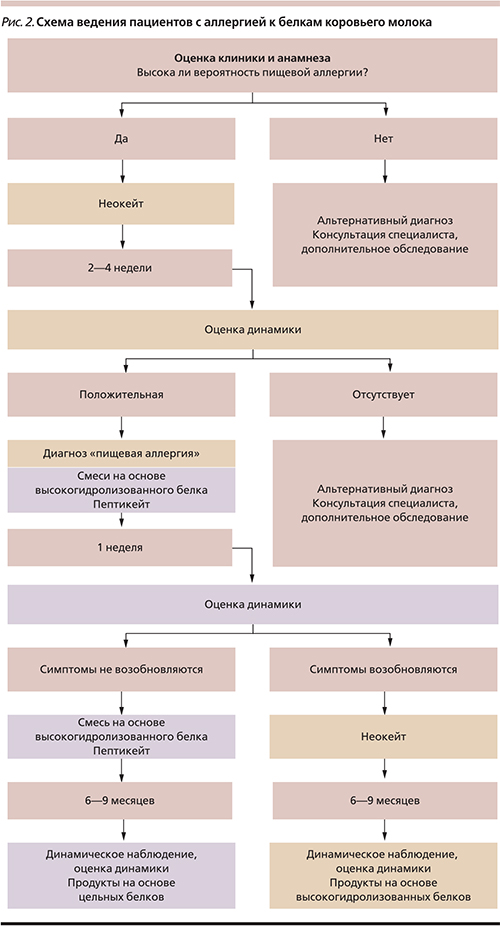
Для детей на искусственном вскармливании с проявлениями АБКМ легкой и средней степеней тяжести лечебная смесь является терапией первой линии (рис. 2). Гипоаллергенной лечебной считается только смесь, которая не вызывает аллергических реакций у 90 % детей с пищевой аллергией (рекомендации ESPGHAN – European Society for Pediatric Gastroenterology, Hepatology, and Nutrition & ESPACI – European Society for Paediatric Allergology and Clinical Immunology). Этому условию удовлетворяют только смеси на основе полностью гидролизованного белка и аминокислотные смеси (Неокейт). Однако смеси на основе высокогидролизованного белка в 10–20 % случаев не облегчают состояния детей с АБКМ, что требует назначения полностью безбелковой аминокислотной смеси. Лечебное питание назначают на 14–28 дней; когда симптомы аллергии уменьшатся, можно перейти на смесь-гидролизат. Если симптомы возобновляются, необходимо вернуться к аминокислотной смеси.
Во время лечебной элиминационной диеты прием другой пищи необходимо исключить, чтобы избежать неправильного толкования проявлений, связанных с действием других аллергенов. Остаточные симптомы АБКМ могут отмечаться еще некоторое время и не обусловлены IgE. Дальнейшая безмолочная диета рекомендуется на протяжении минимум 6 месяцев.
Детям с тяжелыми проявлениями АБКМ, находящимся на искусственном вскармливании, должна быть назначена аминокислотная смесь (рис. 2) [8]. Для таких пациентов аминокислотная формула – самая эффективная элиминационная диета. Лечебное питание сводит к минимуму риск потери массы тела и отставания в развитии.
Пациенты с опасными для жизни, особенно дыхательными, симптомами анафилаксии, должны быть направлены в стационар и находиться под круглосуточным наблюдением.
Смеси на основе немодифицированного белка (козье, кобылье молоко, соевые смеси) или частично гидролизованного белка не следует использовать в качестве лечения пищевой аллергии у детей грудного возраста (особенно у детей первых 6 месяцев). Из-за высокой перекрестной реактивности (до 80 %) и риска неадекватности восполнения питательных веществ использование молока большинства животных исключается. Перекрестная сенсибилизация к сое отмечается среди 17,3 % детей с АБКМ независимо от того, выявлялся ли у данных пациентов титр специфических IgE к белкам коровьего молока [5]. Распространенность аллергии к сое сравнима с АБКМ [11]. В частности, дети с поливалентной пищевой аллергией и эозинофильным энтероколитом также реагируют на соевый белок. Таким образом, не рекомендуется назначать соевые смеси детям с АБКМ, особенно в возрасте младше 6 месяцев.
Потенциал гипоаллергенных смесей для лечения и профилактики пищевой аллергии определяется в клинических исследованиях с использованием специальных протоколов. Неокейт имеет 25-летнюю доказательную базу лечения различных проявлений АБКМ, пищевой аллергии, атопического дерматита и включен в Международные и Российские рекомендации и руководства.
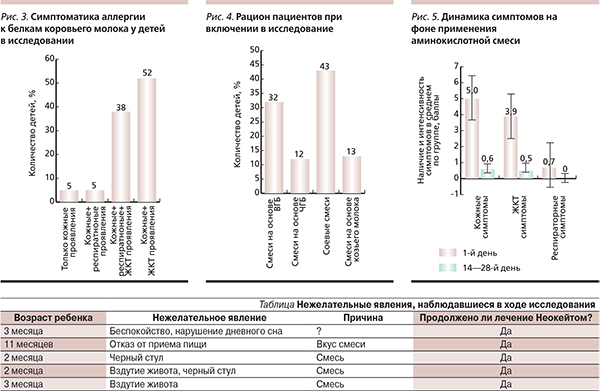
Эффективность, безопасность и хорошая переносимость смеси не только доказаны зарубежными исследователями, но и подтверждены отечественными наблюдениями. Исследование с участием 60 детей с различными проявлениями АБКМ (рис. 3), находившихся на искусственном вскармливании, было проведено в 2010 г. в Научном центре здоровья детей РАМН. До обращения к педиатру/неонатологу дети получали различные смеси (рис. 4). Всем детям на 14–28-й день была назначена аминокислотная смесь (Неокейт). Динамика симптомов на фоне лечения представлена на рис. 5. Пятьдесят восемь (97 %) из 60 детей завершили курс диетотерапии с положительным результатом. Нежелательные явления отмечены у 5 (8 %) детей (см. таблицу), отменить лечение пришлось в двух случаях: одному ребенку – из-за отсутствия эффекта и в одном случае – по социальным причинам.
Через 14–28 дней 54 (90 %) ребенка были переведены и показали хорошую переносимость смесей на основе высокогидролизованного белка (85 % детей получали высокогидролизованную смесь). Принимать аминокислотную смесь продолжили 6 (10 %) детей.
Формула данной смеси – это 100 % свободных аминокислот, что исключает взаимодействие с иммунной системой. Ее использование открыло перспективу быстрого и эффективного лечения тяжелых форм пищевой аллергии у грудных детей, а также неинвазивной и доступной диетодиагностики АБКМ.
Аминокислотная смесь позволяет аллерго-скомпрометированным детям излечиться самостоятельно.


