Введение
Сахарный диабет 2 типа (СД2) часто сочетается с другими заболеваниями – ожирением, дислипидемией, артериальной гипертензией. Это объясняется тем, что одной из причин развития
этих патологических состояний является инсулинорезистентность (ИР). Однако в последнее время с ИР связывают еще одно заболевание, которое встречается у 60–80 % пациентов с СД2, – это неалкогольная жировая болезнь печени (НАЖБП) [1–4].
В своей практике эндокринолог часто сталкивается с синдромом цитолиза неясной этиологии, что требует проведения диагностического поиска и установления причины повышения активности трансаминаз. Известно, что именно НАЖБП является одной из основных причин хронического синдрома цитолиза и самым распространенным заболеванием печени в популяции во все мире [1–4].
С точки зрения науки и практики НАЖБП – достаточно “молодое” заболевание, и если история изуче-
ния диабета насчитывает тысячелетия, то термины “неалкогольная жировая болезнь печени” и “неалкогольный стеатогепатит” получили свою самостоятельность как нозологические единицы только в 1980 г., когда Ludwig и соавт. описали морфологические изменения в печени, характерные для
алкогольного поражения, у лиц, не употребляющих алкоголь в гепатотоксичных дозах [5]. Однако, несмотря на “молодость” заболевания, уже сейчас есть данные исследований, которые свидетельствуют, что НАЖБП не всегда протекает доброкачественно и может быть связана не только с повышенным риском развития цирроза печени и гепатоцеллюлярной карциномы, но и со значительным риском возникновения сердечно-сосудистых заболеваний (ССЗ), особенно среди
пациентов с СД2 [2, 3, 6, 7].
На примере клинической задачи рассмотрим вопросы диагностики и лечения пациента с сд2 и нАЖБП
Клиническая задача
Пациент 51 года, преподаватель. СД2 выявлен случайно 2 недели назад при проведении диспансеризации. При лабораторном исследовании были также обнаружены повышение активности АЛТ,
АСТ и дислипидемия.
Анамнез. Из сопутствующих заболеваний артериальная гипертензия (в течение 5 лет). Не курит. Алкоголь – 3–4 бокала вина в неделю. СД2 у отца. Постоянно принимает лизиноприл, индапамид.
Объективный осмотр. Рост – 175 см, масса тела – 94 кг, ИМТ – 30,7 кг/м2, АД – 150/90 мм рт. ст., ЧСС – 78 ударов в минуту.
Лабораторное обследование. HbA1c – 7,1 %, ГПН – 8,3 ммоль/л, ППГ – 11,4 ммоль/л, липидный спектр: ХС – 5,9 ммоль/л, ЛПНП – 2,8 ммоль/л, ЛПВП –1,2 ммоль/л, ТГ – 2,4 ммоль/л, креатинин сыворотки – 96 мкмоль/л, АЛТ – 79 ЕД/л, АСТ – 85 ЕД/л, СКФ (MDRD) –76 мл/мин, микроальбуминурия – 16 мг/сут.
Инструментальные методы. УЗИ: печень не увеличена, контур ровный, эхогенность повышена, сосуды четко не визуализируются, очаговых изменений нет; селезенка не увеличена; поджелудочная железа не увеличена, контуры ровные, структура неоднородная; ЭКГ:ЧСС – 76 в минуту, ритм синусовый,
признаки гипертрофии левого желудочка.
Осмотр невролога: снижение вибрационной чувствительности.
Осмотр офтальмолога: гипертоническая ангиопатия сетчатки.
Представление о пациенте: перед нами пациент с впервые выявленным СД2, синдромом цитолиза неясной этиологии и признаками изменения печени, по данным ультразвукового исследования.
Необходимо определить тактику ведения данного пациента, а также установить причину цитолиза и изменений в печени.
Примечание. АЛТ – аланинаминотрансфераза, АСТ – аспартатаминотрансфераза, ИМТ – индекс массы тела, АД – артериальное давление, ГПН – глюкоза плазмы натощак, ППГ – постпрандиальная глюкоза,
ХС – холестерин, ЛПНП – липопротеиды низкой плотности, ЛПВП – липопротеиды высокой плотности, ТГ – триглицери ды, СКФ – скорость клубочковой фильтрации, ЧСС – частота сердечных сокращений,
HbA1c – гликированный гемоглобин.
Прежде чем решать данную задачу, давайте обсудим, что же такое НАЖБП и почему именно о данном заболевании печени в первую очередь необходимо думать пациенту с СД2?
НАЖБП: определение
НАЖБП представляет собой группу заболеваний печени, которые развиваются у пациентов, не употребляющих алкоголь в гепатотоксичных дозах.
Понятие НАЖБП включает как простой стеатоз без повреждения гепатоцитов, так и неалкогольный стеатогепатит (НАСГ) с возможным развитием фиброза, цирроза печени, а также гепатоцеллюлярной карциномы. НАЖБП может иметь прогрессирующее течение – от стеатоза (накопления триглицеридов более чем в 5 % гепатоцитов) до НАСГ (стеатоз + воспаление) и цирроза печени (рис. 1) [3, 8].
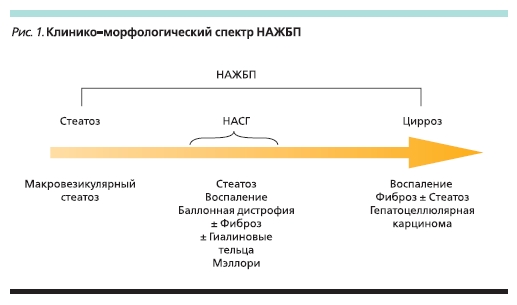
Определение НАЖБП включает два основных критерия, необходимых для установления диагноза: наличие стеатоза, подтвержденного данными визуализационного или гистологического исследования, и отсутствие причин для вторичного накопления жира в гепатоцитах, таких как злоупотребление алкоголем, наследственные заболевания, прием стеатогенных лекарственных препаратов [3]. Причинами развития вторичного стеатоза печени могут быть:
Макровезикулярный стеатоз
• избыточное потребление алкоголя;
• гепатит С (генотип 3);
• болезнь Вильсона;
• липодистрофия;
• голодание;
• парентеральное питание;
• абеталипопротеинемия;
• прием лекарственных препаратов (амиодарон, метотрексат, тамоксифен, кортикостероиды и др.).
Микровезикулярный стеатоз
• синдром Рейе;
• острая жировая дистрофия печени беременных;
• HELLP-синдром;
• прием лекарственных препаратов (вальпроат, антиретровирусные препараты).
• врожденные нарушения метаболизма липидов (болезнь Вольмана, дефицит активности лецитин-холестеринацилтрансферазы и др.) [3].
Согласно определению, НАЖБП подразумевает развитие патологического процесса в условиях отсутствия злоупотребления алкоголем. Однако точное определение гепатотоксичной дозы остается до сих пор не совсем ясным. В научной литературе, посвященной проблеме НАЖБП, значение
гепатотоксичной дозы алкоголя колеблется от 1 алкогольной единицы (≈ 10 граммов этанола на один прием) до 40 граммов этанола в день [9]. В настоящее время Американская гастроэнтерологическая ассоциация (AGA – American Gastroenterological Association) в своих рекомендациях предлагает в клинической практике считать употребление более 21 алкогольной единицы для мужчин и более 14 единиц для женщин в среднем в неделю существенным и рассматривать возможность алкогольного поражения печени [3]. Одна алкогольная единица содержится примерно в 250 мл пива 4,8 %-ной крепости; в 100 мл сухого вина (12 %); в 70 мл крепленого вина (18 %) и в 30 мл крепких напитков (40 %).
Эпидемиология нАЖБП
НАЖБП остается наиболее частой причиной бессимптомного повышения активности печеночных трансаминаз. Например, в США у 70 % взрослых с синдромом цитолиза причиной повышения активности трансаминаз является именно НАЖБП [10].
Распространенность НАЖБП в популяции была изучена в ограниченном количестве исследований.
Для подтверждения диагноза использовались различные диагностические методы – ультразвуковое исследование (УЗИ), компьютерная томография (КТ), магнитно-резонансная томография (МРТ) печени, пункционная биопсия с последующим гистологическим исследованием и биохимическая оценка функционального состояния печени. В целом, основываясь на данных этих исследований, можно
утверждать, что распространенность НАЖБП в общей популяции колеблется от 20 до 40 %, тогда как частота НАСГ составляет 3–5 % [2–4].
Однако, поскольку развитиебНАЖБП тесно связано с ожирением и ИР, распространенность данного заболевания среди пациентов с ожирением, нарушением липидного обмена и СД2 резко возрастает. Распространенность НАЖБП среди пациентов с морбидным ожирением, подвергшихся хирургическому лечению ожирения, может превышать 90 %, при этом у 5 % пациентов может быть обнаружен невыявленный ранее цирроз печени [11, 12]. Среди пациентов с дислипидемией частота НАЖБП может достигать 50 % [2, 3].
При этом стоит также отметить, что у пациентов с НАЖБП в 60–100 % случаев выявляется избыточная масса тела или ожирение, в 20–92 % случаев – гипертриглицеридемия, в 30–70 % – артериальная гипертензия [2–4, 13].
СД2 и нАЖБП
ИР присутствует у 66–83 % пациентов с НАЖБП, поэтому в клинической практике очень часто встречается сочетание СД2 и НАЖБП [2]. Частота НАЖБП среди пациентов с СД2, по данным различных исследований, составляет 50–80 % [2–4]. При этом пациенты с СД2 имеют более высокий
риск развития тяжелого заболевания печени по сравнению с пациентами без диабета. У пациентов с СД2 и НАЖБП чаще развивается НАСГ – распространенность НАСГ среди пациентов с СД составляет 12,2 % по сравнению с 4,7 % среди пациентов без диабета, а среди пациентов с СД2 и ожирением частота НАСГ достигает 21–40 % [4, 14]. Сочетание СД2 и ожирения увеличивает риск развития НАЖБП: при проведении пункционной биопсии пациентам, ранее не наблюдавшимся по поводу заболевания печени, среди лиц с ожирением и СД2 стеатоз печени был обнаружен в 100 % случаев, в 50 % – стеатогепатит, в 19 % – цирроз печени [15]. Риск смерти от заболевания печени для пациентов с СД2 и НАЖБП в 22 раза выше по сравнению с 2–3-кратным увеличением риска смерти для
пациентов с НАЖБП, без диабета [16].
Пациенты с СД2 и НАЖБП по сравнению с пациентами с СД2, но без признаков поражения печени имеют более выраженные метаболические нарушения, включая больший объем висцеральной жировой ткани и выраженность ИР, более тяжелую дислипидемию и более высокий уровень маркеров воспаления – интерлейкина-6 и фактора некроза опухоли α (ФНО-α)[17–19].
Кроме этого НАЖБП тесно связана с риском развития ССЗ – основной причины смерти пациентов с СД2.
В исследованиях было продемонстрировано, что у пациентов с СД2 НАЖБП ассоциируется с увеличением толщины интима-медиа, повышением риска образования атеросклеротических бляшек в сонных артериях, а также бóльшей распространенностью сердечно-сосудистых и церебро-
васкулярных заболеваний [20–21]. Исследование, проведенное в Италии, показало, что НАЖБП у пациентов с СД2 увеличивает риск ССЗ на 53 % независимо от других факторов риска [7]. Точный механизм подобного влияния НАЖБП на сердечно-сосудистый риск неизвестен. Возможные механизмы могут быть обусловлены увеличением уровня концентрации проатерогенных цитокинов, таких как ФНО-α, и С-реактивного белка и/или атерогенным липидным профилем с низким уровнем ЛПВП и высоким уровнем ЛПНП [17, 22]. Кроме этого НАЖБП у пациентов с СД2 связана со специфической ИР кардиомиоцитов и снижением резерва коронарного кровотока, что в свою очередь уменьшает порог
развития гипоксии и повреждения миокарда [23].
Патогенез нАЖБП
Развитие НАЖБП представляет собой последовательность нескольких патогенетических “ударов” (рис. 2) [8, 24]. В соответствии с этой моделью патогенеза первый “удар” обусловлен ИР, которая играет ключевую роль в развитии первичной НАЖБП и способствует накоплению жира в гепатоцитах.
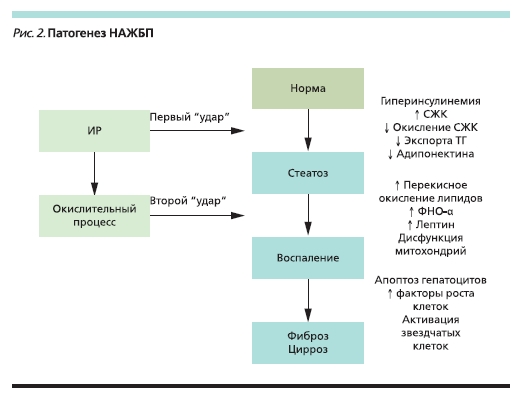
Существует несколько основных механизмов, которые приводят к формированию стеатоза:
• В условиях ИР происходит активация процессов периферического липолиза, что приводит к увеличе-
нию поступления свободных жирных кислот (СЖК) в печень, где они включаются в ТГ.
• Гиперинсулинемия, существующая на фоне ИР, в свою очередь стимулирует синтез СЖК de novo из глюкозы и аденозинтрифосфорной кислоты (АТФ) и тормозит их β-окисление, также способствуя избыточному накоплению СЖК в печени и образованию из них ТГ. Усиление липогенеза в печени происходит через активацию основных молекулярных медиаторов липогенеза: SREBP-1c
(стерол-регулируемый элементсвязывающий протеин), ChREBP (белок, отвечающий за связывание
углеводов) и PPAR-γ (γ-рецептор, активируемый пролифератором пероксисом).
• Снижение экспрессии клеточных рецепторов к адипонектину на фоне гиперинсулинемии. Адипонектин обладает антилипогенетическим действием, стимулируя процессы митохондриального β-окисления
СЖК через активацию АМФ-протеинкиназы и подавляя действие ключевого медиатора липогенеза
SREBP1-c. У пациентов с НАЖБП было также обнаружено снижение концентрации адипонектина в сыворотке.
• Накопление ТГ в печени у пациентов с НАЖБП происходит и вследствие уменьшения синтеза или экскреции аполипопротеина B, являющегося важным компонентом транспортной формы липопротеидов очень низкой плотности (ЛПОНП), что приводит к нарушению экспорта липидов из
печени [2, 25–27].
Вторым патогенетическим “ударом” является окислительный стресс, индуцируемый СЖК и провоспалительными цитокинами (ФНО-α, интерлейкин-6, лептин, резистин), которые продуцируются висцеральной жировой тканью и через портальную систему поступают прямо в печень окислительного стресса свободные радикалы кислорода активируют перекисное окисление липидов, способствуют индукции цитокинов и развитию митохондриальной дисфункции, что приводит к дегенерации и некрозу гепатоцитов, их апоптозу, активации звездчатых клеток с последующим развитием фиброза [2, 4, 8].
Клиника и диагностика НАЖБП Клиническая картина. НАЖБП необходимо подозревать у всех пациентов с СД2, учитывая высокую распространенность данного заболевания печени среди лиц, страдающих диабетом. Как правило, для НАЖБП характерно бессимптомное течение. Если же пациент предъявляет жалобы, они не являются специфичными для НАЖБП. Чаще всего пациентов беспокоят слабость, неопределенный дискомфорт в правом подреберье. Появление же таких жалоб, как кожный зуд, анорексия, диспепсия, развитие желтухи и портальной гипертензии, свидетельствует о далеко зашедшей стадии НАСГ [4].
При лабораторном исследовании у пациентов с НАЖБП может наблюдаться повышение активности АЛТ и АСТ, обычно не более чем в 3–5 раз [2, 4, 28]. По данным литературы, синдром цитолиза наблюдается у 50–90 % пациентов с НАЖБП, получающих лечение в стационаре [28]. Повышение активности трансаминаз не является специфическим маркером НАЖБП и не отражает тяжести повреждения печени. Выраженность синдрома цитолиза не коррелирует со степенью гистологических изменений в печени, что и было продемонстрировано в исследовании пациентов с нормальной активностью трансаминаз и признаками стеатоза: по данным УЗИ – в 59 % случаев при проведении
пункционной биопсии был обнаружен НАСГ [29].
Кроме этого у некоторых пациентов может отмечаться повышение активности щелочной фосфатазы (ЩФ), γ-глутамилтранспептидазы (ГГТП), уровня ферритина и насыщения трансферрина сыворотки. У 10–25 % пациентов с НАЖБП обнаруживаются антинуклеарные антитела [2–4, 28].
Инструментальные методы (УЗИ, КТ, МРТ, магнитно-резонансная спектроскопия – МРС) позволяют верифицировать гепатомегалию, косвенно оценивать степень стеатоза печени и регистрировать формирование портальной гипертензии. Однако данные методы не дают возможности провести
диффренциальную диагностику между стеатозом и НАСГ, а также установить стадию фиброза печени [2–4]. Преимущества и недостатки инструментальных методов, а также признаки, свидетельствующие об изменении печени, характерные для стеатоза, представлены в табл. 1 [2–4, 30].
Таблица 1. Инструментальные методы диагностики НАЖБП.
Самым доступным методом является УЗИ. Чувствительность и специфичность метода зависят от степени стеатоза и наличия ожирения у пациента. При поражении более 30 % паренхимы печени чувствительность и специфичность имеют максимальные значения – 89,7 и 100 % соответственно [31].
У пациентов с ожирением УЗИ менее информативно – чувствительность и специфичность составляют 49,1 и 75 % соответственно [32]. УЗИ может быть скрининговым методом для выявления стеатоза печени [3].
“Золотым” стандартом в диагностике НАЖБП остается пункционная биопсия печени, которая позволяет
проводить дифференциальный диагноз между стеатозом и стеатогепатитом, оценивать стадию фиброза и на основании гистологических данных прогнозировать дальнейшее течение заболевания, а также исключать другие причины поражения печени [3]. Морфологические изменения печени у
пациентов с НАЖБП включают крупнокапельный стеатоз, баллонную дистрофию гепатоцитов и лобулярное воспаление с инфильтрацией мононуклеарами и нейтрофилами при стеатогепатите. Помимо основных признаков при НАЖБП могут обнаруживаться: гликогеноз ядер 1-й зоны, липогранулемы в дольках, тельца Мэллори в гепатоцитах с баллонной дистрофией преимущественно в 3-й зоне ацинуса, мегамитохондрии в гепатоцитах. Для НАЖБП характерен перицеллюлярный и перисинусоидальный фиброз в 3-й зоне ацинуса. По мере прогрессирования заболевания формируются
фиброзные септы между печеночной веной и портальным трактом с последующим формированием узлов и цирроза печени [33].
В каких же случаях необходимо проведение пункционной биопсии? Консенсус AGA, Американской ассо-
циации изучения болезней печени (AASLD – American Association for the Study of Liver Diseases) и
Американского колледжа гастроэнтерологов (ACG – American College of Gastroenterology), опубликованный в 2012 г., предлагает рассматривать вопрос о проведении пункционной биопсии пациентам с подозрением на НАЖБП, имеющим высокий риск стеатогепатита и фиброза. К данной категории относятся пациенты с метаболическим синдромом, в т. ч. и больные СД2. Кроме этого проведение пункционной биопсии необходимо в тех случаях, когда невозможно исключить
другие возможные причины стеатоза обычными диагностическими методами [3]. Однако высокая стоимость метода, возможные тяжелые осложнения все же не позволяют активно применять пункционную биопсию в клинической практике. Кроме этого биопсия может быть неинформативной из-за ошибок забора образцов, малого размера образца взятой ткани, вариабельности интерпретации гисто-логических изменений. Поэтому в настоящее время все больше внимания уделяется неинвазивным методам, позволяющим оценивать наличие воспаления и возможную стадию фиброза
печени у пациентов с НАЖБП [30].
Неинвазивные методы оценки стадии фиброза. Изменение некоторые рутинных лабораторных показателей может свидетельствовать о тяжелом течении НАЖБП, например маркеров синтетической функции печени – альбумина и протромбинового времени.
Повышение уровня билирубина сыворотки также может быть признаком далеко зашедшей стадии НАЖБП. Для того чтобы увеличить ценность обычных лабораторных тестов и клинических признаков как возможных предикторов фиброза печени, в нескольких исследованиях был проведен многомерный анализ, выявивший возможные факторы риска развития фиброза
(табл. 2) [34–40].
Таблица 2. Клинико-лабораторные предикторы фиброза печени у пациентов с НАЖБП.
Интересен такой факт: практически во всех исследованиях СД является серьезным предиктором более тяжелого течения НАЖБП с высокой вероятностью наличия или развития у пациента фиброза печени.
На основании данных многомерного анализа было разработано несколько шкал, позволяющих предполагать у пациента с НАЖБП наличие фиброза. Наиболее известные из них – BARD score и NAFLD fibrosis score. Шкала BARD (Body mass index, AST/ALT index, Diabetes; S. Harrison и соавт., 2008) основана на таких показателях, как ИМТ более 28 кг/м2 (1 балл), АСТ/АЛТ индекс ≥ 0,8 (2 балла), нали-чие СД2 (1 балл). Сумма баллов более 2 свидетельствует о наличии выраженных фиброзных изменений в печени (при отношении шансов, равном 17, т. е. вероятность наличия у больного
фиброза в 17 раз выше, чем вероятность его отсутствия) [39].
NAFLD fibrosis score (Non-alcoholic fatty liver disease – шкала оценки фиброза при НАЖБП; Angulo и соавт., 2007) основана на 6 показателях: возраст, гипергликемия, ИМТ, число тромбоцитов, уровень альбумина и значение АСТ/АЛТ индекса. Формула для оценки наличия фиброза выглядит следующим образом: “ -1,675 + 0,037 × возраст (число лет) + 0,094 × ИМТ (кг/м2) + 1,13 × НТГ (есть = 1, нет = 0) +
0,99 × АСТ/АЛТ индекс – 0,013 × тромбоциты (× 109/л) – 0,66 × альбумин (г/дл)”. Значение, полученное в результате расчета, менее -1,455 с чувствительностью 90 % и специфичностью 60 % свидетельствует об отсутствии фиброза, а более 0,676 указывает на наличие выраженного фиброза
(чувствительность и специфичность 67 и 97 % соответственно) [38]. Именно данная шкала рекомендована AGA для оценки наличия фиброза у пациентов с НАЖБП [3]. При этом нет необходимости рассчитывать данный показатель вручную: он доступен в режиме on-line-калькулятора – www.nafldscore.com
Прямые маркеры воспаления и фиброза. Кроме использования описанных шкал возможно прямое определение в сыворотке крови прямых маркеров воспаления и фиброза. К данным показателям относятся цитокератин-18 – маркер апоптоза гепатоцитов. Цитокератин-18 является основным промежуточным филаментом в структуре цитоскелета, который расщепляется каспазами (преимущественно каспазой 3) – ферментами, запускающими клеточный апоптоз. У больных НАСГ отмечен более высокий уровень фрагментов цитокератина-18 по сравнению с пациентами без воспалительных изменений в печени [41–42].
Свидетельствовать о возможных фиброзных изменениях печени может повышение в сыворотке уровня таких прямых маркеров фиброза, как гиалуроновая кислота, коллаген IV типа, аминоконцевой пропептид коллагена III типа, металлопротеиназы, тканевые ингибиторы металлопротеиназ, ламинин [43–47]. Однако полученных в настоящее время данных недостаточно для широкого внедрения этих
лабораторных тестов в клиническую практику.
Для повышения информативности данных тестов были разработаны математические модели, позволяющие предположить наличие фиброза и оценить его стадию. Европейская группа фиброза печени (European Liver Fibrosis Group) предложила тест Enhanced liver fibrosis panel (ELF). Определение стадии фиброза в данной панели основано на совокупной оценке возраста и концентраций в сыворотке гиалуроновой кислоты, аминоконцевого пропептида коллагена III типа и тканевого ингибитора металлопротеиназы-1 [48]. Другой такой коммерческой моделью является FibroTest,
включающий 5 биохимических показателей: α2-макроглобулин, гаптоглобин, аполипопротеин А1, ГГТП, общий билирубин. На основании значений этих показателей, с учетом возраста и пола пациента рассчитывается индекс, позволяющий определить стадию фиброза [45]. Данные модели имеют высокую надежность при выраженных стадиях фиброза, которая значительно снижается при начальных стадиях фиброза. К недостаткам данных методов можно также отнести их высокую стоимость и недостаточное количество исследований с их применением пациентами с НАЖБП [3].
Диагностичекий алгоритм при хроническом синдроме цитолиза. Возвращаясь к клинической задаче, представленной в начале статьи, хотелось бы подчеркнуть, что в клинической практике врач-эндокринолог часто сталкивается с синдромом цитолиза неясной этиологии и/или признаками стеатоза по данным УЗИ у больных СД2. В каких случаях стоит подозревать НАЖБП и какие дополнительные исследования необходимо провести для подтверждения диагноза? Поскольку синдром цитолиза не специфичен для НАЖБП, необходимо уточнение причины повышения активности трансаминаз. Особое внимание следует уделить вопросам приема алкоголя, иногда в таких случаях необходим опрос родственников больного. С целью выявления причины поражения печени следует уточнять у пациентов такие сведения, как прием лекарственных препаратов за последние 6 месяцев, перенесенные хирургические вмешательства (особенно по поводу лечения ожирения), наличие других хронических (ожирение, СД2, дислипидемия, артериальная гипертензия) или наследственных заболеваний (болезнь Вильсона, гемохроматоз), а также факторов риска вирусных гепатитов (контакт с кровью, гемотрансфузии, посещение стоматолога, тату, пирсинг) (табл. 3).
Таблица 3. Диагностический алгоритм синдрома цитолиза и/или стеатоза печени по данным УЗИ.
С использованием данного алгоритма пациенту были выполнены дополнительные лабораторные тесты,
собран анамнез.
Клиническая задача (продолжение) Анамнез
Алкоголь – 3–4 бокала вина в неделю (≈ 600 мл) – 6 алкогольных единиц. Наследственные заболевания отрицает. Гепатотоксичные препараты в течение последних 6 месяцев не принимал. Факторов риска вирусных гепатитов не выявлено.
Лабораторные исследования
Тромбоциты 210 × 109/л, АЛТ – 68 ЕД/л, АСТ – 73 ЕД/л (при повторном определении), ЩФ – 56 ЕД/л (норма), γГТП – 72 ЕД/л (↑), альбумин – 37 мг/л (норма), ферритин 168 мкг/л (норма), МНО 0,95 (норма); Аутоантитела, HBs Ag, антитела к HBcor, антитела к HCV не обнаружены.
В пользу НАЖБП у пациента говорят следующие факты: отсутствие злоупотребления алкоголем в анамнезе, наличие СД2 и артериальной гипертензии, отсутствие маркеров вирусного и аутоиммунного поражения печени, а также клинико-лабораторных признаков гемохроматоза и болезни Вильсона.
Пункционная биопсия пациенту не проводилась. Была выполнена оценка вероятности фиброза печени с использованием шкалы NAFLD fibrosis score.
Клиническая задача (продолжение) NAFLD fibrosis score у пациента 0,055.
Это промежуточное значение. Наличие у пациента СД2, полученное промежуточное значение NAFLD
fibrosis score, возраст старше 50 лет могут свидетельствовать о значительном риске фиброза печени, что требует более пристального рассмотрения вопроса о проведении пункционной биопсии данному пациенту с целью верификации диагноза и определения стадии фиброза.
Лечение нАЖБП
Тактика ведения пациентов с НАЖБП требует лечения не только заболевания печени, но и связанных
с ним сопутствующих заболеваний – ожирения, дислипидемии, СД2.
Изменение образа жизни. Во многих клинических исследованиях было продемонстрировано, что изменение образа жизни может приводить к снижению активности печеночных трансаминаз и уменьшению стеатоза, по данным УЗИ. Снижение массы тела оказывает положительный эффект
на течение НАЖБП, т. к. приводит к уменьшению ИР, увеличивает утилизацию глюкозы клетками, ингибирует окисление липидов. Снижение массы тела только на 5–10 % уже приводит к уменьшению гепатоспленомегалии, симптомов НАЖБП и активности АЛТ и АСТ [2–4]. Для пациентов с СД2 даже незначительное снижение массы тела может способствовать уменьшению стеатоза и ИР. В одном из исследований было продемонстрировано, что снижение массы тела на 2,6 % было связано с уменьшением содержания ТГ в печени на 20 % после двух недель диеты и физических нагрузок [49].
Положительный эффект на снижение массы тела и чувствительность к инсулину оказывает и физическая нагрузка, которая увеличивает поступление СЖК в мышечную ткань, где происходит их окисление, тем самым обеспечивает уменьшение ИР. Степень уменьшения ИР, как правило, коррелирует с интенсивностью физических упражнений. Проведение бариатрических операций пациентам с НАЖБП с целью лечения ожирения и снижения массы тела связано с уменьшением
смертности, особенно среди пациентов с СД2. Снижение массы тела после бариатрической операции также связано с уменьшением степени стеатоза и воспаления [53–54].
Медикаментозная терапия. Поскольку в основе развития НАЖБП лежит ИР, применение препаратов, повышающих чувствительность к инсулину, теоретически должно способствовать улучшению течения
НАЖБП. К препаратам, повышающим чувствительность к инсулину, относятся средства для лечения СД2 – метформин и пиоглитазон. Влияние метформина на активность трансаминаз и гистологические изменения в печени пациентов с НАСГ было изучено в нескольких исследованиях. Однако в этих исследованиях не было получено улучшения гистологической картины, включая стеатоз, воспаление и
фиброз, у пациентов с НАЖБП [52].
В настоящее время метформин не рекомендуется к применению с целью лечения НАЖБП [3]. При этом
метформин остается препаратом первой линии лечения СД2, доказанно снижая не только уровень
глюкозы крови, но и риск сердечно-сосудистой смертности среди больных СД2 [53].
Вторым препаратом, влияющим на ИР, является пиоглитазон, который, действуя через ядерные PPAR-γ, изменяет транскрипцию генов, регулирующих метаболизм глюкозы и липидов, что в присутствии эндогенного инсулина приводит к повышению захвата глюкозы периферическими тканями, снижению глюконеогенеза в печени, уменьшению липолиза, снижению концентрации в плазме крови ТГ и СЖК. Таким образом, агонисты PPAR-γ могут найти применение в лечении НАЖБП благодаря своим механизмам действия. Применение пиоглитазона больными НАЖБП было изучено в нескольких рандомизированных исследованиях. На фоне лечения пиоглитазоном в дозе 30–45 мг/сут в течение 12–24 месяцев было отмечено снижение активности трансаминаз, уменьшение стеатоза, баллонной
дистрофии и воспаления. Улучшение гистологической картины наблюдалось даже на фоне увеличения массы тела в группе пациентов, принимавших пиоглитазон [54–56]. Недавний мета-анализ 5 клинических рандомизированных исследований показал, что пиоглитазон значительно уменьшает
проявления стеатоза и воспаления, но не оказывает влияния на фиброзные изменения [57]. До сих пор остается спорным вопрос о долгосрочной безопасности применения тиазолидиндионов, особенно в отношении ССЗ, сердечной недостаточности, рака мочевого пузыря и переломов. Мета-анализ 19
исследований, охватывающий 16 390 пациентов с СД2, показал, что лечение пиоглитазоном было связано с достоверным снижением риска (≈ на 18 %) смертности, инфаркта миокарда или инсульта (р = 0,005), но при этом была отмечена большая частота развития сердечной недостаточности в группе
пиоглитазона (2,3 против 1,8 % в группе контроля, р = 0,002) [58]. Поэтому, взвесив риск и пользу применения пиоглитазона пациентами с НАЖБП, AGA рекомендует назначать пиоглитазон только пациентам с НАСГ, подтвержденным результатами пункционной биопсии. При этом необходимо
учитывать два факта: а) большинство данных было получено в популяции лиц без СД2, т. е. отсутствуют данные о влиянии пиоглитазона на течение НАЖБП у лиц с СД2; б) нет данных о
долгосрочной безопасности и эффективности для пациентов с НАСГ [3].
Вторым “ударом” в патогенезе НАЖБП является окислительный стресс, поэтому вызывает интерес возможность применения антиоксидантов больными НАЖБП. Было изучено влияние на пациентов с НАЖБП витамина Е – мощного антиоксиданта с широким спектром действия, включающим профилактику перекисного окисления липидов, подавление экспрессии клетками Купфера и моноцитами ряда цитокинов, уменьшение содержания коллагена α1 в печени, снижение ИР. Несмотря на то что большинство исследований не соответствовало Единым стандартам представления результатов рандомизированных контролируемых испытаний (CONSORT – CONsolidated Standards
Of Reporting Trials), по результатам этих работ могут быть сделаны следующие выводы:
• применение витамина Е связано со снижением активности АЛТ, АСТ у пациентов с НАСГ;
• в исследованиях, где оценивалась динамика гистологических изменений, на фоне лечения витамином Е было отмечено уменьшение степени стеатоза, баллонной дистрофии и воспаления у пациентов с НАСГ;• витамин Е не оказывает влияния на фиброз [3].
В крупнейшем на данный момент исследовании PIVENS (Pioglitazone vs. Vitamin E vs. Placebo for the Treatment of Non-Diabetic Patients with Nonalcoholic Steatohepatitis) было показано, что применение витамина Е в дозе 800 МЕ/сут в течение 96 недель связано с улучшением течения НАЖБП у значительно большего числа пациентов по сравнению с плацебо – 43 против 19 % соответственно, р = 0,001 [56].
В отношении витамина Е остается спорным вопрос его применения пациентами с СД2 и НАЖБП – отсутствуют результаты исследований. Получены также некоторые данные об увеличении общей смертности на фоне применения витамина Е в больших дозах и повышении риска развития
рака предстательной железы при применении витамина Е в дозе 400 МЕ/сут у относительно здоровых мужчин [59–60]. В настоящее время AGA рекомендует рассматривать витамин Е в суточной дозе 800 МЕ/сут в качестве первой линии терапии НАСГ, подтвержденного пункционной биопсией, у взрослых пациентов без СД. Пока не будут получены данные об эффективности и безопасности, не следует
применять витамин Е с целью лечения НАСГ у больных СД, НАЖБП, не подтвержденной гистологическим исследованием, НАСГ с циррозом или криптогенным циррозом печени [3].
В отношении других антиоксидантов и гепатопротекторов, таких как урсодезоксихолевая кислота, омега-3 жирные кислоты, в настоящее время недостаточно данных по их эффективности на пациентов с НАЖБП, поэтому вопрос их широкого применения в клинической практике остается
открытым [3].
Лечение дислипидемии является важным аспектом ведения пациента с НАЖБП, в первую очередь с
целью снижения риска ССЗ. В течение последнего десятилетия исследования показали, что статины безопасны для пациентов с заболеваниями печени; нет убедительных данных, что пациенты с хроническими заболеваниями печени, включая НАЖБП и НАСГ, имеют более высокий риск повреждения печени на фоне применения статинов, чем лица без заболевания печени [62–63]. В
нескольких небольших исследованиях было продемонстрировано снижение активности трансаминаз и улучшение гистологической картины у пациентов с НАЖБП на фоне лечения статинами [65–69]. Однако в настоящее время статины рекомендуют только с целью коррекции дислипидемии у пациентов с НАЖБП; их применение с целью лечения именно НАЖБП требует проведения крупных рандомизированных исследований с оценкой динамики гистологических изменений [3].
Таким образом, лечение НАЖБП у пациентов с СД2 остается нерешенной проблемой. Результатов проведенных исследований недостаточно, чтобы рекомендовать тот или иной препарат пациенту с СД2 и НАЖБП, поскольку отсутствуют данные по эффективности и безопасности лекарственных средств именно для этой категории пациентов. Более того, если обратиться к инструкциям по медицинскому применению метформина и пиоглитазона, можно обнаружить, что метформин не рекомендуется при нарушении функции печени, а пиоглитазон – при синдроме цитолиза (повышение активности АЛТ, АСТ более 2,5 норм).
Какие же рекомендации следует дать нашему пациенту? Общими и для НАЖБП, и для СД2
будут безусловно рекомендации по изменению образа жизни, направленные на снижение массы тела: диета и физические нагрузки. Поскольку у пациента уже есть НАЖБП, необходимо рекомендовать минимальное употребление алкоголя. Важным является и решение вопросов о целевом уровне
HbA1c, и о выборе сахароснижающего препарата.
В соответствии с Консенсусом совета экспертов Российской ассоциации эндокринологов в качестве монотерапии при исходном уровне HbA1c 6,5– 7,5 % препаратами выбора остаются метформин, ингибиторы дипептидилпептидазы-4 (ДПП-4), аналоги глюкагоноподобного пептида-1 (ГПП-1),
а производные сульфонилмочевины, глиниды, тиазолидиндионы и ингибиторы α-глюкозидазы – препаратами резерва [70].
Пациенту может быть рекомендован и метформин, и ингибитор ДПП-4, и аналог ГПП-1. Назначение в данном случае ингибитора ДПП-4 саксаглиптина будет иметь ряд преимуществ. Благодаря своему механизму действия препарат эффективно снижает глюкозу плазмы как натощак, так и в постпрандиальном периоде. При этом, как было показано в клинических исследованиях, препарат может применяться при любой степени нарушения функции печени, его применение не требует
контроля активности АЛТ, АСТ и, что важно, не связано с увеличением риска ССЗ [71–73]. В отличие от метформина нет необходимости в титрации дозы саксаглиптина с целью уменьшения риска нежелательных явлений со стороны желудочно-кишечного тракта – препарат хорошо переносится, его однократный прием в сутки независимо от приема пищи удобен пациентам, как пожилым, так и ведущим активный образ жизни [73].
Поскольку отсутствуют рекомендации по лечению НАЖБП у пациентов с СД2, подбор препаратов, обладающих гепатопротективным действием, проводится эмпирическим путем (это может быть и витамин Е, урсодезоксихолевая кислота, адеметионин, эссенциальные фосфолипиды и др.). В качестве контроля эффективности лечения может быть использована динамика активности АЛТ, АСТ, а также стеатоза, по данным УЗИ, риска фиброза с использованием шкалы NAFLD fibrosis score. Пациент
может быть направлен на консультацию к гастроэнтерологу для решения вопроса о проведении пункционной биопсии с учетом высокого риска фиброза печени и подбора гепатопротекторов.
Положительный эффект на течение НАЖБП и сердечно-сосудистый риск может иметь и лечение дислипидемии, требующее назначения статинов данному пациенту.
Клинический случай. Тактика ведения пациентаЦелевой уровень HbA1c – 7 %.
Изменение образа жизни.
Ограничение алкоголя.
Рациональное питание (диета с ограничением калорий, жиров и простых углеводов).
Аэробные физические нагрузки.
Обучение в школе диабета.
Медикаментозная терапия.
Саксаглиптин 5 мг 1 раз в сутки.
Коррекция дислипидемии (статины).
Коррекция гипертензии (продолжить прием лизиноприла и индапамида).
Длительный прием антиоксидантов – гепатопротекторов.
Динамическое наблюдение.
Самоконтроль АД, массы тела, уровня глюкозы.
Контроль HbA1c через 3 месяца.
Контроль АЛТ, АСТ, УЗИ печени,
оценка NAFLD fibrosis score.
Консультация гастроэнтеролога.
Заключение
НАЖБП имеет высокую распространенность среди пациентов с СД2. Однако очень часто значение НАЖБП для прогноза жизни больного СД2 недооценивается, а диагноз НАЖБП не ставится. При этом уже известно, что пациенты с СД2 и НАЖБП в целом имеют более агрессивное, чем лица без СД, течение заболевания печени с высоким риском развития цирроза и гепатоцеллюлярной карциномы.
Пациенты с СД2 и НАЖБП имеют и более высокий риск ССЗ, а также смертности. Своевременное выявление и жесткий контроль метаболических факторов риска остаются основным направлением лечения СД2 и НАЖБП. Отсутствие однозначных данных по применению медикаментозной терапии НАЖБП в популяции больных СД2 требует проведения рандомизированных контролируемых исследований с использованием пункционной биопсии и динамики гистологических изменений как основного критерия эффективности и безопасности лечения.



