Введение
Гестационный сахарный диабет (ГСД) является полидисциплинарной проблемой, находящейся в фокусе врачей (акушеров-гинекологов, эндокринологов и неонатологов), поскольку ассоциирован с развитием краткосрочных и долгосрочных осложнений со стороны как матери, так и потомства. На сегодняшний день известно, что ГСД увеличивает риски развития таких неблагоприятных исходов течения беременности, как преэклампсия, кесарево сечение, преждевременные роды, низкий балл по шкале Апгар, макросомия и рождение крупного для гестационного возраста ребенка, неонатальная гипогликемия, респираторный дистресс-синдром, неонатальная желтуха, потребность в интенсивной терапии новорожденных [1].
В настоящий момент продолжаются разногласия относительно диагностического подхода к выявлению таких пациенток. В большинстве стран распространен универсальный скрининг на ГСД [2–8]. Несмотря на это, а также на наличие эффективных методов лечения, как немедикаментозных, так и медикаментозных, распространенность развития осложнений ГСД для беременных и потомства остается значимой проблемой во всем мире. Кроме того, согласно прогнозам Международной диабетологической федерации IDF (Internal Diabetes Federation), число беременных с нарушениями углеводного обмена, в т.ч. и ГСД, будет неуклонно прогрессировать во всем мире, что привлекает все больше внимания медицинского сообщества к этой проблеме [9].
Стремление улучшить исходы беременности у пациенток с ГСД, а также понимание нарушений углеводного обмена, впервые выявленных во время беременности, привели к появлению за последнее время работ, демонстрирующих наличие различных патогенетических подтипов ГСД [10–13]. Благодаря проведенным исследованиям уже удалось выяснить, что риски развития осложнений у беременных с различными патогенетическими подтипами разные [10, 13]. Так, еще в 2016 г. С. Powe et al. выделили патогенетические подтипы ГСД на основе индекса чувствительности к инсулину Matsuda и индекса секреции инсулина 1-й фазы Stumboll и продемонстрировали, что у женщин с ГСД, у которых преобладал дефект чувствительности к инсулину, новорожденные были крупнее и отмечалась более высокая вероятность неблагоприятных исходов беременности, ассоциированных с ГСД, чем при подтипе с преобладающим нарушением секреции инсулина. Позднее в исследовании 2019 г., проведенном К. Benhalima et al., было продемонстрировано, что беременные с ГСД и выраженной инсулинорезистентностью (ИР) не только имели более неблагоприятные прогнозы, но и различались по фенотипическим и биохимическим характеристикам.
В частности, установлено, что беременные, имевшие подтип ГСД с высокой выраженностью ИР, обладали более неблагоприятным метаболическим профилем (выше значения триглицеридов, липопротеидов низкой плотности [ЛПНП], более низкие значения липопротеидов высокой плотности [ЛПВП]) [13, 14].
Более детальное изучение различных подтипов ГСД может иметь большое не только научное, но и клиническое значение в улучшении практики по оказанию помощи таким пациенткам. В частности, выделение биохимических маркеров различных подтипов ГСД потенциально способно улучшать раннюю диагностику конкретного подтипа и персонализировать лечение в зависимости от преобладающего патогенетического фактора, а не полагаться на применяемый метод подбора терапии, при котором используется временный период немедикаментозного лечения с дальнейшим назначением и титрованием инсулинотерапии. Такой метод эффективен, но на практике много женщин длительное время не достигают целевых значений гликемии. В то же время часть женщин, способных достигать нормогликемии на фоне немедикаментозных методов лечения, избыточно получают инсулин. Таким образом, попытки персонализировать подход в зависимости от подтипа ГСД остаются важным направлением для научной и практической эндокринологии.
Цель исследования: определить биохимические маркеры для диагностики различных подтипов ГСД у беременных.
Методы
Исследование, одобренное локальным независимым этическим комитетом (Протокол № 5/21 от 11.03.2021), проводилось на базе кафедры внутренних болезней № 3, а также научно-исследовательского института. В это одноцентровое наблюдательное проспективное неконтролируемое исследование были включены 130 беременных женщин, cредний возраст составил 30,2 (27–33) года, наблюдавшихся амбулаторно по поводу беременности в период с марта 2020 по март 2022 г. Критерии включения в исследование: возраст старше 18 лет, наличие одноплодной беременности, наступившей естественным путем без применения вспомогательных репродуктивных технологий, отсутствие ранее диагностированных нарушений углеводного обмена и приема сахароснижающих препаратов в анамнезе, наличие подписанного информированного добровольного согласия на принятие участия в данном исследовании.
У 88 пациенток была выявлена гипергликемия, не соответствовавшая критериям манифестного диабета. Путем расчета индекса Matsuda сформированы следующие группы. При получении значения индекса Matsuda>50-го процентиля по сравнению с показателями беременных без нарушений углеводного обмена мы классифицировали пациентку как имеющую ГСД с преобладающей дисфункцией β-клеток. Если значение индекса Matsuda составляло <50-го процентиля, мы относили пациентку к группе ГСД с преобладающей ИР. В результате у 43 пациенток выявлен подтип ГСД с нарушением функции β-клеток (группа ГСД I), у 45 пациенток определен подтип ГСД с преобладающей ИР (группа ГСД II). По результатам проведенного перорального глюкозотолерантного теста (ПГТТ) с 75 г глюкозы, 42 женщины не имели нарушений углеводного обмена на момент обследования и составили группу контроля. Анализ клинических, фенотипических и анамнестических особенностей пациенток из разных групп подробно рассмотрен в другой статье; по результатам этого исследования данные приведены в табл. 1.
Диагностика ГСД в рамках исследования основывалась на результатах ПГТТ с 75 г глюкозы. ПГТТ проводили утром, натощак, спустя 8–14 часов ночного голодания без предварительного соблюдения диеты с ограничением углеводов. Соблюдению преаналитических правил проведения теста уделялось особое внимание. Все пациентки сначала были проинформированы в устной форме, затем получили письменные рекомендации. Помимо глюкозы у всех участников исследовали уровень инсулина натощак, спустя 60 и 120 минут после нагрузки для расчета индекса ИР с целью дифференциальной диагностики подтипов ГСД путем расчета индекса Matsuda [15].
Дополнительно в день тестирования был произведен забор венозной плазмы натощак для определения уровней общего холестерина (ОХС), триглицеридов (ТГ), ЛПВП, ЛПНП, аполипопротеина А (Апо-А), аполипопротеина В (Апо-В), адипонектина, лептина и оментина.
Проверка количественных данных на подчиненность нормальному закону распределения проверяли с помощью теста Шапиро–Уилка, описательные статистики представлены в виде медианы (интерквартильного размаха). Сравнение количественных показателей в группах проведены при помощи теста Краскала–Уоллиса (попарные апостериорные сравнения – с помощью метода Неменьи), частот – с помощью точного теста Фишера с поправкой на множественные сравнения по Холму. Расчеты выполнены в R (версия 3.2, R Foundation for Statistical Computing, Vienna, Austria).
Результаты
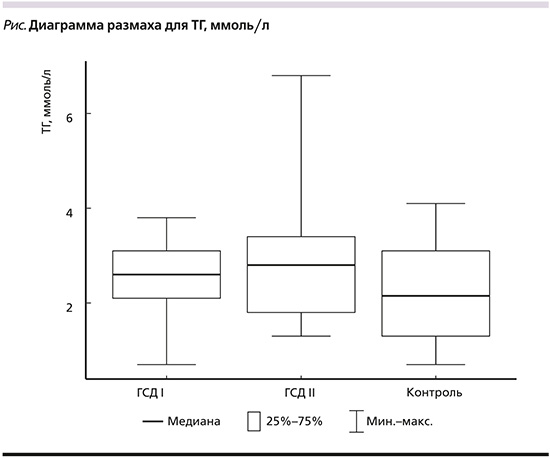
В результате проведенного исследования обнаружено, что беременные из группы ГСД II имели наихудший липидный профиль (статистически значимо самые высокие значения ТГ: p=0,01 – при сравнении с группой ГСД I, p<0,001 – при сравнении с группой контроля (рис. 1), уровни ОХС и ЛПНП были также выше по сравнению с таковыми у пациенток из других групп, а ЛПВП – ниже, однако это подтвердить статистически не удалось.
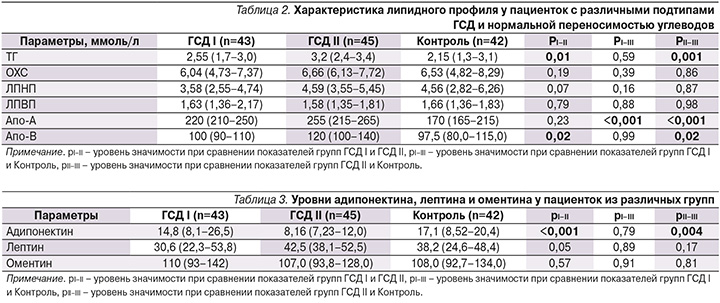
Уровень Апо-А был значительно выше у пациенток с наличием нарушений углеводного обмена по сравнению с беременными из группы контроля, в то же время статистически значимых различий по уровням показателя между разными подтипами ГСД выявлено не было (p<0,001 при сравнении обеих групп ГСД с группой контроля.
Уровень Апо-В был значительно выше у беременных из группы ГСД II по сравнению с беременными из двух других групп (в обоих случаях p=0,02) (табл. 2).
При исследовании адипонектина, лептина и оментина статистически значимые различия выявлены по уровню адипонектина (самый низкий показатель у беременных из группы ГСД II по сравнению с участницами других групп, что подтвердилось статиcтически: p<0,001 при сравнении с группой ГСД I; p=0,004 – с группой контроля). Обнаружить значимых различий по уровням оментина и лептина в рамках исследования не удалось (табл. 3).
Обсуждение
Характеристика липидного профиля. Известно, что беременность ассоциирована с увеличением синтеза жиров печенью [16]. Этому могут способствовать повышенный уровень эстрогена и возрастающая ИР [17]. При исследовании показателей липидного профиля обнаружено несколько интересных особенностей. Так, наилучший липидный профиль выявлен у пациенток из группы контроля (высокий уровень ЛПВП и самые низкие ЛПНП, ТГ). Беременные с ГСД имели более высокие показатели ТГ по сравнению с беременными без нарушений углеводного обмена. Результаты недавнего мета-анализа, проведенного в 2021 г., показали, что уровни ОХС, ЛПНП, ЛПОНП и ТГ были выше у женщин с ГСД, чем у здоровых беременных женщин, в то же время уровень ЛПВП был ниже у женщин с ГСД, чем у беременных с нормальной толерантностью к углеводам. Из всех профилей липидов наибольшая разница наблюдалась в концентрации ТГ [16], что также продемонстрировано и в нашем исследовании. Беременные с ГСД и преобладающей ИР имели наибольшие показатели уровня ТГ. Уровень ТГ статистически значимо различался при сравнении показателей беременных из группы ГСД II (c преобладающей ИР) по отношению к беременным из группы ГСД I (p=0,01) и пациенток из группы контроля (p<0,001). У беременных с ГСД и преобладающей ИР помимо высоких уровней ТГ были также продемонстрированы самые высокие уровни ОХС, ЛПНП и низкие уровни ЛПВП по сравнению с беременными с ГСД без выраженной ИР, тем не менее эти различия не подтвердились статистически (р>0,05) (табл. 2). Однако полученные данные согласуются с результатами исследования «Maternallipid profile differs by gestational diabetes physiologic subtype», проведенного J. Layton в 2019 г. Авторы обследовали 805 беременных женщин и обнаружили, что у женщин с ГСД, характеризующимся преобладающим нарушением чувствительности к инсулину, были значительно более высокие уровни ТГ, более низкий уровень ЛПВП и более высокий уровень свободных жирных кислот [18].
У всех беременных с нарушением толерантности к углеводам были обнаружены более высокие уровни Апо-А и Апо-В по сравнению с пациентками из группы контроля (табл. 2). При этом самые высокие показатели были зарегистрированы у пациенток из группы ГСД II. Статистически значимо обнаружено увеличение только уровня Апо-А у пациенток группы ГСД I и ГСД II по сравнению с группой контроля (p<0,001). В то же время уровень Апо-А статистически значимо не различался у пациенток с разными подтипами ГСД в отличие от Апо-В: ГСД I – 100 (90–110), ГСД II – 120 (100–140) ммоль/л (р=0,02].
Таким образом, наихудший липидный профиль наблюдался у пациенток с ГСД и выраженной ИР, повышение уровня Апо-А имело место у всех беременных с ГСД, в то время как уровень Апо-В статистически значимо различался среди пациенток с разными подтипами ГСД. Отклонения в липидном профиле маловероятно служат причиной развития определенного подтипа ГСД, в данном случае – подтипа с выраженной ИР. Однако стало очевидным, что женщины с различными подтипами ГСД имеют различия в липидном профиле, что потенциально можно использовать для диагностики определенного подтипа для улучшения прогноза.
Характеристика уровней потенциально значимых для патогенеза ГСД гормонов – адипонектина, оментина, лептина. Адипонектин – полипептидный гормон, высвобождаемый адипоцитами и регулирующий гомеостаз, углеводный и липидный обмены. В настоящий момент имеются противоречивые данные относительно роли адипонектина у беременных с ГСД [19]. В ходе нашего исследования обнаружено, что уровень адипонектина статистически значимо различался среди пациенток с ГСД с разными подтипами. Так, у беременных из группы ГСД I он составил 14,8 (8,1–26,5) по сравнению с беременными из группы ГСД II, где уровень адипонектина был cамым низким – 8,16 (7,23–12,0), p<0,001. Уровень адпипонектина различался при сравнении показателей группы ГСД II и группы контроля (p=0,004), в то время как различий при сравнении групп ГСД I и контроля обнаружено не было. Таким образом, несмотря на противоречивые данные, вероятно, адипонектин имеет патогенетическое значение в развитии подтипа ГСД, что может быть обусловлено его ролью в отношении развития ИР.
Ранее проведенное исследование показало, что уровень лептина повышается у беременных с нарушениями углеводного обмена и он может быть рассмотрен в качестве биомаркера ГСД на ранних сроках гестации [20]. По данным нашего исследования, самый высокий уровень лептина отмечен у пациенток из группы ГСД II (с преобладающей ИР), в то время как наименьший был обнаружен у пациенток из группы ГСД I, уровни гормона у пациенток из группы контроля заняли промежуточное место, а получить статистически значимых различий не удалось. Возможно, это связано с недостаточным числом пациенток, включенных в исследование. Уровни оментина не различались у пациенток из разных групп, что согласуется с результатами другого исследования [21] (табл. 3).
Таким образом, по результатам нашего исследования, определение уровня адипонектина может способствовать верификации конкретного патогенетического подтипа ГСД в отличие от лептина и оментина.
Заключение
Мы охарактеризовали липидный профиль, а также уровни гормонов жировой ткани у пациенток с различными подтипами ГСД и обнаружили, что наибольшая биохимическая неоднородность наблюдается при сравнении пациенток с подтипом ГСД с преобладающей ИР и пациентками с нормальной толерантностью к углеводам, в то время как показатели пациенток с подтипом ГСД без выраженной ИР и здоровыми беременными практически не различаются.
Потенциальными биомаркерами, которые могут быть использованы в научной, а затем и в клинической практике для верификации патогенетического подтипа ГСД с выраженной ИР как самого неблагоприятного показателя относительно прогноза, по данным ранее проведенных исследований, могут выступать высокие уровни Апо-В, ТГ, низкие значения адипонектина.
Биохимическая неоднородность у пациенток с различными подтипами ГСД очевидна, однако требуется больше качественных и хорошо спланированных исследований для определения роли этих данных в клинической практике и установления диагностических порогов.
Вклад авторов. Все авторы внесли значимый вклад в написание и подготовку статьи.
Дополнительная информация
Публикация статьи осуществляется в рамках диссертационной работы: «Различные подтипы гестаицонного сахарного диабета, патогенез, клиническая характеристика, диагностические критерии, особенности лечения».



