Введение
На протяжении последних десятилетий на молекулярном уровне получен колоссальный обьем новой информации о структурных и физиологических механизмах клеточной пролиферации, дифференциации, созревания и дегенерации. Было создано множество экспериментальных моделей различных неврологических заболеваний на животных для изучения механизмов гибели клеток и выявления потенциальных мишеней для проведения нейропротективной и нейрорепаративной терапии. На основании нового представления о генетических и молекулярных механизмах церебрального поражения современные способы нейропротекции были успешно воспроизведены на животных и быстро внедрялись в клиническую практику. В то же время многие рандомизированные плацебо-контролируемые исследования по нейропротекции у человека не дали положительных результатов при остром инсульте и хронических формах цереброваскулярных заболеваний. Более того, некоторые исследования были досрочно прекращены вследствие увеличения риска негативных эффектов и отсутствия терапевтической пользы.
Из многочисленных лекарственных субстанций, протестированных в экспериментальных моделях, лишь немногие исследованы в клинических условиях и доказали свою безопасность. Среди них – нейротрофические и мембраностабилизирующие средства, антиоксиданты, блокаторы калиевых и кальциевых каналов, глутаматных рецепторов, ингибиторы каспаз и препараты биологического происхождения с полимодальным эффектом.
Биологические препараты сегодня находятся в центре внимания фармацевтических компаний. Однако не меньшего внимания заслуживают представления и препараты, давно существующие на рынке. Так, вакцинация, появившаяся в европейской медицине около 200 лет назад, снискала беспримерный успех. Несмотря на существующие недостатки и побочные эффекты, ее достижения огромны, например искоренение оспы в результате начатой Всемирной организацией здравоохранения в конце 1950-х гг. всемирной программы вакцинации. Создание новых представлений позволяет начать использование вакцинации в борьбе с рядом опухолей, хотя этой терапии еще предстоит пройти путь от научных разработок до клинических испытаний. Примерами других “старых” биологических препаратов могут служить моноклональные антитела (за создание которых в 1984 г. K. Niels Jerne, J.F. Kohler и Cesar Milstein были удостоены Нобелевской премии) и ряд препаратов крови, таких как концентраты фактора VIII и гемодиализат телячьей крови, названный Актовегином.
Актовегин представляет собой прозрачный водный раствор желтовато-коричневатого цвета. Он лишен белка, но содержит вещества, дающие положительную реакцию с нингидрином. Будучи диализатом крови, Актовегин содержит характерные для нее соли и микроэлементы. Сложный состав этой смеси затрудняет выделение единственного действующего начала. Первоначально им считались низкомолекулярные пептиды (2 % сухого вещества) и производные нуклеиновых кислот; тем не менее на эту роль претендует и ряд других низкомолекулярных веществ (см. ниже).
Показаниями к применению гемодиализата телячьей крови являются нарушения кровообращения и трофики головного мозга (ишемические инсульты, черепно-мозговые травмы), нарушения периферического кровотока и связанные с этим болезни (ангиопатии и трофические язвы голеней), трансплантация кожи, ожоги (в т. ч. химические), нарушения заживления ран (вялотекущие раны, пролежни), профилактика и лечение лучевых поражений кожи и слизистых оболочек. Несмотря на разнообразие показаний, активность препарата легко связать с трофическим действием на ткани.
В данном обзоре мы сосредоточимся на фармакодинамике Актовегина — препарата, который ранее применялся при многих заболеваниях и сегодня возвращается в широкую практику, становясь объектом фундаментальных и клинических исследований. После короткого вступительного обзора, посвященного процессу приготовления препарата, мы рассмотрим современные представления о механизме его действия. После этого мы остановимся на применении гемодиализата телячьей крови на практике в виде резюме некоторых клинических испытаний.
Производство
Актовегин представляет собой депротеинизированный апирогенный и неиммуногенный гемодиализат телячьей крови. При изготовлении он проходит несколько ступеней ультрафильтрации. На первом этапе используется порог в 6 кД, после чего проводятся вакуумная дистилляция, удаление преципитата путем фильтрации через поры диаметром 0,45 мкм и доведение pH до 6,8. После этого полученный продукт фильтруется в стерильных условиях через фильтры с порами 0,2 и 0,45 мкм и выдерживается при 2–6 oС не менее 14 суток, после чего снова подвергается фильтрации (0,45 мкм) и доведению pH до 6,8. После последующих коррекций pH продукт снова фильтруется (7 мкм и 0,2 мкм) и подвергается еще одной ультрафильтрации с порогом 10 кД и фильтрации в стерильных условиях через фильтры с порами 0,2 и 0,45 мкм. После еще одной выдержки (не менее 56 суток при 2–6 oС) готовый продукт отделяют с помощью фильтрации (0,45 мкм) и разводят до номинальной концентрации 200 мг/мл сухого веса. Депротеинизация завершается фильтрацией через фильтры с порами 0,2 и 0,45 мкм в стерильных условиях.
Анализ готового препарата показывает, что он представляет собой смесь природных веществ, как неорганических – электролитов (хлоридов, натрия, калия, кальция, магния, соединений азота), так и органических (глюкозы, ацетата, лактата, аминокислот, пептидов, нуклеозидов, гликосфинголипидов, других продуктов метаболизма). Поскольку белки удаляются из дефибринированной крови при ультрафильтрации (порог – 5 кД), при электрофорезе в полиакриламидном геле следов белка не обнаруживается. Об отсутствии белков и других загрязняющих веществ говорит и безопасность Актовегина; если не брать в расчет отдельные наблюдения, за полвека применения препарата иммунных реакций на него не наблюдали. Токсикологические исследования на мышах и других лабораторных животных показали, что при внутривенном введении гемодиализат телячьей крови токсичен в дозах, превышающих максимальную терапевтическую более чем в 50 раз. Исследования хронической токсичности показали, что при применении в течение 3 месяцев Актовегин не токсичен и не приводит к макро- и микроскопическим патологоанатомическим изменениям.
Поскольку Актовегин имеет биологическое происхождение, он проходит два теста, подтверждающих его однородность. Первый – потребление кислорода (в мкл/мг ткани/ч) гомогенатами печени морских свинок (по Warburg, с помощью микроспирометра). Целевое значение QO2 для Актовегина составляет 4,0/8 мг вещества. Вторым методом стандартизации служит определение захвата меченой тритием глюкозы липидной фракцией жировых клеток придатка яичек крыс. Гемодиализат телячьей крови усиливает ее захват, подобно инсулину; инсулиноподобная активность его в инкубационной среде с концентрацией 1 мг/мл должна составлять не менее 20 мкЕД.
Доклинические исследования
Актовегин оказывает на организм многообразное действие, связанное преимущественно с органонезависимым влиянием на метаболизм клеток, что приводит к повышению потребления и использования кислорода, а также усилению поступления в клетки глюкозы. Благодаря этому Актовегин активирует энергетический метаболизм, оказывая благотворное действие в различных ситуациях. Кроме того, он усиливает окислительные процессы, сдвигая баланс окислительно-восстановительных процессов в сторону окисления. При этом также возрастает содержание высокоэнергетичных фосфатов (например, АТФ и креатинфосфата).
Данная гипотеза появилась в результате ряда исследований, проводившихся как in vitro (например, в культурах клеток), так и in vivo (в опытах на животных). Более того, было показано, что применение Актовегина бывает эффективным при нарушениях кровообращения. Препарат улучшает поступление энергии в ткани, включая головной мозг. Далее мы подведем итоги доклинических испытаний фармакодинамики Актовегина, разделив их по основному оказываемому действию. Разнообразие эффектов Актовегина можно связать с природой препарата, представляющего собой смесь веществ, аналогичную растительным экстрактам, где это считается преимуществом.
Инсулиноподобное действие и метаболизм глюкозы
По характеру действия Актовегин сходен с инсулином [1]. Это наблюдение было дополнительно подтверждено D. Parade [2], описавшим у крыс его инсулиноподобное действие в отношении захвата глюкозы жировыми клетками. Авторы пришли к выводу, что Актовегин содержит вещества, обладающие подобным действием; вопрос о природе этих активных веществ побудил к проведению ряда исследований. Сегодня инсулиноподобное действие Актовегина и стимуляцию метаболизма глюкозы связывают с инозитолфосфоолигосахаридами (IPO).
IPO высвобождаются из мембран гепатоцитов под действием инсулина [3, 4] и благодаря хорошей растворимости, большому объему распределения могут воспроизводить разнообразные инсулиноподобные эффекты во многих клетках [5]. Это наблюдение позднее подтвердили J.M. Mato и соавт. [6] и M. Kellerer и соавт. [7] в опытах на фибробластах крыс с гиперэкспрессией изоферментов человеческого рецептора инсулина, которые инкубировали с инсулином. При этом наблюдалось высвобождение IPO, которые, как показали эти исследования, напрямую стимулировали захват глюкозы ее переносчиками. Так как в этих опытах использовались клетки с резко выраженной гиперэкспрессией инсулиновых рецепторов, в последующем были проведены аналогичные исследования на жировых клетках крыс с физиологическим уровнем экспрессии инсулинового рецептора.
Первые исследования уровня глюкозы проводились на гомогенатах печени морских свинок [8]. Актовегин достоверно изменял уровень глюкозы после 60, 90 и 120 минут инкубации. Более того, инсулиноподобное действие (ИПД), описанное W. Bachmann и соавт. [1], не требовало присутствия инсулина, т. к. проявлялось даже в присутствии антител к инсулину: уровень глюкозы у животных, получавших Актовегин, был отчетливо ниже, чем в контрольной группе. G. Mohnike и соавт. [10] описали опыты по оценке стимуляции захвата и утилизации глюкозы Актовегином в клетках диафрагмы крыс. В последующем исследовании, проведенном в той же лаборатории, F. Machicao и соавт. [11] изучали, обладают ли выделенные из гемодиализата IPO инсулиноподобным действием на жировые клетки крыс. Авторы показали, что ключевые эффекты IPO напоминают действие инсулина на жировые клетки [12]. Любопытно, что действие IPO полностью подавлялось инозитолмонофосфатом, глюкозамином и маннозой, что свидетельствовало о фармакологической специфичности этих активных компонентов Актовегина [13]. В опытах in vitro на миоцитах (линии BC3H-1) инсулин вызывал гидролиз фосфатидилинозитолгликана и повышал образование инозитолгликана и диацилглицерола [14]. Тем не менее эти авторы не получили данных относительно усиления захвата глюкозы инозитолгликаном в этих клетках; отчетливо усиливались только окисление глюкозы и липогенез (рис. 1).
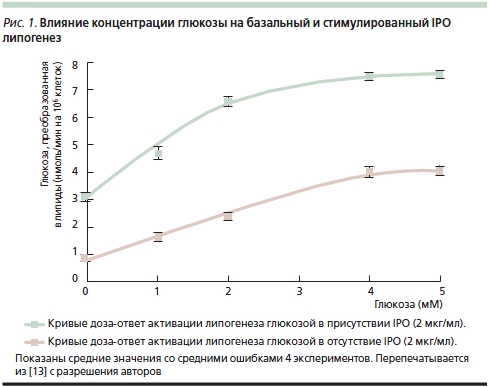
B. Obermier-Kusser и соавт. [9] с целью дальнейшего подтверждения предположения об ИПД содержащихся в Актовегине IPO изучали их влияние на транспорт глюкозы в жировых клетках крыс по сравнению с инсулином: добавление IPO оказывало достоверное дозозависимое действие на транспорт 3-O-метилглюкозы, повышая его в 5 раз (инсулин – в 10) (рис. 2). В той же работе B. Obermier-Kusser и соавт. также изучали связывание цитохалазина B с мембранными переносчиками глюкозы. К удивлению исследователей, число последних в присутствии IPO не возрастало в отличие от действия инсулина, который повышал их содержание в 3–5 раз [9]. Авторы исключили также возможность стимуляции IPO тирозинкиназной активности инсулинового рецептора и предположили, что они не взаимодействуют с нижележащими внутриклеточными сигнальными путями. В итоге была предложена двухступенчатая модель, предполагающая как повышение активности переносчиков глюкозы в цитоплазматической мембране, так и прямое увеличение ее транспорта. Для окончательного выяснения активного вещества требуется изучение свойств отдельных фракций IPO.
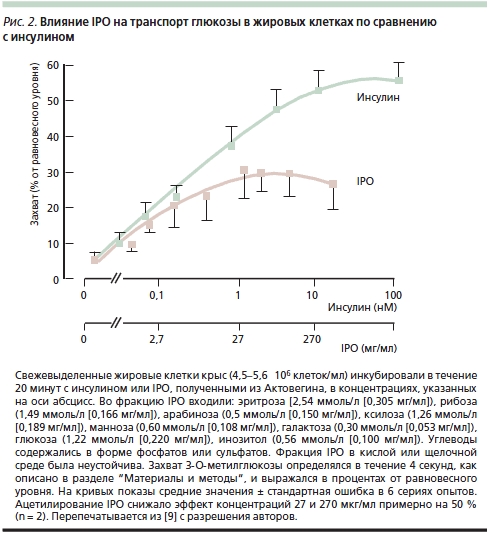
Таким образом, существуют как прямые, так и косвенные данные в пользу существования у Актовегина ИПД, которое отличается от действия самого инсулина преимущественным влиянием на переносчики глюкозы, а не на увеличение ее потока. Тем не менее конечным итогом действия как самого инсулина, так и IPO с инсулиноподобным действием служит повышение утилизации глюкозы, напрямую влияющее на метаболизм клеток и баланс энергии в тканях.
Потребление кислорода, обмен веществ и гипоксия
Исследования потребления кислорода, обмена веществ и гипоксии проводились на таких лабораторных животных, как крысы, морские свинки и собаки. Исследование K.H. Jager и соавт. [15] дало первые доказательства влияния Актовегина на клеточное дыхание: он усиливал потребление кислорода очищенными митохондриями печени крыс. H. De Groot и соавт. [16] изучали влияние гипоксии на гепатоциты крыс, окрашивая их трипановым синим. Добавление Актовегина достоверно повышало их выживаемость в условиях гипоксии. Авторы пришли к выводу, что Актовегин обладает выраженными антигипоксическими свойствами. M. Brecht и H. de Groot [17] изучали влияние свободных аминокислот на гипоксическое повреждение гепатоцитов крыс. Эксперименты проводились аналогично вышеописанному исследованию H.de Groot и соавт. [16]. Это сообщение подтвердило представление о том, что защита от гипоксического повреждения может быть связанной с содержащимися в Актовегине аминокислотами. В соответствии с этими наблюдениями G. Schafer [18] сравнил потребление кислорода гепатоцитами крыс под действием Актовегина и плацебо и описал усиление клеточного дыхания Актовегином (неопубликованные данные). H. Reichel и соавт. [19] показали, что усиление захвата глюкозы и потребления кислорода клетками под действие Актовегина зависит от их фосфорилирующей активности; в присутствии препарата повышение потребления кислорода доходило до 40 %. Это также говорит в пользу представления об усилении Актовегином активности клеток. В подтверждение T. Kuninaka и соавт. [20] исследовали митохондриальное дыхание в митохондриях печени крыс с помощью полярографии и пришли к выводу, подтверждающему данные H. Reichel и соавт. [19]: добавление Актовегина достоверно усиливает окислительное фосфорилирование.
Еще одним интригующим вопросом была скорость воздействия Актовегина на поступление энергии в клетку: К. Schwabe [21] показал, что Актовегин значительно активирует внутриклеточные окислительные процессы и ускоряет не только энергетический, но и резервный метаболизм (например, в сердце и печени сопровождается усиленным накоплением гликогена и калия).
J. Pichotka и соавт. изучали влияние препарата на потребление кислорода. Актовегин вызывал высокодостоверное дозозависимое повышение потребления кислорода по сравнению с контролем. L. Rammler [23] с помощью фотометрии изучал влияние Актовегина на концентрацию АТФ в головном мозге в течение 4 часов. Ему удалось показать, что Актовегин обладает способностью повышать содержание АТФ в тканях (неопубликованные данные). Эти данные стали одним из первых наблюдений, показавших прямое влияние Актовегина на метаболизм головного мозга. Однако от повышения потребления кислорода и метаболизма выигрывает не только головной мозг, но и миокард. P.H. Chanh и соавт. [24, 25] изучали влияние Актовегина на дыхание, обмен веществ и системную гемодинамику при экспериментальной гипоксии, описали существенное повышение потребления кислорода и стимуляцию работы сердца.
Таким образом, Актовегин обладает ИПД и стимулирует клеточный метаболизм, а также повышает потребление кислорода и выработку энергии. Эти эффекты были описаны в различных органах и тканях, что подтверждает представление об Актовегине как о стимуляторе, поддерживающем работу тканей, нуждающихся в поступлении энергии. Поэтому представляется интересным выяснить, может ли восполнение запасов энергии и кислорода в тканях усилить также рост и репликацию клеток. Эта гипотеза изучалась в исследованиях влияния Актовегина на заживление ран.
Влияние препарата на заживление ран и радиационные повреждения
Влияние Актовегина на заживление ран наблюдалось уже на ранних этапах изучения гемодиализата. J. Neinhardt [26] при экспериментальном изучении заживления ран обнаружил, что при лечении Актовегином оно наступало примерно на 2 дня раньше по сравнению с контролем. В другой серии экспериментов H. Mochida и соавт. [27] исследовали влияние Актовегина на силу натяжения надрезанных мышц брюшной стенки животных и пришли к выводу, что Актовегин достоверно ускоряет заживление ран. Это предположение получило подтверждение в опытах D. Schonwald и соавт. in vitro на эндотелиальных клетках сердца морских свинок [28], обнаруживших синергизм между репаративным действием Актовегина и различных ростовых факторов.
Заживление ран существенно зависит от способности отдельных клеток к миграции в зоны повреждения и репликации в этих местах. В связи с этим было предпринято несколько исследований, изучавших способность Актовегина стимулировать миграцию культивируемых клеток. H.G. Miltenburger и соавт. [29] изучали воздействие Актовегина на функцию фибробластов и кератиноцитов и выяснили, что Актовегин высокодостоверно влияет на миграцию клеток, причем его действие усиливается при добавлении трансформирующего фактора роста β. Более того, присутствие Актовегина отчетливо усиливает рост кератиноцитов, а стало быть, и способность тканей восстанавливать нарушенную целостность.
В опытах in vitro подверглись изучению не только трофические свойства препарата и его способность усиливать миграцию клеток, но и функциональная целостность и активность иммунных клеток, усиливающих перестройку тканей, а в результате – заживление ран. Таким образом, Актовегин должен обладать способностью стимулировать иммунокомпетентные клетки. В нескольких исследованиях эти свойства Актовегина изучались в опытах in vitro. Большую роль в воспалительных процессах играют макрофаги; Актовегин оказывает существенное влияние на моноциты, культивируемые in vitro в присутствии сыворотки человека. P. Spessotto и соавт. [30] выделяли моноциты из лейкоконцентрата и исследовали с помощью светового микроскопа плотность и морфологию клеток в монослойных культурах, а также оценивали содержание белка. Плотность клеток и содержание белка повышались при всех изучавшихся концентрациях Актовегина, который мог частично заменить человеческую сыворотку в отношении выживания и дифференцировки моноцитов в культуре.
Радиационные повреждения клеток и тканей считаются важнейшим тестом, в котором проверяются заживляющие и поддерживающие свойства различных фармакологически активных веществ. Действие Актовегина изучалось при тотальном облучении экспериментальных животных, причем некоторые исследования доказали его эффективность. В то же время протоколы этих исследований не всегда совпадали. Тем не менее положительное влияние Актовегина прослеживается в большинстве исследований. Многие наблюдения указывают на возможное радиозащитное действие Актовегина. D. Bauer и A. Locker [31] изучали влияние Актовегина на выживаемость мышей после облучения в летальных дозах. Применение Актовегина вызывало дозозависимое повышение их выживаемости через 30 дней после облучения. В контрольной группе к этому сроку живых животных практически не осталось. G. Barth и соавт. [32] изучали выраженность лучевых повреждений в зависимости от времени инъекции Актовегина. Оптимальным сроком оказались 3 часа после облучения. Профилактическое применение Актовегина в течение 6 суток перед облучением профилактическим действием не обладало. В аналогичном исследовании S.K. Basu и соавт. [33] изучали радиозащитные свойства Актовегина у взрослых крыс, в то время как контрольные животные погибали в первые 30 суток. Среди крыс, получивших Актовегин за час до облучения, выживаемость была, как и в вышеописанном исследовании D. Bauer и A. Locker [31], достоверно выше, что подтверждало их результаты. Напротив, S. Tamou и K.R. Trott [34] при изучении лучевых язв в прямой кишке крыс не нашли различий у животных, получавших Актовегин, и контрольной группой.
Таким образом, представлялось заманчивым исследовать влияние Актовегина на лучевые повреждения in vitro. C.P. Sigdestad и соавт. [35] попытались понять, какие внутриклеточные события происходят при добавлении Актовегина к облученным клеткам в культуре. Авторы не обнаружили никакого его влияния на выживаемость облученных клеток in vitro; тем не менее они выяснили, что после обработки Актовегином в клетках наблюдалось гораздо меньше одноцепочечных разрывов ДНК по сравнению с контролем. Этот факт также подтверждает ранее наблюдавшиеся эффекты, указывающие на положительное влияние Актовегина на выживаемость клеток уже на уровне ядра.
В согласии с описанными выше результатами находится недавно проведенное двойное слепое многоцентровое рандомизированное контролируемое клиническое исследование по изучению эффективности и безопасности Актовегина для больных сахарным диабетом 2 типа с клинически значимой диабетической полиневропатией [36]. Лечение привело к значительному ослаблению нарушений чувствительности и снижению порога вибрационной чувствительности с отчетливой тенденцией к достоверности различий по сравнению с группой плацебо.
Расстройства кровообращения
V.R. Wolff [37] провел биохимический анализ печени крыс через 60 минут после развития экспериментального геморрагического шока. Вызываемые Актовегином изменения в метаболитном составе печеночной ткани сравнивались с таковым после введения плацебо. После анализа полученных данных автор выдвинул предположение об активации Актовегином оксилительных процессов в клетках в соответствии с вышеперечисленными данными. Поскольку гиперхолестеринемия играет важную роль в патогенезе тромбозов и эмболий, P. Giarola [38] задался вопросом: способен ли Актовегин влиять на уровень липидов плазмы кроликов с экспериментальной гиперхолестеринемией? Авторы сообщили о положительном влиянии Актовегина на риск тромбозов и эмболий. В согласии с этими опытами P.H. Chahn и соавт. [24] сравнивали у находившихся под наркозом собак дыхание, обмен веществ и системную гемодинамику в присутствии Актовегина и без него. Был сделан вывод, что Актовегин способен напрямую повышать сердечный выброс и улучшать работоспособность при разных патофизиологических состояниях. Аналогичным образом E. Somogyi [39] попытался изучить эффекты Актовегина на уровне кардиомиоцитов в условиях периодической экспериментальной гипоксии, достигаемой при перекрытии аортокоронарного шунта. Актовегин позволял успешно предотвращать появление морфологических и биохимических нарушений. Авторы сделали вывод, что Актовегин защищает миокард от тяжелых гипоксических повреждений. Эти данные были полностью подтверждены K. Eichler и R. Volker [40], которые оценивали in vitro (в культурах сердечной мышцы куриного эмбриона) при экспериментальной сердечной недостаточности: способно ли добавление Актовегина ее компенсировать или поспособствовать активации и регенерации миокарда? Более того, добавление Актовегина к этим культурам увеличивало промежуток времени до появления первых признаков сердечной недостаточности. Авторы сочли этот эффект следствием прямой стимуляции Актовегином метаболизма клеток.
Действие на центральную нервную систему
Помня о вышеописанных разнообразных эффектах, оказываемых Актовегином на различные органы и системы, можно ожидать и его быстрого благоприятного воздействия на центральную нервную систему (ЦНС). Действительно, некоторые наблюдения, сделанные в опытах на животных и нервной ткани, позволяют экстраполировать достигнутые на соматических клетках эффекты и на них.
Что касается метаболизма клеток ЦНС, G. Lanner и G. Argyropoulos [41] провели серию электроэнцефалографических экспериментов на кроликах с искусственной ишемией головного мозга. Они пришли к выводу, что средства, способные, подобно Актовегину, повышать поступление и утилизацию глюкозы клетками, должны стимулировать поврежденную мозговую ткань. Авторы вводили Актовегин внутримышечно в течение 3 дней, анестезировали кроликов и начинали эксперимент с перевязывания кровоснабжающих мозг артерий, что вызывало острую ишемию. Опытной группе в отличие от контрольной в сонную артерию вводили Актовегин. Результаты экспериментов отчетливо показали, что Актовегин по сравнению с контрольной группой достоверно удлиняет промежуток времени, в течение которого возможно восстановление головного мозга. Это наблюдение согласуется с данными сообщения G. Kruger и G. Quadbeck [42], которые вводили препарат крысам в условиях гипоксии и обнаружили, что наибольший эффект достигается при его сочетании с глюкозой. По мнению авторов, этот результат связан со способностью Актовегина усиливать поступление глюкозы в головной мозг.
С учетом мощной системы саморегуляции сосудистого русла в ЦНС этот эффект Актовегина тем более примечателен, что он подводит к мысли о прямом стимулирующем действии на клеточный метаболизм поврежденной нервной ткани, хотя прямого влияния на мозговой кровоток не наблюдается. Это также вытекает из ранних экспериментов G. Quadbeck и соавт. [43], которые показали повышенный захват ЦНС меченой по 14C глюкозы под действием Актовегина. Повышенное содержание глюкозы в ткани мозга не было при этом результатом ее недостаточной утилизации, т. к. при этом возрастала продукция [14C]CO2. Исследование S. Hoyer и K. Betz [44], в котором изучалась ишемия головного мозга в целом, подтвердило описанные явления. Авторы изучали развившуюся с течением времени нормализацию метаболических нарушений (уровней глюкозы, лактата, креатинфосфата и АТФ) у 2-летних крыс. После перенесенной тотальной ишемии головного мозга эти показатели сравнительно быстро возвращались к исходным цифрам. Однако через 48 и 72 часа после начала реперфузии авторы отметили продолжительное нарушение энергетического баланса в коре головного мозга и гиппокампе. Применение Актовегина успешно препятствовало этому повреждению мозга. Эти результаты были также подтверждены наблюдениями над крысами с вызванным каиновой кислотой повреждением мозга: применение Актовегина снижало летальность крыс от эпилептического статуса [45].
Все эти результаты подчеркивают эффективность Актовегина при повреждениях мозга, например при ишемии, когда абсолютно необходима поддержка клеточного метаболизма. Таким образом, Актовегин помогает при постишемических расстройствах и обеспечивает выживание нейронов в критических ситуациях.
Эффекты, наблюдавшиеся в опытах на различных животных, были показаны также и в ряде клинических испытаний: Актовегин изучался при гипоксии в рамках двойного слепого перекрестного клинического испытания [46]. Авторы записывали потенциалы действия, вызванные зрительными стимулами, а также электроретинограммы у пробандов, получавших Актовегин или плацебо в условиях гипоксии (концентрация кислорода во вдыхаемом воздухе 10,5 %), соответствующей пребыванию на высоте 5500 м над уровнем моря. Дозозависимые изменения обоих оцениваемых показателей наблюдались только после введений Актовегина. В двойном слепом перекрестном контролируемом клиническом испытании эти сообщения получили дополнительное подтверждение [47, 48], позволяющее использовать Актовегин пожилыми больными.
В недавно закончившемся исследовании in vitro эти клинические данные были подтверждены следующими результатами: Актовегин оказывал дозозависимое защитное действие в отношении первичных нейронов крыс; результаты позволили предположить возможную роль Актовегина в защите нейронов от апоптоза и снижении оксидативного стресса (Elmlinger, Bobrova, Kriebel, Movsesyan, Husun, McCracken; данные приняты к публикации).
Заключение
Актовегин доказал свою клиническую эффективность в ряде лабораторных работ, включая как опыты на лабораторных животных, так и in vitro. Его прямое влияние на клеточный метаболизм связывают с ИПД на транспорт глюкозы в клетки. В основе действия Актовегина скорее всего лежат IPO, которые делают гемодиализат телячьей крови препаратом выбора, особенно в эру биологической терапии. С патофизиологической точки зрения не вызывает сомнений, что обладающий антигипоксантным и антиоксидантным действиями Актовегин может широко применяться при неврологических заболеваниях центральной и периферической нервной системы, в патогенезе которых играют роль гипоксия, ишемия и оксидативный стресс. Препарат может использоваться при сосудистых заболеваниях головного мозга, при когнитивных нарушениях, обусловленных сосудистыми или сосудисто-дегенеративными факторами. Заболевания периферической нервной системы, например ишемические невропатии, тоннельные и радикулярные синдромы, в генезе которых сосудистый фактор играет важную роль, также являются возможной целью для применения Актовегина.


