Определение
Термин “пневмония” подразумевает острое заболевание легочной паренхимы любой этиологии (кроме аллергической и развившегося вследствие воздействия физико-химических факторов), так что сам по себе он не несет достаточной информации для выбора терапии. Более того, клиническая картина и симптоматика пневмонии у детей во многом сходны с таковыми острых бронхитов, заболеваемость
которыми на два порядка выше, чем пневмонией. Отличает пневмонии от бронхитов наличие поражения легочной паренхимы – альвеол, что можно выявить рентгенологически – по наличию инфильтративных изменений. С учетом этого оказалось весьма плодотворным сужение рамок для диагностики пневмонии, которое было проведено отечественными педиатрами еще в 1973 г.: пневмония была определена как “острое инфекционное заболевание легочной паренхимы, диагностируемое по синдрому дыхательных расстройств и/или физикальным данным, а также инфильтративным изменениям на рентгенограмме” [1]. Это условие признано во всем мире в качестве “золотого стандарта” диагностики пневмонии.
Важность такого подхода состоит в том, что наличие инфильтративных изменений на рентгенограмме обладает 100%-ной чувствительностью и высокой специфичностью (85–90 %) в отношении бактериальной этиологии пневмонии; его применение на практике позволяет исключать поражения бронхов (бронхит, бронхиолит), в большинстве своем вирусные. Эти распространенные заболевания
не сопровождаются очаговыми или инфильтративными изменениями на рентгенограмме и не требуют антибактериальной терапии, хотя по клиническим данным их нередко диагностируют как пневмонию.
В развивающихся странах, где рентгеновское исследование малодоступно, ВОЗ рекомендует использовать набор клинических симптомов, чтобы отличить бактериальную пневмонию от вирусных бронхитов. Эти признаки были с успехом апробированы и в России (см. рисунок) [2].
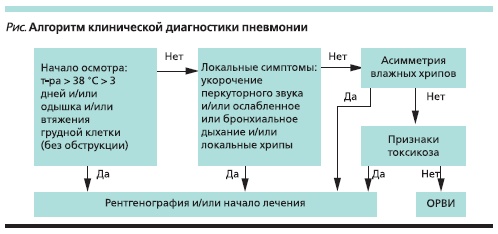
Более широкий критерий диагностики пневмонии использован в недавно изданных Американской Академией педиатрии Рекомендациях по внебольничным пневмониям у детей старше
3 месяцев [3]: достаточным для диагноза считается “наличие признаков и симптомов пневмонии у ранее здорового ребенка”. При этом, однако, большинство пневмоний диагностируется как вирусные и не подлежит антибактериальной терапии. Такой подход связан с особенностью системы здравоохранения, когда большинство больных лечатся амбулаторно, часто без рентгеновского подтверждения, и имеет целью сократить использование антибиотиков при поражениях нижних дыхательных путей, которые многие педиатры диагностируют как пневмонию. В то же время документ
ААП рекомендует использовать клинические, лабораторные и рентгенологические методы, чтобы вычленить из общей массы пневмоний бактериальные формы, требующие назначения антибиотиков, поскольку, согласно рекомендациям регулирующих органов США, получение одобрения для антибактериальной терапии предусматривает “наличие у больного признаков симптомов пневмонии в комбинации с рентгенологической документацией или микробиологическим подтверждением” [4].
Эти различия в определениях следует учитывать при сравнении эпидемиологических показателей, а также практики диагностики и лечения пневмоний. Заболеваемость пневмонией в России определяется цифрами 4–15 на 1000 детей в возрасте 1 месяца – 15 лет с максимумом в возрасте 1–3 года [2]. Аналогичные цифры (4–10 на 1000) приводят современные зарубежные источники в отношении “рентгеноположительных” пневмоний. При расширительном определении пневмоний цифры заболеваемости (амбулаторной) в США намного выше – 74–92 на 1000 детей < 2 лет и 35–52 – 3–6 лет; в то же время в 2006 г. было госпитализировано всего 2 больных пневмонией на 1000 детей 0–18 лет (9 на 1000 детей 0–1 года) [3].
Классификация
Разделение пневмоний на вне- и внутрибольничные стало актуальным в связи с распространением лекарственной устойчивости микроорганизмов, вызывающих пневмонии. К внутрибольничным относят пневмонии, развившиеся через 72 часа пребывания в стационаре или в течение 72 часов после выписки оттуда. В их этиологии основную роль играют устойчивые “больничные” штаммы возбудителей или штаммы аутофлоры больного, лекарственная резистентность которых обусловлена антибиотиками, вводившимися больному. Внебольничные пневмонии вызываются циркулирующими среди населения штаммами пневмотропных возбудителей, лекарственная устойчивость которых обусловлена в основном
характером и уровнем использования антибактериальных препаратов в соответствующем регионе.
На основании клинико-рентгенологических данных выделяют очаговую, очагово-сливную, долевую
(крупозную), сегментарную, интерстициальную пневмонии. Тяжесть пневмонии обусловливается легочносердечной недостаточностью, токсикозом и наличием осложнений (плеврит, легочная деструкция, инфекционно-токсический шок).
Этиология
Хотя пневмонии, согласно российскому определению, в основном имеют бактериальную этиологию, зна-чительная их часть развивается на фоне ОРВИ и гриппа, способствуюших преодолению механической и иммунологической защиты дыхательных путей. Только вирусные (гриппозные, парагриппозные, аденовирусные, вызванные респираторно-синцитиальными вирусами) пневмонии с массивным поражением паренхимы встречаются редко, да и при них вторичная бактериальная инфекция весьма вероятна. Это лишний раз показывает, что наличие инфильтрата в легких, даже у больных с доказанной вирусной инфекцией, должно трактоваться как свидетельство бактериальной пневмонии и служить показанием к антибактериальному лечению.
Среди детей в возрасте 1–6 месяцев пневмонии часто возникают на фоне аспирации пищи вследствие дисфагии, их могут вызывать кишечная флора, стафилококки. Streptococcus pneumoniae и Haemophilus influenzae типа b вероятны в случае контакта с больным сибсом, обычно на фоне вирусной инфекции
(гриппа, парагриппа, РС-вирусной). Большинство атипичных пневмоний – результат перинатальной инфекции Chlamidia trachomatis. В возрасте до 2 месяцев пневмонии могут быть связаны с перинатальной инфекцией стрептококком группы В и листериями, роль Ureaplasma urealyticum и Mycoplasma hominis подвергается сомнению.
У детей 6 месяцев – 5 лет 80–85 % пневмоний вызывает пневмококк, 5–10 % – H. influenzae типа b (введение массовой вакцинации против этой инфекции, начатое в России только в 2011 г., снизит заболеваемость в будущем), т. е. вызванные атипичными возбудителями (M. pneumoniae и C. pneumoniae), как и стафилококко-вые пневмонии, наблюдаются редко. Предшествующая вирусная инфекция выявляется в половине случаев. Среди детей 6–15 лет H. influenzae типа b практически не наблюдается; 50 % и более пневмоний – пневмококковые, редко – стрептококковые. Доля атипичных пневмоний может достигать 40–45 %.
Чувствительность возбудителей пневмонии к антибиотикам
Во многих странах 20–60 % пневмококков, циркулирующих среди населения, приобрели промежуточную (МПК 0,2–1,0 мкг/мл) или высокую (МПК > 2,0 мкг/мл) устойчивость к пенициллинам, цефалоспоринам и макролидам. В России среди населения циркулирует около 90 % чувствительных штаммов пневмококков, однако в детских садах и особенно в интернатах процент устойчивых штаммов намного выше. Устойчивые к пенициллину штаммы пневмококка обычно приобретают устойчивость и к ряду других антибиотиков. В целом среди детей раннего возраста частота нечувствительных к пенициллину штаммов пневмококка достигает 25–30 % [6].
На этом фоне выделяется амоксициллин (и амоксициллин/клавуланат), устойчивость пневмококков к которым наблюдается крайне редко, так что именно они являются препаратом выбора при пневмонии. Столь же высока чувствительность пневмококков к цефтриаксону.
Чувствительность пневмококков к макролидам в России лежит в пределах от 92 % (азитромицин) до 96 % (джозамицин), однако в ряде городов 12–15 % штаммов пневмококков не чувствительны к азитромицину, эритромицину и другим 14-членным макролидам [6]. К оральным цефалоспоринам III
поколения (цефиксим, цефтибутен) устойчиво достаточно много штаммов, поэтому применять эти препараты при респираторной инфекции не следует. Пневмококки в России приобрели высокую устойчивость к ко-тримоксазолу и тетрациклину, в 100 % случаев они устойчивы (природно) к аминогликозидам. Редкие резистентные к амоксициллину и цефтриаксону штаммы чувствительны к
имипенему и ванкомицину.
H. influenzae в России чувствителен к амоксициллину на 90–95 %, на 100 % – к амоксициллину/клавуланату, а также цефалоспоринам II–III поколений, аминогликозидам, левомицетину и рифампицину. Из числа макролидов в отношении H. influenzae in vitro активен азитромицин.
Большинство внебольничных штаммов стафилококка продуцируют β-лактамазу, но сохраняют чувствительность к амоксициллину/клавуланату, оксациллину, цефазолину, линкомицину, аминогликозидам и рифампицину. Гемолитческий стрептококк сохраняет 100 %-ную чувствительность к пенициллинам, однако отмечается рост его устойчивости к макролидам, в меньшей степени – к 16-членным джозамицину и мидекамицину.
Микоплазмы и хламидии не имеют клеточной мембраны, что делает их устойчивыми к пенициллинам и цефалоспоринам. Они чувствительны ко всем макролидам, тетрациклинам, в меньшей степени – к линкомицину. диагностика
Представленный на рисунке алгоритм позволяет проводить отбор детей с ОРЗ для рентгенологического исследования, оно с высокой вероятностью выявляет пневмонию.
Хотя клинические и рентгенологические данные обычно не позволяют ставить окончательный этиологический диагноз, в большинстве случаев их достаточно, чтобы отличить пневмонии, вызываемые атипичными возбудителями (микоплазмы, хламидии), от типичных пневмоний, вызываемых кокковой или (редко) граммотрицательной бактериальной флорой. Это позволяет выбирать класс стартового антибиотика: β-лактам – при типичной и макролид – при атипичной пневмонии (табл. 1).
Таблица 1. Клинические признаки типичных и атипичных пневмоний.
Для типичных пневмоний во всех возрастах характерны скудные физикальные признаки (“немые” пневмонии) со стойкой лихорадкой, токсикозом, отказом ребенка от еды. Для атипичной микоплазменной пневмонии также характерна высокая лихорадка, но без выраженного токсикоза, не
вызывающая большой тревоги родителей, плюс обилие мелкопузырчатых хрипов с двух сторон и их асимметрия, покраснение конъюнктив. Для пневмонии, вызванной C. pneumonia, характерно постепенное начало с фарингитом, иногда с обструктивным синдромом. При атипичных пневмониях преобладают диффузные, негомогенные инфильтраты на снимках. Типичным бактериальным пневмониям, согласно терминологии ВОЗ, соответствует уплотнение (consolidation – сливной альвеолярный инфильтрат) легочной ткани – всей доли или ее части, особенно плотное, скрывающее
край сердца или диафрагмы, на фоне которого часто видна воздушная бронхограмма [5].
Значение гемограммы для диагностики пневмонии не столь значительно, как это принято считать, клинические признаки имеют более высокую диагностическую эффективность. Лейкоцитоз ниже 15 × 109/л наблюдается в первые дни болезни среди 40 % больных кокковой и 96 % – атипичной пневмонией, фактически столь же часто, как и при бронхитах. И лишь цифры выше 15 × 109/л позволяют с умеренной вероятностью исключить вирусную этиологию поражения нижних дыхательных путей, поскольку и при бронхитах (РС-вирусных у детей в возрасте 2–3 месяцев) такие цифры возможны. Уровни С-реактивного белка более 30 мг/л и прокальцитонина выше 2 нг/мл более надежны для диагностики пневмонии.
Уровни лейкоцитоза выше 15 × 109/л и прокальцитонина более 2 нг/мл исключают атипичную пневмонию, однако при меньших уровнях отличия практически полностью сглаживаются. Атипичная пневмония от ОРВИ и бронхита по уровням маркеров отличается мало.
При пневмониях у детей первого полугодия, вызванных C. trachomatis, нередко встречаются очень высокий лейкоцитоз (30–40 × 109/л) и эозинофилия более 5 %.
Суммарные данные о частоте выявления маркеров воспаления при пневманиях, ОРВИ и бронхите представлены в табл. 2.
Таблица 2. Маркеры воспаления (%) при пневмониях, ОРВИ и бронхите.
Терапия
Выбор антибактериального средства при пневмонии проводят эмпирически с учетом разных возбудителей в разных возрастах, тяжести процесса и вероятности устойчивости возбудителя.
Показаниями к замене препарата являются отсутствие клинического эффекта в течение 36–48 часов при нетяжелой и 72 часов при тяжелой пневмонии, а также развитие побочных эффектов [8].
Критерии эмпирического выбора антибиотика при внебольничных пневмониях для трех возрастных групп приведены в табл. 3. При нетяжелых пневмониях как в стационаре, так и в поликлинике предпочтительны оральные препараты; если терапия была начата парентерально, после достижения эффекта (падения температуры) следует перейти на оральный препарат (ступенчатый метод). При обычных курсах назначение противогрибковых препаратов и пробиотиков не оправданно. Лечение нетяжелых пневмоний при хорошем уходе возможно на дому [9].
Таблица 3. Выбор стартового препарата при внебольничной пневмонии.
Ввиду высокого уровня чувствительности пневмококка основными препаратами лечения пневмонии являются амоксициллин и амоксициллин/клавуланат; приводимые в некоторых инструкциях их дозы (30–40 мг/кг/сут) могут оказаться неэффективными, обычная доза (45 мг/кг/сут) и высокая (90 мг/кг/сут) рекомендованы как в России, так и в большинстве других стран [2, 10]. Более удобны для подсчета у детей с разным весом дозы 50 и 100 мг/кг/сут.
Для детей в возрасте 1–6 месяцев оправданно введение препарата, действующего как на кишечную, так и на кокковую флору, включая стафилококк. Этому требованию удовлетворяет в первую очередь амоксициллин/клавуланат в дозе 50 мг/кг/сут в 2 приема – внутрь или внутривенно. При неуспехе следует перейти на внутривенный цефотаксим 100 мг/кг/сут или внутривенный, внутримышечный цефтриаксон 50 мг/кг/сут ± аминогликозид. В отсутствие указанных выше препаратов их могут заменить внутривенным, внутримышечным цефазолином (100 мг/кг/сут) в сочетании с аминогликозидом (например, гентамицин 6 мг/кг/сут). Получавшим ранее антидозу амоксициллина/клавуланата (100
мг/кг/сут) или назначить меропенем 30–40 мг/кг/сут, а при подозрении на метициллин-резистеньный стафилококк (MRSA) – ванкомицин 30–40 мг/кг/сут [11].
Для преморбидно здоровых детей старше 6 месяцев, не получавших антибиотики (в течение 3 месяцев до настоящей болезни), при нетяжелых типичных пневмониях препаратом первого выбора является амоксициллин в дозе 50 мг/кг/сут в 2 приема [10, 11]. Детям до 5 лет лучше использовать амоксициллин/клавуланат (50 мг/кг/сут в 2 приема внутрь), гарантированно подавляющий H. influenzae типа b (даже устойчивые штаммы этого возбудителя). Те же препараты следует применять и недавно леченным антибиотиками детям, а также детям из интернатов; при большей вероятности устойчивости пневмококка доза амоксициллина может быть удвоена (в США при всех пневмониях рекомендуется доза 90 мг/кг/сут, максимально – 4 г/сут [2]).
При аллергии к β-лактамам амоксициллин заменяют на макролиды, линкомицин или клиндамицин.
Неуспех терапии амоксициллином или амоксициллином/клавуланатом чаще всего указывает на неверный выбор – на то, что пневмония вызвана атипичными возбудителями. В этих случаях замена на макролид через 24–48 часов лечения обычно приводит к быстрому успеху. Не является ошибкой и одновременное назначение амоксициллина или амоксициллина/клавуланата вместе с макролидом –
например, если наблюдение за больным не может быть обеспечено.
Казалось бы, макролиды, которые могут быть эффективными и при атипичной, и при пневмококковой пневмонии, имеют преимущества перед амоксициллином. Однако опыт опровергает это предположение, свидетельствуя о большем проценте неэффективности при такой стартовой терапии. Это связано с тем, что макролиды – бактериостатики, к тому же к ним наблюдается рост устойчивости пневмококка. Поскольку резистентность к 16-членным макролидам развивается медленнее, чем к 14- и 15-членным (джозамицин, мидекамицин), применение последних предпочтительнее там, где назначение амоксициллина невозможно из-за аллергии. При подозрении на инфекцию H. influenzae типа b лучше использовать азитромицицин.
При тяжелых внебольничных пневмониях показана госпитализация, лечение начинают внутримышечно
или лучше внутривенно. И в этих случаях амоксициллин/клавуланат для детей до 4–5 лет предпочтителен цефазолину или незащищенным пенициллинам из-за возможности гемофилюсной этиологии, альтернативой может быть цефалоспорин II–III поколений. Среди детей старше 5 лет наиболее частый возбудитель – пневмококк, эффект обычно достигается введением ампициллина или цефазолина. Комбинации антибиотиков, расширяющие антимикробный спектр, показаны при осложненных формах и неясности этиологии. Если есть подозрение на стафилококковую этиологию, оправдан амоксициллин/клавуланат [12].
К сожалению, приходится сталкиваться с отклонениями от этих рекомендаций. Все еще назначается гентамицин, совершенно бесполезный при пневмококковой и атипичной этиологии пневмонии. Не следует применять оральный цефалоспорин I поколения цефалексин, т. к. он может не дать эффекта при гемофилюсной инфекции. Часто приходится встречаться и с неэффективностью при пневмококковой инфекции оральных цефалоспоринов III поколения (цефиксима и цефтибутена), назначение которых стало модным среди некоторых педиатров.
При быстром наступлении эффекта антибиотиков другие виды терапии не нужны. Жаропонижающие средства при пневмонии не назначают, т. к. это может затруднить оценку эффективности лечения. Проветривание помещения обязательно. До наступления эффекта режим постельный, при быстрой обратной динамике ребенка переводят на полупостельный, а с 6–10-го дня – на общий режим.
Возобновлять закаливание можно через 10–14 дней, но большие физические нагрузки (спорт) допустимы через 6 недель при нетяжелой и 12 недель после осложненной пневмонии; в течение этого времени восстанавливается легочный кровоток.
Сниженный в первые дни аппетит быстро восстанавливается, что делает излишним назначение витаминов. Лечению рахита витамином D пневмония не препятствует. Суточный объем жидкости должен быть не менее 700–1000 мл, растворами для оральной гидратации с низким содержанием натрия (Гастролит, Глюкосолан) восполняют 1/2 объема, Регидроном – 1/3, добавляя воду, чай, соки и т. д. Оральной гидратацией можно ограничиться в отношении всех больных неосложненной и 80–90 % больных осложненной пневмонией; объем жидкости, вводимой в вену, не должен превышать 20–30 мл/кг/сут.
Ранняя выписка из стационара (на 3–4-й день, сразу по достижении эффекта при наличии условий для
продолжения лечения на дому, понимании родителями его необходимости и наличии возможности последующего наблюдения) позволяет избегать суперинфекции. Сохранение увеличенной СОЭ, хрипов в легких или остаточных рентгенологических изменений не препятствует ранней выписке ребенка.
Физические методы удаления мокроты в остром периоде пневмонии не играют существенной роли.
Электропроцедуры излишни, они затягивают пребывание в стационаре и создают угрозу суперинфекции в поликлинике. ЛФК, дыхательная гимнастика (амбулаторно) показаны к ускорению купирования плевральных изменений.



