Внебольничные инфекции дыхательных путей (ИДП) относятся к числу наиболее распространенных заболеваний, которые налагают огромное экономическое бремя на национальные системы здравоохранения и остаются одной из ведущих причин смерти современного человека [1–3]. ИДП служат основным показанием к назначению антибиотиков, на их лечение приходится до 2/3 всех выписываемых антибактериальных препаратов [4]. С одной стороны, широкое применение антибиотиков, а также популяризация специфической вакцинопрофилактики привели к значительному снижению смертности от ИДП и пневмококк перестал быть главной причиной смерти человека [5]. С другой стороны, ИДП остаются не только самым частым показанием к назначению антибиотиков, но и главной причиной злоупотребления последними [6, 7]. В свою очередь зачастую необоснованная «антибиотическая агрессия» выступает в качестве важнейшего условия селекции и распространения лекарственноустойчивых потенциально патогенных возбудителей респираторных инфекций, что является в настоящее время одной из ключевых проблем мирового здравоохранения, влекущей за собой увеличение продолжительности пребывания больного в стационаре, рост прямых и непрямых затрат на лечение и повышение смертности [8].
Одновременно с этим мы становимся свидетелями драматического падения усилий фармацевтических компаний по разработке новых антибиотиков, и подобный «провал» особенно заметен как раз в отношении ИДП [9–11]. Отсюда перед врачом возникает непростая терапевтическая дилемма – в каких случаях и какой следует назначать антибиотик (из числа доступных и, как правило, имеющих многолетнюю историю эффективного и относительно безопасного применения), а когда от его применения разумно воздержаться. Ее решение, базирующееся на известных принципах рациональной антибактериальной терапии (табл. 1), мы и предлагаем обсудить ниже на примере таких распространенных внебольничных инфекций нижних дыхательных путей (ИНДП), как острый бронхит (ОБ), внебольничная пневмония (ВП) и обострение хронической обструктивной болезни легких (ХОБЛ).

Острый бронхит
Едва ли не самой частой причиной обращения за медицинской помощью на амбулаторном этапе является остро возникший кашель, а самым распространенным диагнозом в этих случаях оказывается ОБ [13]. К сожалению, до настоящего времени отсутствует «золотой» стандарт диагностики внебольничных ИНДП, в т.ч. и ОБ, что нельзя не учитывать при анализе результатов соответствующих эпидемиологических исследований. Помимо этого мы располагаем ограниченными сведениями о распространенности нетяжелых клинических форм ОБ, поскольку большинство оценок базируется на анализе обращаемости населения за медицинской помощью. В связи с этим нас вряд ли должна удивлять «противоречивость» показателей ежегодной заболеваемости ОБ – от 20 до 400‰, объясняемая характером обследуемой популяции (дети, посещающие дошкольные учреждения, школьники, военнослужащие, резиденты домов престарелых и др.) и конкретной эпидемиологической ситуацией, складывающейся в том или ином регионе [14, 15].
При определении ОБ в качестве альтернативного синдромосходного заболевания, как правило, упоминается пневмония: «Острый бронхит – остро возникшее заболевание у пациента без хронической патологии легких, ведущим признаком которого является кашель (продуктивный или непродуктивный), сопровождающийся другими симптомами ИДП в отсутствие подозрения на наличие пневмонии» [16]. Разграничение этих заболеваний очень важно, поскольку абсолютное большинство случаев ОБ вызываются вирусами (см. ниже) и характеризуются высокой вероятностью спонтанного выздоровления, что делает нецелесообразным применение антибиотиков.
В противоположность этому серьезный прогноз ВП, а также то обстоятельство, что ВП, главным образом бактериальная инфекция респираторных отделов легких, диктуют необходимость неотложной антибактериальной терапии. При этом с учетом нередкого клинического сходства ОБ и нетяжелой ВП [17], известного субъективизма в оценке стетоакустического обследования [18], пределов и возможностей рутинной рентгенографии органов грудной клетки [19, 20], не всегда доступной на момент первичного обследования, особое значение в последнее время приобретает экспресс-определение отдельных биомаркеров, например С-реактивного белка [21], позволяющее оптимизировать дифференциацию между вирусными и бактериальными ИНДП (рис. 1).
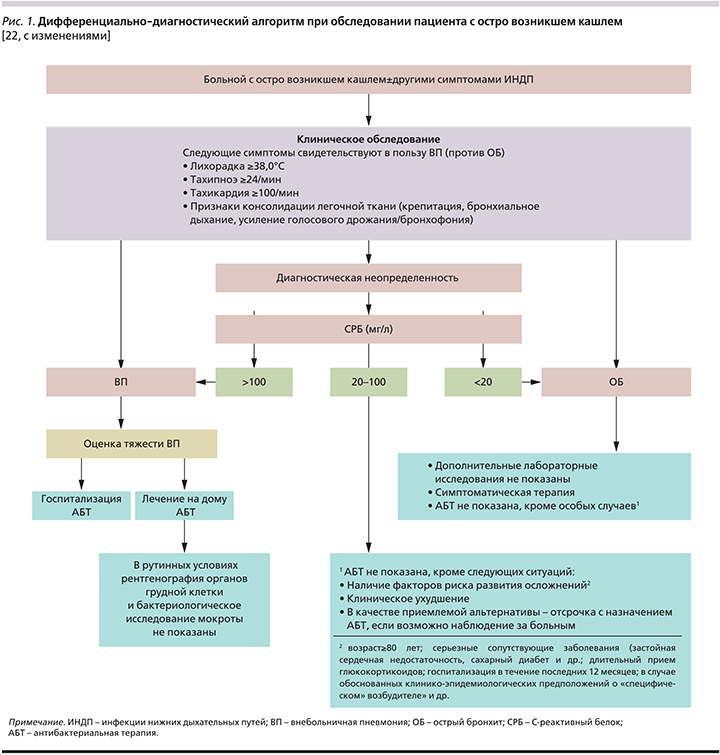
Более 90% случаев ОБ вызываются такими пневмотропными вирусами, как вирусы гриппа А и В, парагриппа, респираторный синцитиальный вирус, корона-, адено-, рино- и метапневмовирусы [23–25]. Этиологический «вклад» конкретного респираторного вируса зависит от ряда факторов, включая наличие или отсутствие эпидемической распространенности соответствующей инфекции, сезона, статуса вакцинопрофилактики гриппа в популяции и пр.
В ряде случаев причиной развития ОБ становятся такие «атипичные» возбудители, как Chlamydophila (Chlamydia) pneumoniae и Mycoplasma pneumoniae [15].
Высказанное предположение о возможности ряда т.н. типичных пневмотропных бактериальных возбудителей (Streptococcus pneumoniae, Haemophilus influenzae и др.) вызывать развитие ОБ [26] не находит до настоящего времени надежного подтверждения (исключая случаи т.н. нозокомиального трахеобронхита у пациентов с трехеостомой или эндотрахеальной интубацией). Особняком в этом плане стоит Bordetella pertussis, «ответственная», по данным ряда целенаправленных исследований, за 1–6% случаев этиологически верифицированного ОБ [27, 28].
Несмотря на то что в абсолютном большинстве случаев ОБ имеет вирусную этиологию, до 90% пациентов с неосложненным течением1 заболевания продолжают получать антибиотики [29–31]. Подобная порочная практика, не претерпевшая за последние 20 лет сколь-нибудь существенных изменений, по сути, игнорирует и отсутствие доказательств эффективности АБТ в обсуждаемой клинической ситуации, и многочисленные свидетельства побочных эффектов необоснованной «антибиотической агрессии» [32], и соответствующие предостережения/запреты авторитетных экспертных медицинских сообществ [33].
Впрочем, данное положение не отменяет возможности применения антибиотиков при ОБ в следующих случаях: I) при наличии острого кашля у больного старше 80 лет и по крайней мере одного или II) при наличии острого кашля у больного старше 65 лет и по крайней мере двух из нижеследующих условий: а) госпитализация в течение ≥48 часов за последние 12 месяцев; б) прием системных глюкокортикоидов или другой иммуносупрессивной терапии; в) ВИЧ/СПИД; г) сахарный диабет 1 или 2 типов; д) хроническая сердечная недостаточность; е) печеночная недостаточность; ж) почечная недостаточность; з) серьезные неврологические расстройства; III) обоснованные клинико-анамнестические предположения о «специфическом» возбудителе [34, 35], рис. 2.
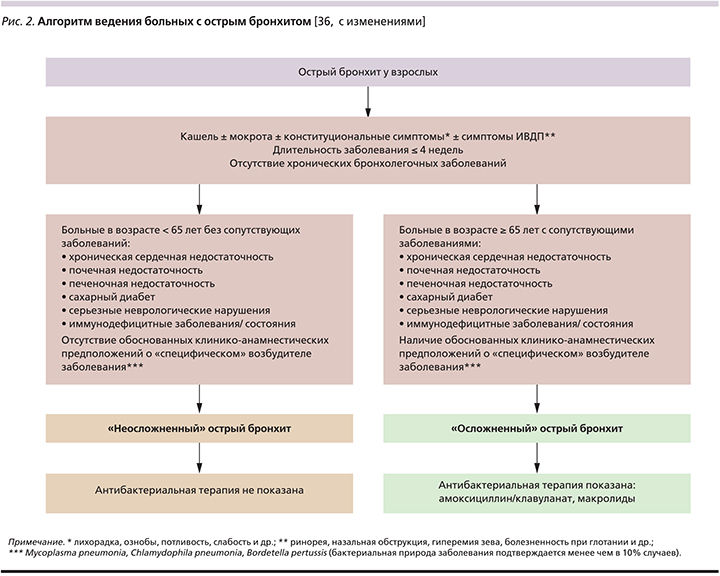
Последнее положение имеет главным образом отношение к коклюшу и предполагает назначение макролидов – азитромицина в течение 3–5 дней, кларитромицина или эритромицина в течение 7 дней. Указанная длительность АБТ не уступает более продолжительной (эритромицин в течение 10–14 дней) в частоте эрадикации B. pertussis из носоглотки, но при этом характеризуется меньшей частотой нежелательных лекарственных реакций [37].
Внебольничная пневмония
Несмотря на то что ВП является лишь верхушкой эпидемиологической «пирамиды» ИНДП, из 100 лиц с остро возникшими респираторными симптомами диагноз заболевания в ходе последующего клинико-рентгенологического исследования подтверждается в 5 случаях [38], она продолжается оставаться ведущей инфекционной причиной смерти, унося ежегодно больше жизней, чем туберкулез, менингит, СПИД и инфекционный эндокардит вместе взятые [39]. Примечательно при этом, что с начала активного применения антибиотиков и до настоящего времени результативность лечения ВП существенно не изменилась. Так, показатели кумулятивной госпитальной летальности в отделениях общего профиля и в отделениях интенсивной терапии (ОИТ) в начале 1950-х гг. и в наше время оказываются сходными (13 и 14% соответственно) [40, 41]. И очевидно, что наряду с постарением населения [42] одной из причин подобной статистической «стагнации» является повсеместный рост числа лекарственноустойчивых штаммов основных возбудителей ВП [43].
Даже используя широкий круг микробиологических, иммуносерологических и молекулярно-генетических методов исследования, установить этиологию ВП удается едва ли в половине случаев. Этот факт, с одной стороны, указывает на ограниченные возможности этиологической диагностики ИНДП, с другой – позволяет предположить, что нам известны далеко не все потенциальные возбудители заболевания. В пользу последнего предположения свидетельствуют многочисленные «находки» последних лет, существенно расширяющие и видоизменяющие наши представления об этиологии ВП – Legionella pneumophila, C. pneumoniae, SARS (Severe Acute Respiratory Syndrome)-ассоциированный коронавирус, Hantavirus, MERS (Middle East respiratory syndrome)-ассоцииро-ванный коронавирус и др.
Тем не менее в подавляющем большинстве стран и регионов пневмококк (S. pneumoniae) по-прежнему остается ведущим возбудителем независимо от степени тяжести/оценки прогноза ВП – на его долю приходится более 40% от числа всех этиологически верифицированных случаев заболевания [45].
Впрочем, из этого правила есть и исключения: в США и Канаде удельный вес S. pneumoniae в этиологии ВП в последние годы не превышает 10–15%, что связывается прежде всего с широкой распространенностью пневмококковой вакцинопрофилактики в этих странах [46].
Нередко при микробиологических исследованиях мокроты больных ВП выделяются культуры H. influenzae, Staphylococcus aureus, грамотрицательных энтеробактерий (табл. 2). В то же время их роль в развитии пневмонии достаточно спорна, поскольку нет полной уверенности, что, будучи выделенными из мокроты, именно они оказываются возбудителями заболевания [5].
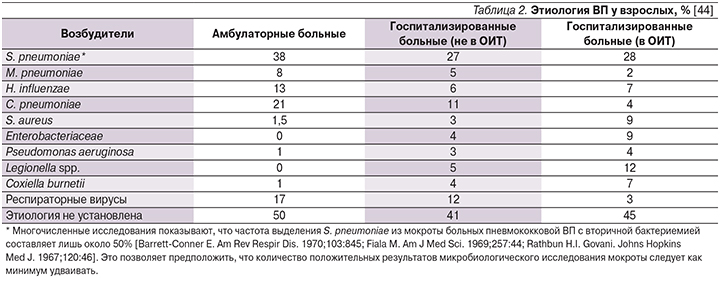
К т.н. атипичным возбудителям ВП относят преимущественно M. pneumoniae, C. pneumoniae и L. pneumophila, совокупно ответственных за развитие ВП в 10–20% случаев [47, 48].
В выборе рациональной АБТ помимо ориентированности в этиологии ВП не менее важно и знание структуры лекарственной устойчивости ключевых возбудителей заболевания, прежде всего пневмококка. В некоторых странах устойчивость пневмококков к пенициллину достигает 60%, причем многие из них обладают резистентностью к трем и более классам антибиотиков. Резистентность S. pneumoniae к пенициллину обычно сочетается с устойчивостью к цефалоспоринам I–II поколений, тетрациклинам, ко-тримоксазолу [43].
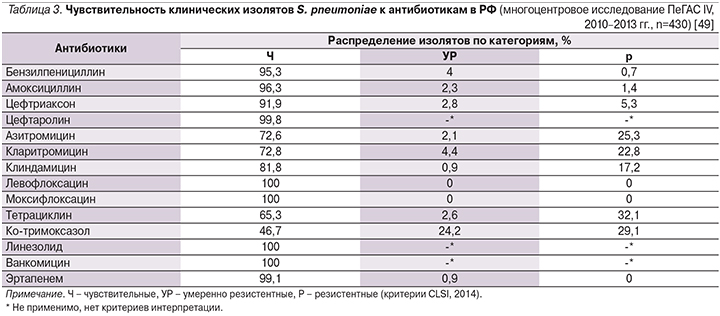
Данные мониторинга чувствительности клинических штаммов S. pneumoniae в РФ, выделенных у пациентов с внебольничными ИДП в 2010–2013 гг., представлены в табл. 3. Отличительной чертой нашей страны служит высокий уровень резистентности пневмококка к тетрациклинам и ко-тримоксазолу, что может быть связано с неоправданно высокой частотой их применения в XX – начале XXI вв. В противоположность этому уровень устойчивости S. pneumoniae к пенициллину и аминопенициллинам остается относительно невысоким – 4,7 и 1,4% изолятов соответственно. Резистентность пневмококка к различным макролидам и линкозамидам варьируется в пределах 18–27,4%; большинство макролидорезистентных пневмококков демонстрирует устойчивость к клиндамицину, что может свидетельствовать о преобладании в РФ MLSB-фенотипа резистентности (MLSB-фенотип – перекрестная устойчивость к макролидам, линкозамидам и стрептограмину В), обусловленного модификацией мишени и определяющего устойчивость S. pneumoniae ко всем макролидам, включая 16-членные.
Переходя непосредственно к обсуждению вопросов АБТ, следует отметить, что в настоящее время имеются доказательства превосходства ряда подходов к лечению взрослых больных ВП. Так, целесообразность раннего назначения антибиотиков (в первые 4–8 часов от момента госпитализации) подтверждается результатами обсервационных исследований и согласуется с мнением экспертов [50–52]. Снижение затрат может быть достигнуто при использовании соответствующих положений современных рекомендаций, облегчающих выбор пациентов ВП, которые могли бы безопасно и эффективно лечиться в амбулаторных условиях. По возможности ранний переход с парентерального введения антибиотика на его прием внутрь и следующая за этим выписка из стационара (когда пациент становится клинически стабильным) также способствует снижению стоимости лечения.
Выбор препаратов для стартовой АБТ больных ВП осуществляется эмпирически с учетом факторов, определяющих спектр потенциальных возбудителей заболевания и профиль антибиотикорезистентности. При этом важно иметь в виду, что «…данные, полученные из существующих рандомизированных клинических исследований, не позволяют создать доказательные рекомендации по выбору антибиотика для терапии внебольничной пневмонии» [53]. Отсюда, очевидно, стратификация больных и рекомендации по выбору АБТ в большей степени отражают национальные эпидемиологические данные антибиотикорезистентности ключевых возбудителей ВП, их потенциальное экологическое влияние, а также учитывают затратную эффективность лекарственной терапии.
Так, согласно соответствующим положениям проекта национальных рекомендаций, подготовленных экспертами Российского респираторного общества (РРО) и Межрегиональной ассоциации по клинической микробиологии и антимикробной химиотерапии (МАКМАХ) [49], среди больных ВП, которые могут получать лечение в амбулаторных условиях, целесообразно выделить две группы. В первую из них включены пациенты без серьезных хронических заболеваний внутренних органов, не принимавшие за последние 3 месяца системных антибиотиков и не имеющие других факторов риска инфицирования редкими и/или полирезистентными возбудителями (пребывание в доме престарелых или других учреждениях длительного ухода, наличие госпитализаций по любому поводу в течение ≥2 суток в предшествовавшие 90 дней, в/в инфузионная терапия, лечение ран в домашних условиях в предшествовавшие 30 дней и др.).
В данной клинической ситуации антибиотиком выбора является амоксициллин, альтернатива – макролиды. Последнее объясняется быстрым и существенным ростом устойчивости S. pneumoniae к макролидам в РФ [54] и как следствие – риском клинических неудач [55]. Макролиды могут применяться при невозможности применения амоксициллина (индивидуальная непереносимость, анамнестические указания на аллергические реакции немедленного типа на прием β-лактамов), а также при наличии клинических/эпидемиологических свидетельств в пользу ВП микоплазменной или хламидийной этиологии.
Во вторую группу включены больные ВП с сопутствующими заболеваниями (ХОБЛ, сахарный диабет, хроническая сердечная недостаточность, хроническая болезнь почек со снижением скорости клубочковой фильтрации, цирроз печени, алкоголизм, наркомания, истощение) и/или принимавшие за последние 3 месяца антибиотики в течение ≥2 последовательных дней, и/или имевшие иные факторы риска инфицирования редкими и/или полирезистентными возбудителями (см. выше). Поскольку вероятность этиологической роли грамотрицательных бактерий (в т.ч. обладающих некоторыми механизмами вторичной лекарственной устойчивости) у этих больных возрастает, в качестве антибиотиков выбора рекомендуются ингибиторозащищенные пенициллины (амоксициллин/клавуланат и др.), а альтернатива – «респираторные» фторхинолоны и цефдиторен.
Подобный подход, предполагающий применение фторхинолонов в качестве альтернативной терапии, общепринят и обусловлен необходимостью уменьшить селекцию лекарственноустойчивых штаммов пневмотропных возбудителей и возможность их использования при неэффективности АБТ первого ряда [56, 57].
Несмотря на определенную роль «атипичных» возбудителей в этиологии ВП для пациентов данной группы, рутинное назначение комбинации β-лактамного антибиотика и макролида не рекомендуется, т.к. на сегодняшний день не доказано, что такая стратегия улучшает исходы лечения при возможном увеличении риска нежелательных лекарственных реакций и селекции антибиотикорезистентности [58].
При госпитализации пациента с ВП необходимо прежде всего решить вопрос о месте лечения – отделение общего профиля или ОИТ. Крайне важным является быстрое выявление признаков тяжелой ВП, т.к. данные пациенты требуют неотложной помощи в условиях ОИТ. В решении этого вопроса определенное значение имеют известные шкалы оценки прогноза заболевания (табл. 4).

В отношении госпитализированных пациентов возможно применение широкого круга АБП: ампициллина, ингибиторозащищенных пенициллинов (амоксициллин/клавуланат и др.), цефалоспоринов с высокой антипневмококковой активностью (цефотаксим, цефтриаксон, цефтаролин), эртапенема, «респираторных» фторхинолонов, демонстрирующих в целом сопоставимую эффективность [66–68]. Стратификация больных аналогична таковой для амбулаторных пациентов [49].
Антибиотиком выбора у госпитализированных пациентов с нетяжелой ВП без сопутствующих заболеваний и других факторов риска инфицирования редкими и/или полирезистентными возбудителями является ампициллин, альтернативными – ингибиторозащищенные пенициллины (амоксициллин/клавуланат и др.) и «респираторные» фторхинолоны (левофлоксацин, моксифлоксацин).
Антибиотиком выбора для госпитализированных пациентов с нетяжелой ВП при наличии сопутствующих заболеваний и других факторов риска инфицирования редкими и/или полирезистентными возбудителями являются ингибиторозащищенные пенициллины (амоксициллин/клавуланат и др.), цефалоспорины III поколения (цефотаксим, цефтриаксон), «респираторные» фторхинолоны (левофлоксацин, моксифлоксацин), а для отдельных категорий пациентов – цефтаролин и эртапенем.
Несмотря на различия в спектре активности in vitro указанные режимы АБТ у пациентов данной категории обладают сопоставимой эффективностью [68]. В регионах с высокой распространенностью пенициллинорезистентных пневмококков (ПРП) при наличии индивидуальных факторов риска инфицирования ПРП определенные преимущества может иметь цефтаролин [70]. Для пожилых пациентов с множественной сопутствующей патологией и высоким риском неблагоприятного прогноза, наличием факторов риска аспирации, для обитателей домов престарелых можно ожидает более высокую эффективность при применении эртапенема [71, 72].
Имеющиеся доказательства превосходства комбинации «β-лактам+ макролид» над монотерпией β-лактамами госпитализированных больных ВП, полученные преимущественно в рамках обсервационных исследований, касаются главным образом тяжелого течения заболевания [73, 74]. В связи с этим рутинное назначение комбинированной АБТ при нетяжелой ВП у госпитализированных пациентов нецелесообразно в связи с риском селекции антибиотикорезистентности [36] – рис. 3.
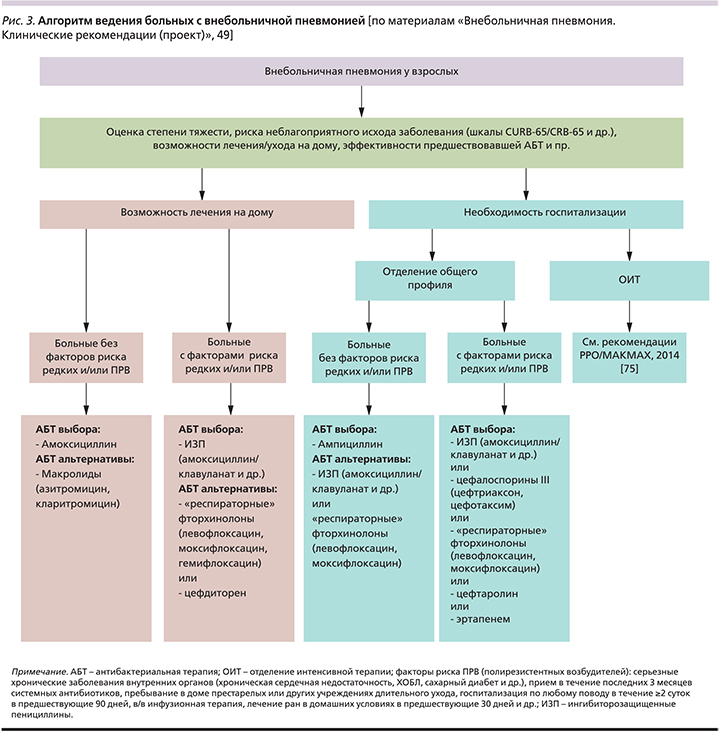
Обсуждение вопросов АБТ пациентов с тяжелой ВП не входило в задачи настоящей статьи; они детально изложены, в частности, на страницах рекомендаций РРО/МАКМАХ (2014) [75].
Обострение ХОБЛ
Обострения ХОБЛ, определяемые как «…остро возникающие эпизоды усугубления респираторных симптомов, требующие проведения дополнительной терапии» [76], наблюдаются по крайней мере 1 раз в год у каждого третьего больного; при этом более чем в половине случаев пациенты не сообщают врачу о подобных эпизодах [77].
Наиболее драматичным и нередким следствием обострения ХОБЛ является летальный исход. Так, госпитальная летальность при нахождении пациентов в отделении общего профиля составляет 2–11%, в ОИТ – 24%, а кумулятивная летальность в течение первого года после выписки из стационара достигает 22–43% [78, 79].
Патофизиология обострений ХОБЛ весьма сложна; с клинических позиций не все обострения одинаковы и потому требуют различных терапевтических подходов. Так, в частности, в настоящее время принято выделять четыре ведущих фенотипа обострения заболевания: а) бактериальный, б) ви-русный, в) эозинофильный, г) «малоклеточный» (pauci-inflammatory), из которых наиболее распространены инфекционные (бактериальный ≈50% и вирусный ≈30% случаев) [80]. При этом едва ли не в каждом четвертом случае удается доказать вирусную и бактериальную коинфекции [81].
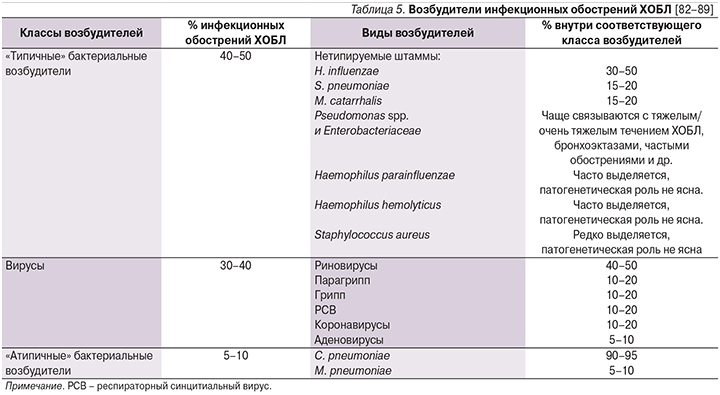
Среди потенциальных бактериальных возбудителей, ответственных за обострения ХОБЛ, чаще других упоминаются H. influenzae, S. pneumoniae и Moraxella catarrhalis (табл. 5).
Более 30 лет назад N. Anthonisen et al. [90] предложили клинические критерии, облегчающие практикующему врачу отбор пациентов, перенесших обострение ХОБЛ и нуждавшихся в эмпирической АБТ (табл. 6).
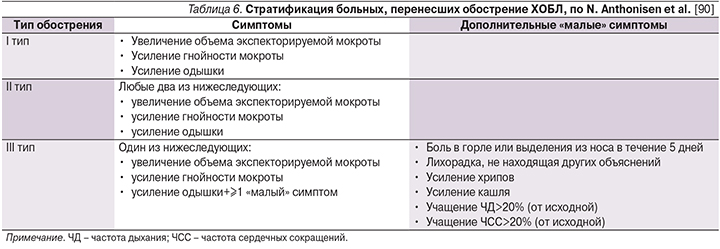
Выявленная авторами закономерность (клинически более тяжелое обострение ХОБЛ (I тип обострения по Anthonisen) скорее имеет бактериальную этиологию и как следствие – обосновывает применение антибиотиков) нашла в последующем подтверждение [91, 92] и была включена в современные клинические рекомендации [16, 93, 94]. При этом было установлено, что гнойный характер мокроты является валидным суррогатным маркером бактериальной инфекции [95–97].
Параллельно с этим было показано, что появление гнойной мокроты или усиление ее гнойности оказываются надежным предиктором хорошего «ответа» на АБТ пациентов с нетяжелым течением ХОБЛ, переносящих обострение заболевания [98]. Таким образом, соответствующие изменения цвета мокроты являются единственным клиническим признаком, помогающим врачу в решении вопроса о целесообразности назначения антибиотиков больным этой категории в амбулаторных условиях, что может быть дополнено определением биомаркеров (рис. 4).
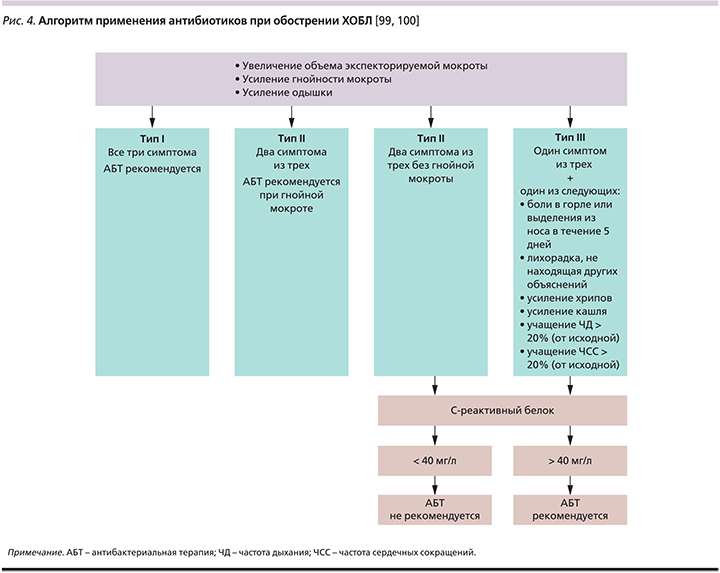
Помимо указанных выше клинических критериев АБТ оправданно назначение АБТ при обострении ХОБЛ у пациентов с тяжелым/крайне тяжелым течением заболевания, а также у нуждающихся в неинвазивной или инвазивной механической вентиляции [101]. При этом важно подчеркнуть, что в случаях наличия известных показаний антибиотики следует применять как можно раньше (в первые 48 часов), поскольку отсрочка с началом АБТ характеризуется большей частотой терапевтических неудач [102].
Определившись с категорией больных, переносящих обострение ХОБЛ и нуждающихся в АБТ, не менее важным представляется и выбор потенциально наиболее эффективного антибиотика, т.к. частота рецидивов в зависимости от результативности лечения колеблется от 17 до 32% [103]. В известной степени этот выбор был облегчен результатами клинических исследований, оценивающих не только ближайшие, но и долговременные эффекты АБТ (частота повторных обострений, в т.ч. и требующих госпитализации, время до первого обострения ХОБЛ в ходе длительного 6–9–12-месячного проспективного наблюдения) [104–106].
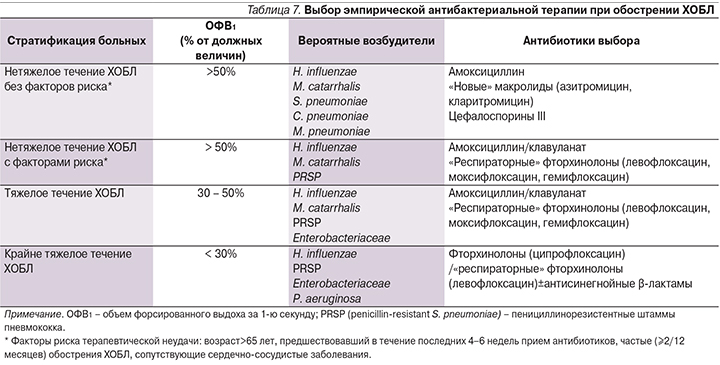
Все вышеизложенное нашло отражение в современных рекомендациях по выбору эмпирической АБТ пациентов с обострением ХОБЛ, включивших известные факторы риска неблагоприятного исхода, коррелирующих в свою очередь с наиболее вероятными возбудителями (табл. 7).
Заключение
Не вызывает сомнений, что основную помощь практикующему врачу при выборе оптимальной эмпирической АБТ больных ИНДП оказывают клинические рекомендации, основывающиеся на соответствующей доказательной базе и адаптированные к тому или иному региону с учетом знания структуры локальной антибиотикорезистентности ключевых пневмотропных возбудителей. В этом контексте главными задачами рекомендаций наряду с очерчиванием ключевых диагностических и дифференциально-диагностических признаков ИНДП становится и внедрение в повседневную клиническую практику рационального применения антибиотиков, а именно отказ от их назначения при вирусных/предположительно вирусных ИДП и удержание от использования менее эффективных из них там, где АБТ показана.



