Развитие таргетной терапии (“target“ – мишень) рака молочной железы (РМЖ) стало возможным благодаря прогрессу в области молекулярной биологии, в т. ч. открытию в 1985 г. онкогена рецептора 2-го типа эпидермального фактора роста (HER2), играющего ключевую роль в жизнедеятельности нормальной клетки. Ген HER2 кодирует тирозинкиназу, принадлежащую к семейству белков HER (HER1–HER4). Гиперэкспрессия рецептора и/или ампфликация гена HER2, приводящая к злокачественной трансформации клетки, обнаруживается примерно в 20–25 % случаев РМЖ и ассоциируется с агрессивным течением заболевания, высоким риском метастазирования и низкой выживаемостью [1–4].
Доказано, что положительный HER2-статус больных РМЖ является достоверным прогностическим фактором развития метастазов в головной мозг (МГМ). Международная исследовательская группа по раку молочной железы (International Breast Cancer Study Group) провела ретроспективный мета-анализ, включивший 9524 больных ранним (операбельным) РМЖ, никогда не получавших трастузумаб и включенных в 10 клинических исследований, проведенных с 1978 по 1999 г. Было показано, что метастазы в ГМ развивались в 2 раза чаще у больных с гиперэкспрессией HER2 (6,8 % у больных с HER2-позитивным и 3,5 % – с HER2-негативным РМЖ; р < 0,01, а в качестве первого очага прогрессирования – у 2,7 и 1,0 % больных соответственно) [5]. По данным проспективного эпидемиологического исследования, “registHER” cреди 1009 первичных больных HER2-позитивным метастатическим РМЖ (HER2+-мРМЖ) с медианой наблюдения 25 месяцев МГМ были обнаружены у 33,2 % женщин, в т. ч. в 6,9 % случаев при первичной диагностике и в 26,3 % – при прогрессировании заболевания (интервал времени от постановки диагноза до МГМ в среднем составил 12,8 месяца). При этом МГМ чаще наблюдались у женщин пременапаузального возраста с отрицательным рецептор-эстрогеновым статусом и при наличии ≥ 2 локализаций метастазов изначально [6].
Отмечено, что НER2 может потенцировать инвазию и метастазирование РМЖ в ГМ через увеличение экспрессии хемокинового трансмембранного рецептора (CXCR), определяющего движение опухолевых клеток к тому или иному органу (необходимое условие для инвазии и метастазирования). Экспрессия CXCR4 в 3,4 раза выше в клетках HER2 + РМЖ, чем в HER2 - РМЖ, что объясняет более высокую вероятность метастазирования НER2-позитивного РМЖ. Для опухолей, при которых наблюдается экспрессия рецептора CXCR4, характерно метастазирование в легкие, печень и головной мозг. Опухолевые клетки, экспрессирующие рецептор CXCR, селективно “привлекаются” в эти органы, в больших количествах продуцирующие стромальный клеточный фактор – 1α (SDF-1α). Исследования in vitro показали, что SDF-1α может вызывать повышение проницаемости сосудов, приводящее к пенетрации клетками РМЖ эндотелиальных клеток сосудов ГМ человека. Нормальный гематоэнцефалический барьер (ГЭБ) позволяет проникать только низкомолекулярным веществам размером менее 20 нм и критической массой 200 kDа, но если МГМ сформировался, это означает, что ГЭБ открыт и перестает выполнять барьерную функцию [7–9]. МГМ носят гематогенный характер, продуцируя более высокие уровни фактора роста эндотелия сосудов (VEGF) с последующим формированием многочисленных сосудов по сравнению с первичной опухолью РМЖ и метастатическими очагами других локализаций. Выявлена четкая корреляция между гиперэкспрессией VEGR и HER2+, активацией mTOR и усилением ангиогенеза и метастазирования, особенно в ГМ [10]. Полученные данные указывают на биологическую предрасположенность HER2-позитивного РМЖ к метастазированию в ГМ.
В настоящее время в клинических испытаниях изучается несколько новых таргетных препаратов, применяющихся при лечении HER2+ РМЖ (табл. 1), но только трастузумаб и лапатиниб, в меньшей степени бевацизумаб исследуются при метастазах РМЖ в ГМ.
Трастузумаб (рекомбинантное моноклональное гуманизированное анти-HER2-антитело) и лапатиниб (мелкая молекула; табл. 2), обладают различными механизмами действия, периодами полужизни, обусловливающими разные пути поступления препаратов в организм.
Трастузумаб – первый таргетный препарат, зарегистрированный для лечения больных местно-распространенным и метастатическим HER2+ РМЖ, достоверно увеличивает общую выживаемость данной категории пациенток, но в среднем у трети больных HER2+-мРМЖ, получавших трастузумаб, развиваются МГМ (рис. 1). Однако данная частота МГМ идентична наблюдаемой у больных HER2+-мРМЖ, никогда не подвергавшихся лечению трастузумабом (33 %) [6]. Таким образом, трастузумаб не увеличивает риск развития МГМ.
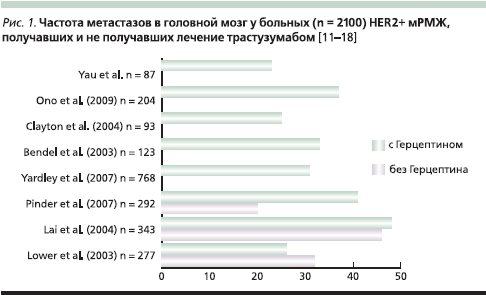
Результаты ретроспективного исследования Park и соавт. [19] свидетельствуют о том, что терапия трастузумабом увеличивает время до развития МГМ (медиана времени до их выявления МГМ составила 19 месяцев у больных, получавших трастузумаб, и 8 месяцев у не получавших таргетную терапию; р < 0,001).
Более того, многочисленные исследования [19–25], представленные в табл. 3, свидетельствуют, что продолжение терапии трастузумабом с момента выявления МГМ, статистически достоверно увеличивает общую выживаемость больных HER2+-мРМЖ по сравнению с пациентками, завершившими лечение трастузумабом после установления факта МГМ, прежде всего за счет эффективного контроля экстракраниальных метастазов. При этом медиана времени до прогрессирования интракраниальных очагов была больше у больных HER2+-мРМЖ, получавших трастузумаб после диагностирования МГМ, по сравнению с теми, у кого проводилось лечение без трастузумаба (7,8 месяца против 2,9; p = 0,006) [19].
Если медиана выживаемости у больных HER2+ РМЖ, получавших только одну лучевую терапию, равнялась 3 месяцам, то комбинация лучевой терапии с таргетной терапией трастузумабом достоверно увеличивает ее до 21 месяца (р < 0,001) [22]. Исследование соотношения концентрации трастузумаба в сыворотке и спинно-мозговой жидкости (СМЖ) до и после лучевой терапии у 6 женщин с HER2+ РМЖ показало, что лучевая терапия по поводу МГМ приводит к повреждению ГЭБ, тем самым обеспечивая проникновение крупной молекулы моноклонального антитела трастузумаба через ГЭБ: повышение соотношения концентрации трастузумаба в сыворотке к концентрации в СМЖ – от 420 : 1 (52 054 и 124 нг/мл) до 76 : 1 (20 158 и 266 нг/мл соответственно). Поражение мозговых оболочек также способствует пенетрации трастузумаба через ГЭБ (данное соотношение при лептоменигиальном карциноматозе составляет 49 : 1) [26]. В настоящее время накоплены данные об интратекальном введении трастузумаба, чаще всего в дозе 20–25 мг еженедельно на фоне стандартной терапии по поводу лептомемингиального карциноматоза [27–31] или 12,5 мг каждые 3 недели на фоне внутривенного введения трастузумба по поводу МГМ (лечение у больной продолжалось 19 месяцев, выполнено 23 интратекальных введения трастузумаба, что привело к значительному улучшению со стороны неврологической симптоматики; после прогрессирования больная начала лечение лапатинибом в комбинации с капецитабином) [32]. Пока интратекальное введение трастузумаба остается экспериментальным лечением, но в любом случае хорошо переносится.
Объективные данные, полученные при иммуно-позитронной эмиссионной томографии (иммуно-ПЭТ) с трастузумабом, меченным цирконием89 (Zr89), подтверждают, что трастузумаб может проникать через поврежденный ГЭБ, т. к. защитные свойства ГЭБ ограничиваются нормальной тканью мозга, а не самим метастазом. Полученные изображения в 1–5-й дни после введения Zr89 трастузумаба у 8 больным HER2+ РМЖ с МГМ свидетельствовали о том, что накопление препарата соответствовало уже выявленным опухолевым очагам в ГМ, легких, печени и костях; более того, были выявлены другие МГМ, не диагностированные ранее [33].
Поскольку продолжение терапии трастузумабом с момента выявления МГМ статистически достоверно увеличивает общую выживаемость больных HER2+-мРМЖ, встает вопрос о смене комбинаторного препарата. Из всех цитостатиков, которые активно изучаются при МГМ и проникают через ГЭБ (препараты платины, темозоломид, топотекан, капецитабин, тегафур и т. д.), признанным комбинаторным препаратом с таргетной терапией HER2+-мРМЖ (трастузумабом и лапатинибом) считается капецитабин [34, 35].
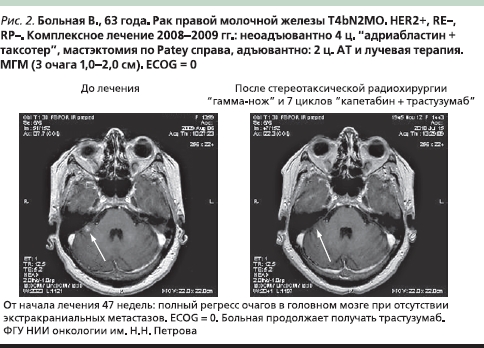
На рис. 2 приведен случай успешного лечения больной HER2+ РМЖ с метастазами в ГМ, подвергавшейся последовательной стереотаксической радиохирургии “гамма–нож”, и комбинации таргетной терапии трастузумабом 6 мг/кг 1 раз в 3 недели с монохимиотерапией капецитабином 2000 мг/м² внутрь в интермиттирующем режиме (с 1-го по 14-й дни 21-дневного цикла).
Лапатиниб – второй таргетный препарат, проникающий через ГЭБ. Лапатиниб (малая молекула) является обратимым ингибитором цитоплазматического домена тирозинкиназ эпидермального фактора роста 1-го и 2-го типов (HER1 и HER2). Клинические испытания таргетной терапии лапатинибом с капецитабином выявили эффективность данной комбинации при метастазах HER2+ РМЖ. В исследовании EGF105084 был выполнен анализ волюметрической (объемной) редукции метастазов HER2+ РМЖ в ГМ при применении лапатиниба и капецитабина: уменьшение объема метастазов наблюдалось у 36 % пациенток (у 25 % больных – редукция > 20 % и у 9,5 % больных – редукция ≥ 50 %). Лапатиниб в комбинации с капецитабином показал клинически значимую эффективность и хорошую переносимость больных у HER2+-мРМЖ с МГМ, ранее получавших содержащую трастузумаб терапию [36].
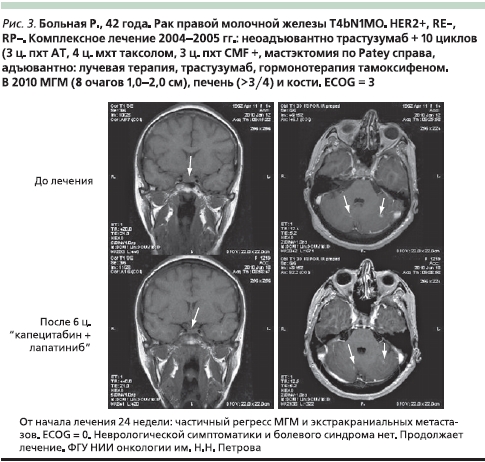
На рис. 3 представлен случай успешного лечения больной HER2+ РМЖ с МГМ, получавшей капецитабин 2000 мг/м² внутрь с 1-го по 14-й дни каждого 21-дневного цикла на фоне таргетной терапии лапатинибом 1250 мг/сут ежедневно и химиотерапию.
Бевацизумаб-текущие исследования показали эффективность этого моноклонального антитела (Авастин) – ингибитора эндотелиального фактора роста (VEGF) при опухолях мозга, в частности при глиобластомах. Однако практически отсутствуют данные об эффективности и переносимости препарата при МГМ из-за ранее существовавших опасений нарастания риска кровоизлияний в метастатический очаг ГМ.
Тем не менее данные о комбинации бевацизумаба с цитостатиками или эрлотинибом у пациенток с МГМ немелкоклеточного рака легкого свидетельствуют о мягком токсическом профиле препарата с крайне низким риском кровотечений в МГМ [37]. Выраженная противоопухолевая активность препарата выявлена при ретроспективном анализе, включившем четыре случая РМЖ с МГМ: один полный и три частичных регресса МГМ. Продолжительность объективного ответа МГМ составила 11, 10, 8 и 6 месяцев [38]. С учетом того, что НER2 опосредованно увеличивает продукцию VEGF, усиливая ангиогенез и метастазирование, особенно в головном мозге, в настоящее время проводится клиническое испытание, исследующее эффективность комбинации бевацизумаба с карбоплатином ± трастузумаб при HER2+ РМЖ c МГМ (табл. 4) [35].
Тесты invivoи invitroвыявили синергизм и отсутствие перекрестной резистентности между трастузумабом и лапатинибом. В настоящее время проводится ряд исследований (табл. 4) по оценке эффективности комбинации трастузумаба и лапатиниба как с химио-, так и с гормонотерапией для обеспечения своевременного таргетного воздействия на оба взаимодополняющих сигнальных механизма, снижая риск развития резистентности (трастузумаб избирательно воздействует на внеклеточный домен HER2, а лапатиниб в основном посредством антителопосредованной цитотоксичности связывает внутриклеточный тирозинкиназный домен рецепторов эпидермального фактора 1-го и 2-го типов, ингибирует фосфорилирование и активацию сигнальных путей).
Предварительные результаты таргетной терапии трастузумабом с лапатинибом в лечении рефрактерного HER2+ РМЖ по сравнению с монотерапией лапатинибом уже сейчас свидетельствуют о безопасности данной комбинации, а также о статистически достоверном увеличении медианы выживаемости без прогрессирования (12,0 недель против 8,1) [40].
Результаты исследования послужили основанием включения комбинации трастузумаба и лапатиниба в международные рекомендации NCCN по лечению мРМЖ (табл. 5) в качестве одной из предпочтительных схем терапии HER2+ РМЖ. Более того, представленные на ASCO (Чикаго, 2010) рекомендации по химиотерапии мРМЖ, в т. ч. для HER2+ РМЖ, леченного ранее трастузумабом, включают комбинации лапатиниб + капецитабин, трастузумаб + капецитабин и трастузумаб + лапатиниб, рассматривающиеся как перспективные в лечении больных HER2+ РМЖ с МГМ. Таким образом, внедрение в клиническую практику таргетных препаратов, в т. ч. трастузумаба и лапатиниба, дает обоснованную надежду на улучшение результатов лечения больных с HER2-позитивным РМЖ с метастазами в головной мозг.



