Гиперэкспрессия HER2 встречается приблизительно в 20–25% случаев инвазивного рака молочной железы (РМЖ) и ассоциируется с неблагоприятным прогнозом. С момента внедрения трастузумаба — моноклонального антитела против рецептора HER2, в рутинную клиническую практику изменился взгляд на лечение данной подгруппы больных и на прогноз заболевания в целом. Больные с HER2-позитивными опухолями, ранее считавшимися наиболее неблагоприятными, в настоящее время имеют наилучший прогноз [1–3].
Однако очевиден тот факт, что не все пациенты с гиперэкспрессией HER2 отвечают на трастузумаб-содержащую терапию. Приблизительно 15% больных имеют прогрессирование на терапии с включением трастузумаба, что свидетельствует о наличии первичной или приобретенной резистентности к препарату [4]. На этом основаны дальнейшие поиски дополнительной терапии для включения в режимы лечения с лапатинибом, нератинибом, афатинибом, T-DM1 (трастузумаб мейтанзин) и пертузумабом.
Пертузумаб – гуманизированное моноклональное антитело, которое связывается с внеклеточным доменом II HER2-рецептора и препятствует димеризации HER-рецепторов.
Семейство рецепторов эпидермального фактора роста включает 4 рецептора: erbB1 (EGFR, HER1), erbB2 (HER2), erbB3 и erbB4, которые экспрессируются на подавляющем большинстве нормальных и опухолевых эпителиальных клеток. По своей структуре они относятся к трансмембранным тирозинкиназным рецепторам, состоящим из внеклеточного (экстрацеллюлярного) домена, трансмембранного домена, отвечающего за промежуточную передачу сигнала; внутриклеточного тирозинкиназного домена, запускающего каскад реакций, необходимых для конечной реализации действия рецептора. Внеклеточный домен дополнительно подразделяется на 4 части: домен I служит для связывания с лигандом, домен II – для димеризации с другими рецепторами семейства, домен IV – для связывания с трастузумабом.
Все рецепторы неактивны в виде мономеров, однако при связывании внеклеточного домена со специфическим лигандом происходит активация рецептора (образование гомо- и гетеродимеров). EGFR, ErbB3 и ErbB4 имеют установленные лиганды, воздействие которых приводит к димеризации рецепторов, необходимой для «запуска» тирозинкиназной эффекторной части. HER2 является единственным рецептором, которому для активации не требуется соединения с лигандом. При этом HER2 является предпочтительным партнером для димеризации благодаря открытой конформации рецептора. HER2-содержащие гетеродимеры имеют более высокую стабильность [5], из всех возможных гетеродимеров этого семейства наибольшей активностью обладает комплекс HER2:HER3. Предполагается, что именно димеризация (образование пар) рецепторов HER2 и HER3 является одной из ведущих причин развития лекарственной резистентности, т.к. ведет к повышению активности сигнальных путей PI3K и МАРК, ответственных за рост, пролиферацию и нарушение апоптоза опухолевой клетки. Блокируя образование HER2-содержащих димеров, пертузумаб угнетает многочисленные пути передачи сигнала, опосредованные HER-рецепторами (в первую очередь HER2:HER3). Пертузумаб и трастузумаб связываются с различными эпитопами HER2-рецептора, и их совместное использование благодаря комплементарным механизмам действия позволяет добиваться блокады большего количества сигнальных путей и как следствие – большей противоопухолевой эффективности.
В нескольких исследованиях I фазы изучали пертузумаб в монотерапии, в комбинации с различными режимами химиотерапии и с трастузумабом у больных метастатическим HER2-положительным РМЖ, резистентным к стандартным режимам лечения.
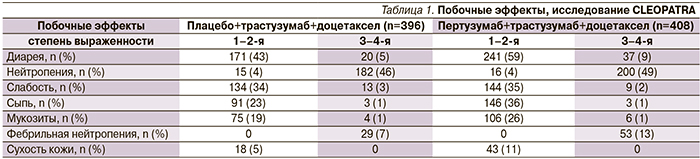
В результате проведенных исследований была показана хорошая переносимость пертузумаба, наиболее частые побочные эффекты не превышали 1–2-ю степени и включали астению, сыпь, диарею, тошноту, при этом максимально переносимая доза не была достигнута.
В ряде пилотных исследований II фазы было показано, что пертузумаб может быть эффективен и после неудачи терапии трастузумабом [6], однако наилучшие результаты были получены при комбинации этих двух моноклональных антител [7]. Из 66 включенных в исследование больных контроля болезни (полный+частичный регресс+стабилизация болезни>6 месяцев) удалось добиться в 50% случаев, причем длительной стабилизации – у 17 больных. Медиана времени до прогрессирования составила 5,5 месяца. Комбинация хорошо переносилась, не было отмечено случаев прекращения лечения из-за развития кардиальной токсичности.
На основании проведенных исследовании I–II фаз рекомендуемая доза пертузумаба составляет 840 мг – нагрузочная доза, далее 420 мг – каждые 3 недели.
Полученные результаты легли в основу рандомизированного исследования III фазы (CLEOPATRA) [8] по изучению эффективности комбинации пертузумаба и трастузумаба в I линии терапии метастатического HER2-положительного РМЖ.
Исследование CLEOPATRA является классическим международным двойным слепым плацебо-контролируемым исследованием III фазы. Основной целью исследования являлась оценка эффективности и переносимости комбинации пертузу-маб+трастузумаб+доцетаксел в качестве I линии терапии метастатического HER2-положительного РМЖ по сравнению со стандартной терапией I линии трастузумаб+доцетаксел.
С февраля 2008 по июль 2010 г. в исследование были включены 808 пациенток с подтвержденным в центральной лаборатории HER2-положительным статусом опухоли, не получавших ранее противоопухолевой терапии по поводу метастатической болезни. Допускалось включение больных, ранее получавших нео- и/или адъювантную терапию, в т.ч. и с трастузумабом, при условии, что от момента ее завершения до развития метастатической болезни прошло не менее 12 месяцев. Средний возраст включенных в исследование больных составил 54 года (от 27 до 89 лет), 48% имели опухоль с положительными рецепторами эстрогенов и/или прогестерона. Более трети (78%) больных имели висцеральные метастазы. Нео- и/или адъювантную терапию получали 47% включенных пациенток, причем 40% из них – антрациклин-содержащую терапию, 23% – таксаны, а 10,5% – трастузумаб-содержащие режимы.
Рандомизация проводилась в соотношении 1:1 в следующие группы терапии: пертузумаб+трастузумаб+до-цетаксел (исследовательская группа) и плацебо+трастузумаб+доцетаксел (группа контроля). Предусматривалась стратификация по стране участнику исследования и наличию/отсутствию предшествующей нео- и/или адъювантной терапии.
Пертузумаб вводили каждые 3 недели: нагрузочная доза – 840 мг и далее – по 420 мг. Трастузумаб использовался в стандартном 3-недельном режиме: 8 мг/кг – нагрузочная доза и далее – по 6 мг/кг. Доцетаксел начинали использовать в дозе 75 мг/м2, и в отсутствие значимой гематологической токсичности при последующих курсах доза могла быть увеличена до 100 мг/м2.
Минимальное число курсов доцетаксела при условии отсутствия прогрессирования болезни составило 6. Лечение проводилось до прогрессирования или развития непереносимой токсичности. Оценку эффективности проводили каждые 9 недель.
Первичной целью исследования стала выживаемость без прогрессирования (по оценке независимых экспертов). Вторичными целями – выживаемость без прогрессирования по оценке исследователей, общая выживаемость, непосредственная эффективность и переносимость лечения.
Первый запланированный анализ был проведен в мае 2011 г. при медиане наблюдения 19,3 месяца. Медиана выживаемости без прогрессирования (по оценке независимых экспертов) в контрольной группе, получавшей трастузумаб, доцетаксел и плацебо, составила 12,4 месяца, в то время как в исследовательской группе, получившей два анти-HER2-препарата и доцетаксел, – 18,5 месяца. Таким образом, различие в показателях медианы выживаемости без прогрессирования составило 6,1 месяца (отношение рисков [ОР]=0,62; 95% доверительный интервал [ДИ] – 0,51–0,75; p<0,001). Для 88 больных, ранее получавших нео- и/или адъювантную терапию трастузумабом, медиана выживаемости без прогрессирования составила 10,4 месяца в контрольной группе и 16,9 – в исследовательской (ОР=0,62, 95% ДИ – 0,35–1,07). Медиана выживаемости без прогрессирования у больных без предшествующей терапии трастузумабом также была значимо выше в исследовательской группе и составила 21,6 месяца по сравнению с 12,6 – у больных, получавших только трастузумаб и доцетаксел (ОР=0,6; 95% ДИ – 0,43–0,83).
Объективный ответ (полный+ частичный регресс) был достигнут в 69,3% случаев в группе контроля и в 80,2% в исследовательской группе соответственно (р=0,001).
Второй промежуточный анализ был проведен в мае 2012 г. при медиане наблюдения 30,1 месяца в группе плацебо и 29,7 – в группе терапии с включением пертузумаба [9].
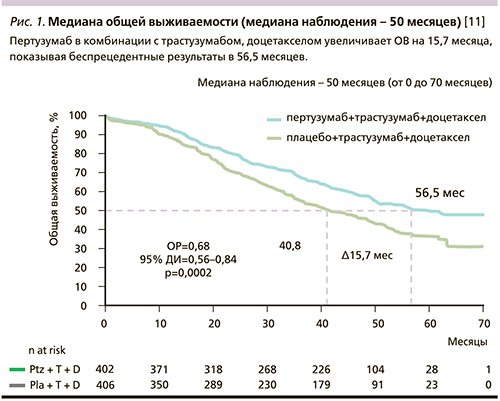
Время до прогрессирования и частота объективного эффекта не изменились, анализ общей выживаемости показал, что ОР смерти от прогрессирования метастазов РМЖ был на 34% меньше в группе больных, получавших пертузумаб. Число летальных исходов в группе плацебо было выше по сравнению c группой терапии с включением пертузумаба – 38% (154 из 406) против 28% (113 из 402) (ОР=0,66; p=0,0008).
После получения впечатляющих результатов второго промежуточного анализа о преимуществе комбинации двух анти-HER2-препаратов (трастузумаб и пертузумаб) с июля 2012 г. все больные группы плацебо стали получать комбинацию трастузумаба и пертузумаба (crossover). Лечение во II, III и последующих линиях (после окончания терапии в рамках исследования) было сопоставимым в обеих группах.

При сравнении переносимости двух режимов частота развития нежелательных явлений в целом была сопоставимой. Различия отмечены в отношении таких нежелательных явлений, как диарея, сыпь, мукозиты, фебрильная нейтропения, сухость кожи. Больные, получавшие два анти-HER2-препарата, имели эти нежелательные явления чаще по сравнению с контрольной группой (табл. 1), однако эти нежелательные явления были преимущественно 1–2-й степени выраженности и не приводили к изменению плана лечения. В то же время кардиальная токсичность (систолическая дисфункция левого желудочка и снижение фракции выброса более чем на 10% по сравнению с исходным уровнем или менее 50%) чаще отмечалась у больных контрольной группы.
В сентябре 2014 г. в рамках конгресса ESMO (European Society for Medical Oncology) доложен окончательный анализ общей выживаемости при медиане наблюдения 50 месяцев. Медиана общей выживаемости в группе плацебо составила 40,8 месяца по сравнению с 56,5 – в исследовательской группе больных, которые получили трастузумаб, пертузумаб и доцетаксел (ОР=0,68; 95% ДИ – 0,56–0,84; p=0,0002) [10]. Кривые выживаемости представлены на рис. 1.
На основании проведенного исследования комбинация трастузумаб+пертузумаб +доцетаксел рекомендована FDA (Food and Drug Administration)в качестве I линии лечения метастатического РМЖ с гиперэкспрессией HER2.
Большой интерес представляет проведенный поданализ в рамках исследования CLEOPATRA, который оценивал частоту развития метастазов в головной мозг [12]. В общей популяции больных РМЖ метастазы в головной мозг выявляются в 6–16% случаев [13–15]. В то же время при РМЖ с гиперэкспрессией HER2 частота выявления метастазов в головной мозг составляет 28–43% [16]. В исследовании Gabos и соавт. [17] при поливариантном анализе было показано, что гиперэкспрессия HER2 является независимым прогностическим фактором развития метастазов в головной мозг (ОР=4,23; 95% ДИ 1,84–9,47; р<0,0007). Аналогичные данные получены при проведении ретроспективного анализа 9524 больных ранними стадиями РМЖ с гиперэкспрессией HER2 [18].
Следует отметить, что общая выживаемость больных РМЖ с гиперэкспрессией HER2 с метастазами в головной мозг составляет от 17,1 до 23,5 месяца, в то время как для больных с HER2-отрицательным статусом – 9,4 месяца (р=0,0002) [19–21].
Анализ частоты метастазирования в головной мозг в исследовании CLEOPATRA проведен в мае 2012 г. (второй промежуточный анализ). На момент анализа из 808 больных, включенных в исследование, у 51 (12,6%) – группы плацебо и у 55 (13,7%) – группы пертузумаба были выявлены метастазы в головной мозг. При этом метастазы в центральную нервную систему (ЦНС) были единственным проявлением прогрессирования заболевания. У 11 больных группы плацебо и 8 – группы пертузумаба прогрессирование болезни отмечено со стороны как ЦНС, так и висцеральных органов. Медиана времени до появления метастазов в головной мозг составила 11,9 месяца для группы плацебо и 15,0 – для группы пертузумаба (ОР=0,58; 95% ДИ – 0,39–0,85; р=0,0049). Медиана общей выживаемости больных, у которых единственным проявлением прогрессирования заболевания были метастазы в ЦНС, составила 26,3 месяца для группы плацебо и 34,4 – для группы пертузумаба (ОР=0,66; 95% ДИ – 0,39–1,11; р=0,1139).
При проведении моновариантного анализа установлено, что фактором риска развития метастазов в головной мозг является наличие более 3 зон метастазирования (ОР=0,42; 95% ДИ – 0,28–0,63; р=0,0001).
Несмотря на то что частота развития метастазов в головной мозг была одинаковой для группы плацебо и группы пертузумаба, времени до выявления метастазов в головной мозг было достоверно больше у больных, получавших комбинацию пертузумаб+трастузумаб+доцетаксел. В то же время анализ общей выживаемости больных, для которых единственным проявлением прогрессирования заболевания были метастазы в ЦНС, статистической достоверности не показал. Тем не менее полученные результаты свидетельствуют о выраженной тенденции к значимому увеличению общей выживаемости больных РМЖ с метастазами в головной мозг, получивших в I линии лечения комбинацию пертузумаба, трастузумаба и доцетаксела.
Представленные результаты свидетельствуют о значимости применения наиболее эффективных комбинаций в I линии лечения, что обеспечивает адекватный контроль висцеральных проявлений болезни, тем самым увеличивая время до выявления метастазов в головной мозг и общую выживаемость больных метастатическим РМЖ с гиперэкспрессией HER2.
Частота развития РМЖ увеличивается с возрастом. По данным Hutchins и соавт., 49% больных РМЖ имеют возраст ≥65 лет, однако в клинических исследованиях принимают участие не более 9% больных данной возрастной категории. В связи с этим мы имеем лимитированные данные в отношении эффективности и безопасности применения химиотерапии в комбинации с анти-HER2-препаратами в отношении пожилых больных.
В исследовании CLEOPATRA проведен дополнительный субанализ эффективности и безопасности применения пертузумаба, трастузумаба и доцетаксела в I линии лечения HER2- положительного РМЖ в зависимости от возраста пациенток (<65 против ≥65 лет) [22]
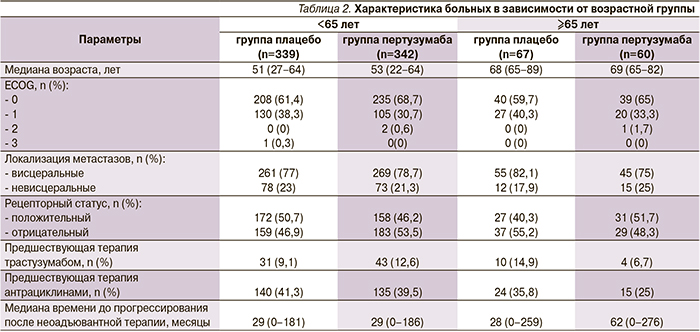
Из 808 больных, включенных в исследование, 681 (84,3%) была моложе 65 лет и 127 (15,7%) – в возрасте 65 лет и старше.
В табл. 2 представлены анализируемые клинические характеристики болезни в зависимости от возраста больных. В обеих возрастных группах, рандомизированных на получение пертузумаба, больные чаще имели ECOG 0. Молодые женщины чаще получали неоадъювантную терапию с включением трастузумаба и антрациклинов. В группе пертузумаба ≥65 лет отмечена более длительная медиана времени до развития метастатической болезни после окончания системной неоадъювантной терапии – 62 месяца по сравнению с 28 и 29 месяцами в остальных группах.
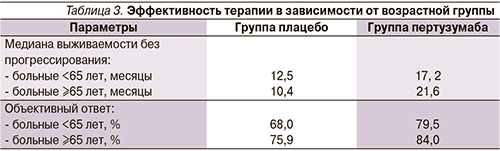
Медиана выживаемости без прогрессирования для больных моложе 65 лет составила 12,5 месяца в группе плацебо и 17,2 – в группе пертузумаба (ОР=0,65; 95% ДИ 0,53–0,80). В то время как в группе больных ≥65 лет составила 10,4 месяца в группе плацебо и 21,6 – в группе пертузумаба (ОР=0,52; 95% ДИ – 0,31–0,86).
Объективный ответ (полный+частичный регресс) от больных моложе 65 лет достигнут в 68% случаев в группе плацебо и 79,5% в группе пертузумаба, от пациентов ≥65 лет – 75,9% в группе плацебо и 84% – в группе пертузумаба. Эффективность применения комбинации пертузумаб+трастузумаб+доцетаксел по сравнению с плацебо+трастузумаб+доцетаксел в зависимости от возраста представлена в табл. 3.
Частота диареи, нейтропении и изменения вкуса была выше в группе терапии пертузумабом вне зависимости от возраста. После завершения терапии доцетакселом частота диареи, слабости и сыпи была выше в группе терапии пертузумабом по сравнению с группой плацебо в обеих возрастных категориях.
Побочные эффекты ≥3-й степени чаще встречались в группе пертузумаба по сравнению с группой плацебо вне зависимости от возраста. Диарея 3-й степени чаще (14,8%) отмечалась среди пожилых пациентов по сравнению с 6,6% в группе больных моложе 65 лет. Кроме того, у пожилых больных чаще отмечалась периферическая невропатия 3-й степени: 8,2% по сравнению с 1,7% в группе больных моложе 65 лет. С другой стороны, фебрильная нейтропения чаще встречалась в группе больных моложе 65 лет: 14,7% по сравнению с 8,2% у больных ≥65 лет. Следует отметить, что применение Г-КСФ (гранулоцитарного колониестимулирующего фактора) чаще требовалось группе больных моложе 65 лет по сравнению с больными ≥65 лет (39,0 против 19,7%).
При проведении однофакторного анализа было показано, что возраст не влияет на частоту развития систолической дисфункции левого желудочка. В связи с небольшим числом систолических дисфункций левого желудочка (n=51) провести адекватный анализ в зависимости от возраста не представляется возможным.
При интерпретации данных обращает на себя внимание длительность медианы выживаемости без прогрессирования в группе больных ≥65 лет, которая составила 21,6 месяца. Возможно, это связано с тем, что в подгруппе ≥65 лет большее число больных имели невисцеральные проявления болезни, меньшее число больных ранее получали неоадъювантную терапию трастузумабом и медиана времени до прогрессирования после окончания системной неоадъювантной терапии была значимо выше. Все это говорит о том, что среди больных, включенных в исследование CLEOPATRA, течение болезни имело более индолентный характер в старшей возрастной группе.
В группе больных ≥65 лет частота диареи ≥3-й степени встречалась чаще по сравнению с больными молодого возраста (14,8 против 6,6%), что говорит о необходимости более тщательного клинического мониторинга при использовании комбинации пертузумаб+трастузумаб+доцетаксел в рутинной практике.
Редукция дозы доцетаксела чаще отмечалась в группе больных старше 65 лет и медиана числа курсов доцетаксела составила 6 против 8 для группы <65 лет. Это, возможно, стало причиной более редкого применения Г-КСФ и меньшего числа фебрильных нейтропений в старшей возрастной категории. Тем не менее следует отметить что, несмотря на снижение дозы доцетаксела и меньшее число курсов терапии, общая эффективность в группе больных ≥65 лет была сопоставимой с таковой у больных молодого возраста. Это наблюдение в очередной раз ставит вопрос об оптимальной длительности химиотерапии при комбинации с анти-HER2-препаратами.
Комбинация пертузумаб+трастузумаб+доцетаксел не увеличивает риск развития дисфункции левого желудочка, не получено данных, свидетельствующих о развитии отсроченной кумулятивной кардиотоксичности вне зависимости от возраста.
Основываясь на данных по эффективности и безопасности, полученных в исследовании CLEOPATRA, мы считаем, что применение комбинации пертузумаб, трастузумаб и доцетаксел в I линии лечения метастатического HER2-положительного РМЖ не должно быть лимитировано возрастом больных.
Описание клинического случая больной П. 1952 г.р.
Диагноз: Рак левой молочной железы T3N2M1 IV стадии с множественными метастазами в легкие установлен в ноябре 2009 г. По данным гистологического исследования биоптата опухоли левой молочной железы, инфильтративный протоковый рак 2-й степени злокачественности. При иммуногистохимическом исследовании: РЭ (рецепторы эстрогенов) и РП (рецепторы прогестерона) – отрицательные, HER2/neu – 3+.
При компьютерной томографии (КТ) органов грудной клетки, брюшной полости и малого таза с внутривенным (в/в) контрастированием (до начала лечения, см. рис. 2а, б) в левой подмышечной области определяются конгломераты увеличенных лимфатических узлов 3,6 и 2,6 см; в обоих легких, практически во всех сегментах, определяются многочисленные мелкие метастазы размером до 5 мм.
С ноября 2009 по май 2010 г. проведено 9 курсов химиотерапии в комбинации с таргетной терапией в рамках исследования CLEOPATRA в режиме: доцетаксел 75 мг/м2 в/в день 1-й каждые 3 недели на фоне терапии трастузумабом 8 мг/кг (нагрузочная доза), затем 6 мг/кг в/в день 1-й, каждые 3 недели, и пертузумабом 840 мг (нагрузочная доза), далее 420 мг в/в день 1-й, каждые 3 недели. Эскалация дозы доцетаксела не проводилась.
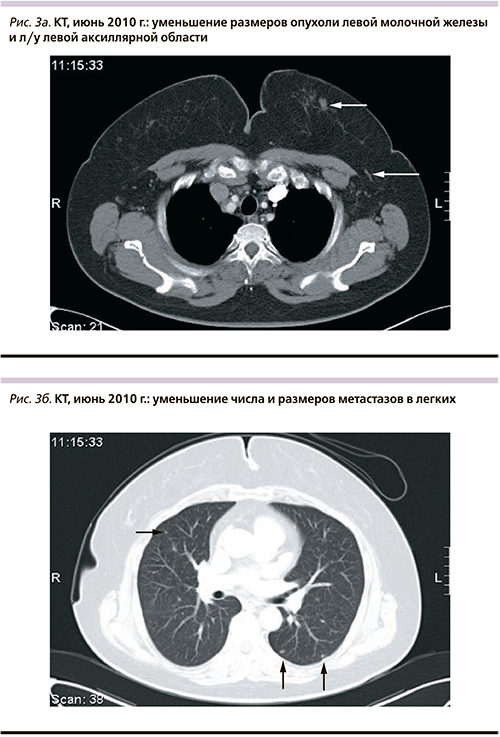
Максимальный эффект лечения при оценке каждые 12 недель по критериям RECIST – частичный регресс с полной резорбцией первичной опухоли, достигнутый после 9 курсов терапии: КТ органов грудной клетки и брюшной полости с в/в контрастированием (см. рис. 3а, б) – в левой подмышечной области определяются отдельные увеличенные лимфатические узлы до 1,5 см в диаметре; в обоих легких остались единичные мелкие очаги, размеры которых уменьшились до 1–2 мм. На фоне лечения клинически значимой токсичности, в т.ч. и кардиологической, отмечено не было.
С июня 2010 г. по настоящее время проведено 74 курса терапии трастузумабом (6 мг/кг в/в день 1-й, каждые 3 недели) и пертузумабом (420 мг в/в день 1-й, каждые 3 недели).
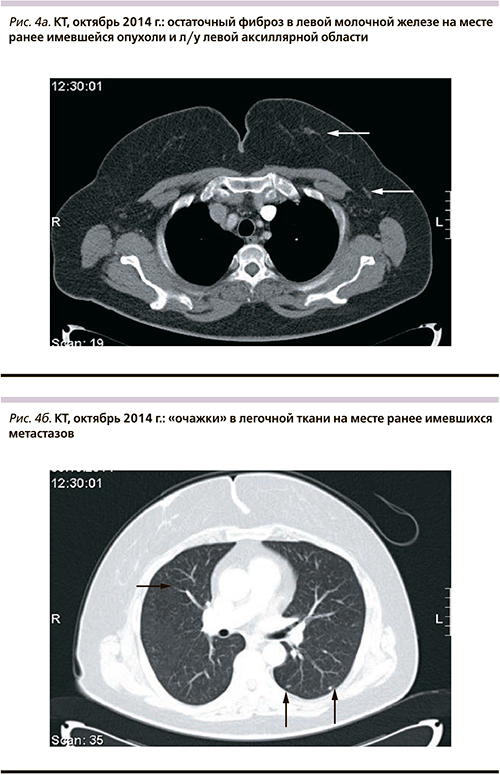
Достигнутый эффект сохраняется по настоящее время (последнее контрольное обследование выполнено 06.10.2014, см. рис. 4а, б), длительность терапии I линии составила 60 меся-цев.
Заключение
Таким образом, в исследовании CLEOPATRA было показано, что применение комбинации пертузумаба и трастузумаба с доцетакселом позволяет добиваться самого продолжительного показателя медианы общей выживаемости из всех полученных на сегодняшний день в рамках клинических исследований с включением больных HER2-положительным метастатическим РМЖ. Впервые продолжительность жизни в этой исходно неблагоприятной группе больных приблизилась к 5-летнему рубежу. При этом существенное увеличение эффективности терапии комбинацией двух таргетных анти-HER2-препаратов не сопровождалось ухудшением переносимости лечения.
На наш взгляд, внедрение данной комбинации пертузумаба и трастузумаба с доцетакселом в клиническую практику значительно расширяет возможности лечения пациентов с распространенным HER2-положительным РМЖ и должно способствовать изменению стандартов терапии для этой категории больных
Имеющиеся результаты открывают многообещающие перспективы применения данной комбинации и при раннем РМЖ в качестве (нео)адъювантной терапии.



