Введение
Обструктивное апноэ сна (ОАС) признается одним из доминирующих заболеваний группы расстройств сна, распространенных среди 25% популяции в целом с увеличением в настоящее время его встречаемости до 65% у лиц с ожирением [1]. В то же время ОАС – гетерогенное респираторное заболевание с повторяющимися эпизодами остановок дыхания (апноэ) и эпизодами гиповентиляции (гипопноэ) во время сна, приводящими к громкому храпу, избыточной дневной сонливости, утренней головной боли, никтурии, нарушению обмена веществ [2, 3].
Терапия постоянным положительным воздухоносным давлением (от анг. Continuous Positive Airway Pressure, или СРАР-терапия) в настоящее время является единственной обоснованной патогенетической терапией, влияющей на метаболический профиль пациентов с ОАС [4]. Положительные эффекты такой терапии очевидны, однако в предыдущих исследованиях они оценивались за короткий промежуток времени (не более 3 месяцев) в разнородной группе пациентов с ОАС, в связи с чем полученные результаты достаточно противоречивы. Более того, в случаях длительного проведения СРАР-терапии оценка не затрагивала основных компонентов метаболического профиля, а сами пациенты относились к группе среднетяжелого и тяжелого течения ОАС [5, 6].
Цель исследования: в настоящем исследовании исследовалось влияние длительной (годичной) СРАР-терапии на метаболический профиль пациентов с легким течением ОАС, изменяющее современные представления о возможностях такой терапии.
Методы
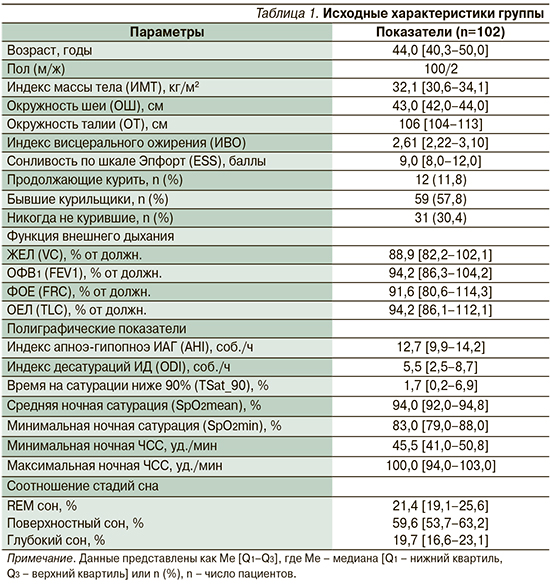
В годичное когортное исследование были включены 102 пациента, из них 100 (98%) мужчин, с медианой возраста 44 года (от 40 до 50 лет), имевших верифицированное легкое течение ОАС (индекс апноэ-гипопноэ – AHI от 5 до 15 часов) и метаболические нарушения, Все пациенты подписали информированное согласие на участие.
Всем пациентам проводили врачебный осмотр и комплексное медицинское обследование. Их интервьюировали на длительность и начало набора массы тела, число предшествовавших попыток его снижения, прием лекарственных препаратов и/или биологически активных добавок для коррекции массы тела, особенности режима питания и калорийности суточного рациона, физической активности. Все пациенты находились на подобранной антигипертензивной и гиполипидемической терапии.
Критери исключения: любые хронические заболевания, влияющие на дыхание, в т.ч. неврологические, мышечные или легочные нарушения, деформация позвоночного столба или грудной стенки, декомпенсированная застойная сердечная недостаточность, а также прием лекарств, подавляющих дыхательный импульс, например снотворных. Основные характеристики группы приведены в табл. 1.
Пациентам проводилась таргетная СРАР-терапия в соответствии с рекомендациями Американской академии медицины сна (AASM) для достижения оптимальной коррекции ОАС уровнем AHI<5/ч [7]. Контрольными точками наблюдения являлись 0, 3, 6, 12-й месяцы наблюдения.
Исследование выполнялось на кафедре фтизиатрии и пульмонологии лечебного факультета МГМСУ им. А.И. Евдокимова МЗ РФ, на базе Больницы Центросоюза РФ (Москва), соответствовало стандартам добросовестной клинической практики (GCP) и принципам Хельсинкской декларации, было одобрено межвузовским этическим комитетом МГМСУ им. А.И. Евдокимова.
Для выявления ОАС всем пациентам проводилась ночная полиграфия методом компьютерной сомнографии (КСГ), основанной на технологии определения эпизодов апноэ и их последствий по вариации изменений периферического артериального тонуса PAT (periferal arterial tone) в соответствии с унифицированными правилами и рекомендациями AASM (American Academy of Sleep Medicine) [8, 9]. Диагностика ОАС выполнялась на мобильном аппаратном комплексе КСГ WatchPAT-200 (ItamarMedical, Caesarea, Израиль) с оригинальным программным обеспечением PATTMSW v. 5.1.77.7 (ItamarMedical, Caesarea, Израиль) путем регистрации основных респираторных полиграфических показателей в период 23.00–7.30. Индекс апноэ-гипопноэ сна (ИАГ) от 5 до 15/ч соответствовал легкому течению ОАС, от 15 до 30/ч – среднетяжелому течению ОАС, более 30/ч – тяжелому течению ОАС. Оценка ночной десатурации ODI (oxygen desaturation index), средней и минимальной ночной сатурации (SpO2), частоты сердечных сокращений (ЧСС), стадий сна выполнялась в соответствии с международными рекомендациями [10, 11].
Лечебный уровень СРАР-терапии титровался в домашних условиях с использованием аппаратов для автоматического выбора положительного давления «PR System One REMstar Auto CPAP Machine with A-Flex» (Philips Respironics, США) в течение 7 дней после диагностического исследования. Для оценки показателей эффективности вентиляционной поддержки на 0, 3, 6, 12-м месяцах наблюдения использовалась оригинальная программа анализа приверженности Encore Pro v.2.14 (Philips Respironics, США). За эффективность (успешность) СРАР-терапии принималось снижение AHI<5/ч при диапазоне значений положительного рабочего давления (СРАР) от 5,0 до 20,0 мбар [12].
Статистический анализ данных проводился с использованием коммерческих пакетов программ Statistica 13.0 (TIBCO Software Inc., США) и PASW Statistics v.18 (IBM, США). Распределение количественных признаков и качественных порядковых признаков с числом рангов более 5 описывались мeдианами (Me) и квартилями (нижним Q1 и верхним Q3). Распределение качественных номинальных и бинарных признаков, а также качественных порядковых признаков с малым числом рангов описывались абсолютными и относительными частотами их значений. Для сравнения связанных групп применялись ANOVA Фридмена и post-hoc сравнения (критерий Вилкоксона). При проверке гипотез пороговым уровнем значимости считался p<0,05. Для нивелирования проблемы множественных сравнений применялась поправка Бонферрони.
Результаты исследования
Под «метаболическим профилем» исследуемых пациентов понимался комплекс нарушений, оцениваемых по характеру изменений липидного и углеводного обменов, динамике клинико-антропометрических показателей (табл. 2), оцениваемых на 0, 3, 6, 12-м месяцах наблюдения. Необходимо отметить, что все пациенты с ОАС (n=102) ответили на СРАР-терапию и успешно завершили исследование без значимых побочных эффектов.
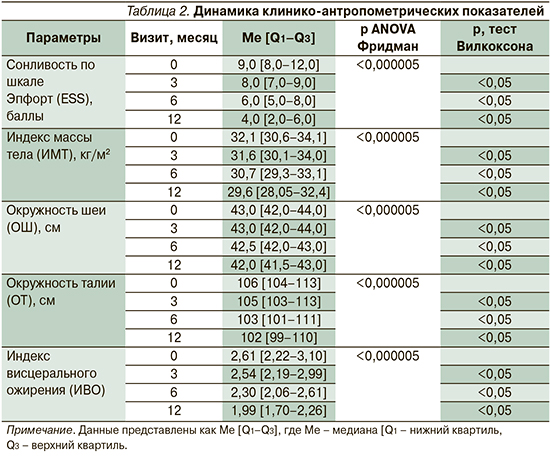
СРАР-терапия имела положительное влияние на основные клинико-антропометрические показатели, достигающие порогового уровня «нормализации» на 6-й и 12-й месяцы терапии. Например, устранение избыточной дневной сонливости (ESS) к 12-му месяцу терапии: 4,0 [2,0–6,0] против 9,0 [8,0–12,0], p<0,05, сочеталось с клинически и статистически значимым уменьшением индекса массы тела (ИМТ): 29,6 [28,05–32,4] против 32,1 [30,6–34,1], p<0,05, и индекса висцерального ожирения (ИВО): 1,99 [1,70–2,26] против 2,61 [2,22–3,10], p<0,05.
Оценка нарушений углеводного обмена учитывала уровень глюкозы в крови натощак и через 2 часа после нагрузки глюкозой, уровень базального инсулина, величину индекса инсулинорезистентности (табл. 3).
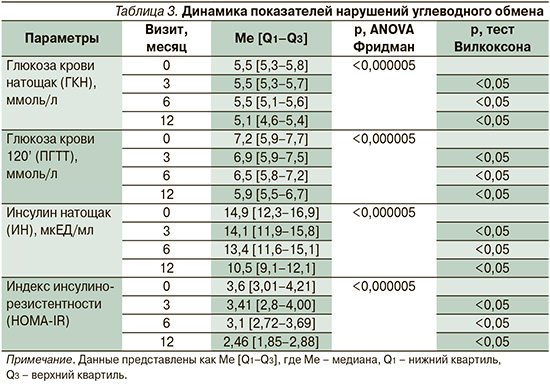
СРАР-терапия имела положительное влияние на основные показатели углеводного обмена. Так, на 12-м месяце терапии статистически значимо снизился уровень инсулина натощак: 10,5 [9,1–12,1] против 14,9 [12,3–16,9], p<0,05, и показатель инсулинорезистентности (HOMA-IR): 2,46 [1,85–2,88] против 3,6 [3,01–4,21], p<0,05. По данным индекса HOMA-IR, инсулинорезистентность исходно выявлялась у 86 (84,3%) пациентов группы. К концу наблюдения нормальные значения данного параметра (<2,77) отмечались у 63 (65,6%) пациентов.
Оценка нарушений липидного обмена учитывала уровень холестерина (ХС), липопротеидов высокой плотности (ЛПВП), липопротеидов низкой плотности (ЛПНП); триглицеридов (ТГ), аполипопротеина B (Апо-B) (табл. 4).
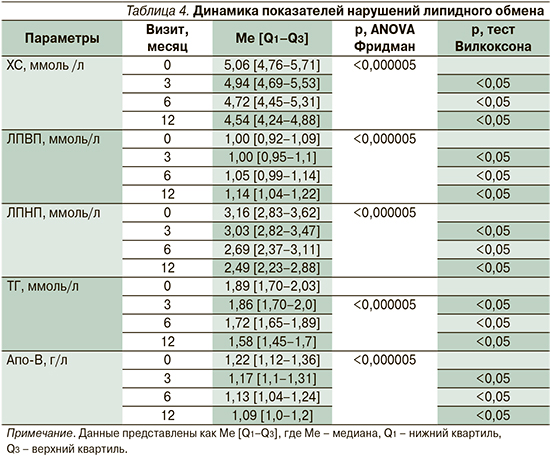
СРАР-терапия имела положительное влияние на основные показатели липидного обмена, достигающие порогового уровня «нормализации» на 6-й месяц лечения. Так, к 6-му месяцу терапии отмечалось статистически значимое снижение уровня ЛПНП: 2,69 [2,37–3,11] против 3,16 [2,83–3,62], p<0,05 и Апо-B: 1,13 [1,04–1,24] против 1,22 [1,12–1,36], p<0,05, что сочеталось с увеличением уровня ЛПВП: 1,05 [0,99–1,14] против 1,00 [0,92–1,09], p<0,05.
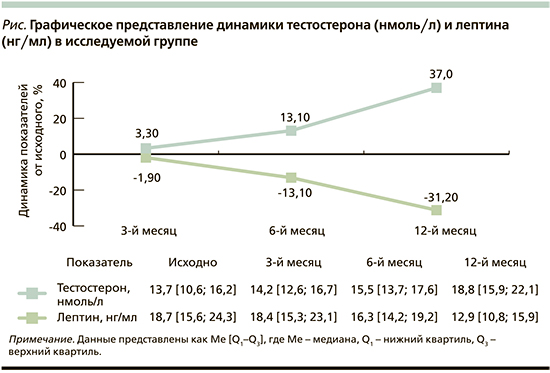
Оценка нарушений гормонального фона учитывала уровень тестостерона и лептина (см. рисунок). СРАР-терапия имела положительное влияние на динамику лептина (медиатор энергетического обмена наряду с инсулином) и тестостерона (основной мужской половой гормон). Клинически и статистически значимое снижение уровня лептина к 12-му месяцу терапии: 12,9 [10,8–15,9] против 18,7 [15,6–24,3], p<0,05, сочеталось с увеличением уровня тестостерона: 18,8 [15,9–22,1] против 13,7 [10,6–16,2], p<0,05, что клинически проявлялось улучшением настроения и работоспособности.
Обсуждение
Коморбидные пациенты с легким течением ОАС, имеющие метаболические нарушения, зачастую находятся вне поля зрения практикующих специалистов. С одной стороны, это объясняется плохим распознаванием ОАС по характерным клиническим маркерам [13], отсутствием доступности диагностических устройств (компьютерной сомнографии) и низкой обращаемостью таких пациентов за врачебной помощью. С другой стороны, пациенты легкого течения ОАС с «метаболическими расстройствами» демонстрируют многократно повышенные риски фатальных и нефатальных сердечно-сосудистых событий или осложнений, особенно при формировании у них резистентной артериальной гипертензии [14]. Это заставило нас обратить на них особое внимание, особенно как на кандидатов для длительной СРАР-терапии – единственно обоснованной стратегии жизнь - сберегающей терапии пациентов с ОАС [15].
Для устранения возможных искажений в интерпретации результатов мы изучили пациентов с ОАС, ранее получавших подобранную антигипертензивную и гиполипидемическую терапию. Необходимо отметить, что была использована беспрецедентная длительность наблюдения за пациентами (12 месяцев), позволившая нам установить границы наступления положительных эффектов СРАР-терапии, не обнаруженных ранее в других исследованиях по причине их малой продолжительности (не более 3 месяцев) [5, 6]. Наши данные согласуются с таковыми ряда исследований по изучению взаимосвязей апноэ сна с инсулинорезистентностью, липидным и гормональным профилями пациентов со среднетяжелым и тяжелым течением ОАС [16–18]. Основные эффекты СРАР-терапии на «метаболический профиль» пациентов ОАС, вероятнее всего, связаны с устранением фрагментации сна и ночной гипоксемии, особенно при автоматическом выборе СРАР-терапии длительностью более 6 месяцев [15]. Эта гипотеза подтверждается и в нашем исследовании, когда положительное воздействие СРАР-терапии на основные составляющие «метаболического профиля» и дневной сонливости пациентов легкого течения ОАС наступает в диапазоне 6–12 месяца.
Заключение
В заключение следует отметить, что длительная СРАР-терапия необходима всем коморбидным (метаболическим) пациентам с легким течением ОАС, поскольку положительное влияние на метаболический профиль устраняет имеющиеся у них высокие риски кардиоваскулярных осложнений и по своей сути является жизнь-сберегающей терапией [18].



