Введение
В России, как и во многих других странах, сахарный диабет 2 типа (СД2) является социально значимым заболеванием. Распространенность СД2 крайне высока и увеличивается с каждым годом, однако эффективность контроля гликемии при этом заболевании все еще недостаточна. Этим обусловлен рост частоты микро- и макрососудистых осложнений СД2, определяющих прогноз жизни пациента. Согласно клиническому исследованию PANORAMA (кросс-секционный анализ данных по гликемическому контролю, собранных у 5817 пациентов с СД2), в Европе большая доля пациентов с СД2 имеет уровень гликированного гемоглобина (HbA1c) ≥7% [1] (рис. 1).
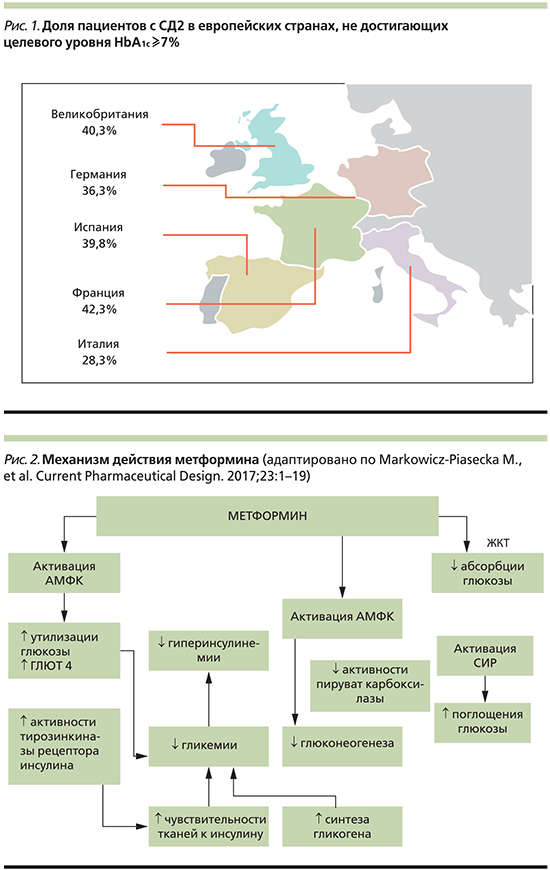
Масштабность проблемы еще более значительна, если принять во внимание тот факт, что наряду с официально зарегистрированными случаями СД2 у значительной части населения диагноз не установлен и имеет место нарушенная толерантность к глюкозе (НТГ) или нарушение гликемии натощак [2]. Согласно исследованию NATION с использованием анкетирования и скринингового определения HbA1c, почти одна пятая населения России находится в стадии предиабета (19,26%) [3]. Высокий риск развития сердечно-сосудистых катастроф имеют не только пациенты с СД2, но и лица с предиабетом. Согласно данным исследования E. Selvin et al. (n=15 792), уровень HbA1c в диапазоне 5,5–6,0% ассоциировался с увеличением риска развития сердечно-сосудистых заболеваний (ССЗ) на 30%, инсульта на 20%, смерти по любой причине на 20%; повышение HbA1c до 6,0–6,5% приводило к увеличению ССЗ на 90%, инсульта в 2 раза, смерти по любой причине на 60% [4]. В исследовании Multi-Ethnic Study of Atherosclerosis (MESA), включившем 10-летний период наблюдения за 6000 лицами, установлено, что предиабет сопровождается трехкратным повышением риска инфаркта миокарда по сравнению с лицами с нормальной толерантностью к глюкозе [5].
Метаболические нарушения, приводящие к развитию микро- и макрососудистых осложнений, возникают задолго до клинического дебюта СД2 и к моменту диагностики недуга приводят к необратимым сосудистым и неврологическим нарушениям. Считается, что первым метаболическим дефектом является инсулинорезистентность (ИР), развитие которой определяет взаимовлияние генетических и приобретенных факторов [6, 7]. В механизмах ее формирования важную роль играют такие нарушения, как липотоксичность, воспаление, глюкотоксичность, митохондриальная дисфункция [8]. Степень ИР и заболеваемость СД2 наиболее выражены среди лиц с абдоминальным ожирением. В клинической практике для его диагностики используется измерение окружности талии [9]. О наличии абдоминального ожирения свидетельствует увеличение окружности талии более 94 см у мужчин и более 80 см у женщин [20].
В условиях тканевой ИР увеличивается продукция инсулина печенью, снижается утилизация глюкозы периферическими тканями. Существует прямая связь между увеличением продукции глюкозы печенью и гипергликемией натощак [7, 10]. Печень играет ключевую роль в регуляции гомеостаза глюкозы, которая выделяется из этого органа в результате гликолиза и глюконеогенеза (1,8–2,2 мг/кг/мин) [9]. Вклад этих метаболических процессов в поддержание углеводного гомеостаза может меняться в разное время суток. В частности, в ночное время около 75% глюкозы печеночного происхождения образуется путем гликогенолиза, а оставшаяся часть – путем глюконеогенеза. Однако по мере удлинения периода ночного голодания глюконеогенез все более преобладает над гликогенолизом [11].
Компенсаторная гиперинсулинемия (ГИ), развивающаяся в условиях снижения чувствительности тканей к действию инсулина, усиливает поглощение глюкозы периферическими тканями, а также уменьшает гепатическую продукцию глюкозы, что определенное время поддерживает нормальное содержание глюкозы крови [6]. Компенсаторная ГИ сопровождается гиперплазией, увеличением количества β-клеток и повышением экспрессии генов ключевых ферментов, участвующих в метаболизме глюкозы. Ослабление подавления гепатической продукции глюкозы после приема пищи играет значимую роль в ухудшении гомеостаза глюкозы в постпрандиальный период [12]. Свой вклад в данный процесс вносят изменения в секреторной функции β-клеток на фоне постоянной стимуляция в сочетании с генетическими дефектами их функции и воздействием липотоксичности. Кроме того, избыток свободных жирных кислот (СЖК) стимулирует печеночный глюконеогенез, подавляет транспорт глюкозы в мыщцы [13].
Истощение ресурсов β-клеток (дефицит ранней фазы секреции инсулина) способствует развитию НТГ, а затем и клиническому СД2. Сама по себе хроническая гипергликемия снижает способность β-клеток секретировать необходимое количество инсулина в ответ на различные стимулы (феномен глюкотоксичности) [14, 15].
ГИ и ИР – независимые факторы риска развития ишемической болезни сердца (ИБС). Для предупреждения сердечно-сосудистой смертности необходимо раннее начало лечения нарушений углеводного обмена (на стадии предиабета) [16].
Выбор ИР в качестве мишени лечения нарушений углеводного обмена позволяет улучшать чувствительность к инсулину и позитивно воздействовать на сопутствующие метаболические нарушения. К средствам, влияющим на ИР, относятся бигуаниды: метформин обычного высвобождения и метформин пролонгированного действия [17].
В настоящее время метформин рассматривается как средство первой линии в лечении СД2 и должен применяться всеми пациентами, не имеющими к нему противопоказаний [18, 19]. Бигуаниды, как и производные сульфонилмочевины (ПСМ), наиболее эффективны среди неинсулиновых сахароснижающих препаратов (ССП), снижая уровень HbA1c на 1,5–2,0% [16], при этом вариабельность степени снижения гликемии связана с ее исходным уровнем до инициации лечения этими препаратами. Метформин может быть назначен как в монотерапии, так и в комбинации с любым другим пероральным противодиабетическим средством и инсулином.
Механизмы действия метформина
Принимая во внимание, что СД2 – это хроническое прогрессирующее заболевание, крайне важно сохранение функциональной активности β-клеток. Фармакологическое действие метформина не связано со стимуляцией инсулярного аппарата. В присутствии инсулина препарат подавляет гепатическую продукцию глюкозы за счет повышения чувствительности гепатоцитов к этому гормону, что приводит к нормализации гликемии натощак, усиливает чувствительность жировой и мышечной ткани к инсулину, замедляет всасывание углеводов на уровне тонкой кишки (рис. 2). Повышая чувствительность тканей к инсулину, снижая глюко- и липотоксичность, метформин опосредованно улучшает секрецию инсулина и способствует сохранению секреторного потенциала β-клеток [20, 21]. Снижение уровня глюкозы происходит без риска гипогликемических состояний, что является несомненным достоинством препарата.
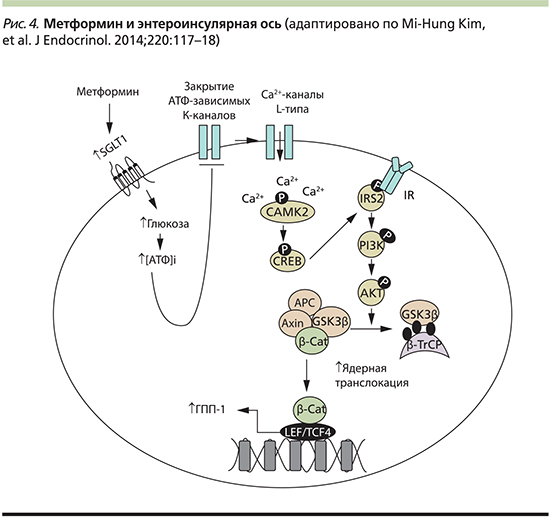
За антигипергликемический эффект метформина ответственны несколько молекулярных механизмов, причем основное его действие осуществляется на уровне митохондрий клеток печени. Транспорт метформина из крови в гепатоциты опосредован ОСТ1 – членом семейства белков-транспортеров органических катионов [22]. Интересно, что генетический полиморфизм ОСТ1 у человека может определять вариабельность клинической эффективности метформина. На молекулярном уровне метформин ингибирует комплекс I дыхательной цепи митохондрий в печени, что приводит к активации АМФ-протеинкиназы (AMPK; рис. 3) – важного регулятора клеточного энергетического гомеостаза, клеточного роста, пролиферации, который координирует многочисленные метаболические пути. Под воздействием метформина АМРК активируется путем ингибирования митохондриальной дыхательной цепи и увеличения активных форм азота и повышения соотношения АМФ/АТФ внутри клетки как наиболее чувствительного индикатора энергетического статуса, что обусловлено конкурентным связыванием АМФ и АТФ с AMPK [23]. Опосредованная метформином активация АМРК приводит к восстановлению энергетического гомеостаза путем увеличения поглощения глюкозы в скелетных мышцах, подавления экспрессии ферментов глюконеогенеза в печени и повышения чувствительности к инсулину (посредством воздействия на метаболизм жиров) [19, 24].
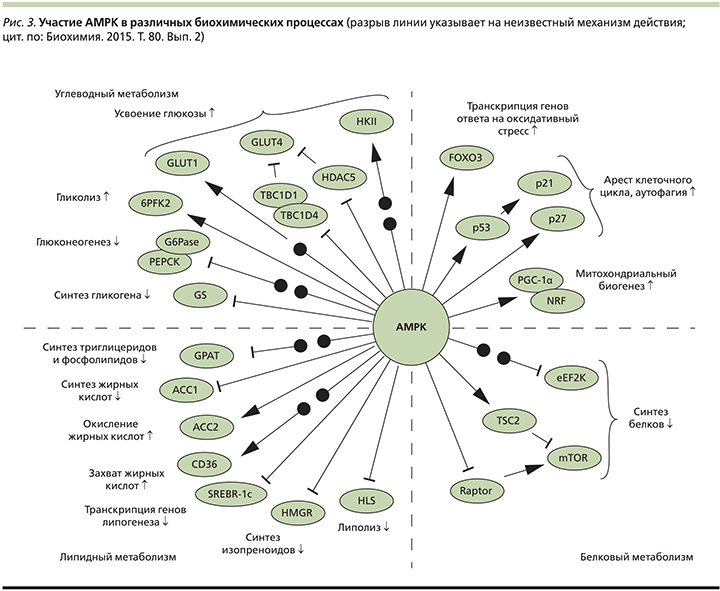
Метформин также оказывает AMPK-независимое воздействие на печень, которое может включать ингибирование фруктозо-1,6-бисфосфатазы AMФ. Кроме того, на фоне снижения уровней АТФ, вызываемого метформином, гепатоцитам приходится, соответственно, уменьшать продукцию глюкозы [23, 24].
Меформин обладает и рядом других метаболических эффектов, включая и влияние на липотоксичность: снижение продукции и окисление СЖК, уровня триглицеридов и холестерина липопротеидов низкой плотности, положительное влияние на постпрандиальный липидный профиль. Снижение поступления СЖК в печень, синтеза триглицеридов и повышение чувствительности к инсулину сопровождаются уменьшением отложения жира в этом органе [25].
Метформин и желудочно-кишечный тракт
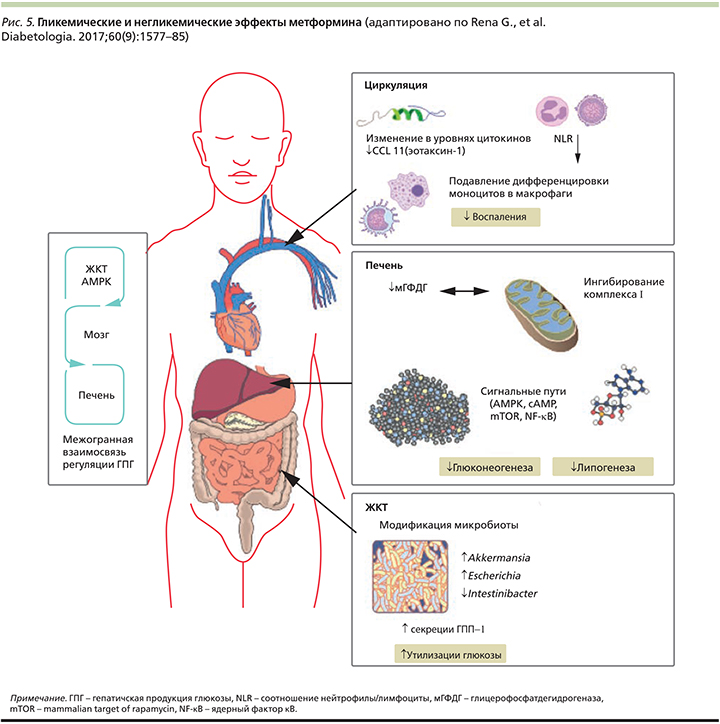
Желудочно-кишечный тракт (ЖКТ) является мишенью для действия метформина [26]. В исследованиях показано, что этот препарат влияет на гомеостаз глюкозы посредством изменения уровня глюкагоноподобного пептида-1 (ГПП-1; рис. 4) [27, 28]. Предполагаемое влияние метформина на секрецию ГПП-1 (повышение) может быть связано с активацией Wnt-сигнальных путей в L-клетках кишечника, а также стимуляцией экспрессии генов, кодирующих рецепторы ГПП-1 и глюкозозависимого инсулинотропного полипептида в островках Лангерганса, а также увеличением экспрессии генов белков-предшественников – преглюкагона, проглюкагона [26]. Однако все еще необходимы исследования в этой области.
Стало очевидно, что метаболические эффекты метформина отчасти связаны с изменением кишечной микробиоты (рис. 5) [23]. В частности, применение метформина сопровождается повышением количества видов бактерий рода Escherichia, Akkermansia muciniphila, Subdoligranulum, в т.ч. бактерий, продуцирующих короткоцепочечные жирные кислоты (бутират), которые стимулируют синтез инкретинов. Микробный анализ показал достоверное снижение потенциала микробиоты к продукции бутирата у больных СД2 [29].
Оказывая влияние на всасывание углеводов в ЖКТ, замедляя его скорость, а также снижая аппетит, метформин способствует уменьшению постпрандиальной гликемии, ассоциированной с риском преждевременной смертности от ССЗ [20, 23].
Терапия метформином препятствует увеличению массы тела либо способствует ее снижению, в т.ч. и при применении в комбинации с инсулином [17, 25], что является значимым преимуществом препарата. Потенциальное влияние метформина на массу тела обусловлено несколькими механизмами, в т.ч. снижением концентрации инсулина и увеличением секреции ГПП-1.
Негликемические эффекты метформина
Принимая во внимание важность для прогноза пациента с СД2 не только достижения гликемического контроля, но и воздействия на другие факторы риска развития сердечно-сосудистой патологии, в последнее время большое значение придается негликемическим эффектам метформина (рис. 5) [8, 18, 25].
Примерно половина пациентов с СД2 имеют атерогенную дислипидемию, что неблагоприятно влияет на кардиоваскулярный прогноз. Эффекты метформина в отношении метаболизма липидов плазмы обусловлены его гиполипидемическим и антиатерогенным действиями. Как уже говорилось, метформин активирует АМРК, следствием чего является подавление экспрессии генов липидного метаболизма, таких как синтетаза СЖК (G001196), ацетил-CoA-карбоксилаза (G000684), S14, белок, связывающий стерол-регулирующий элемент-1 (SREBP-1c) [30]. Помимо этого метформин влияет на процесс биосинтеза мононенасыщенных жирных кислот из насыщенных через АМРК-опосредованное фосфорилирование рецептора тиреоидных гормонов-4 (TR4) [25]. Подобные эффекты являются дополнительным преимуществом метформина с позиции основной цели терапии СД2 – снижение кардиоваскулярной заболеваемости и смертности.
Дополнительные кардиопротективные эффекты метформина обусловлены и его влиянием на тромботические процессы, функцию эндотелия и сосудистую реактивность [31] (табл. 1). В частности, метформин снижает уровень маркеров активации тромбоцитов (тромбоцитарного фактора 4 и β-тромбоглобулина), концентрацию ингибитора активатора плазминогена-1 (ИАП-1), выработку молекул адгезии и фибриногена, тормозит активность XIII и VII факторов свертывания [20, 25, 26].
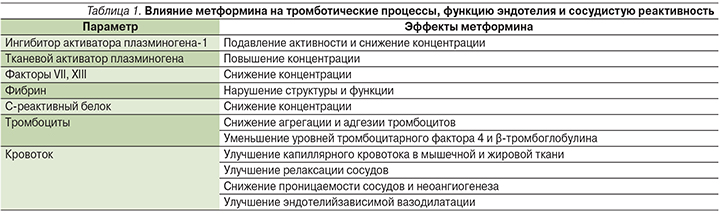
Метформин оказывает прямое противовоспалительное действие на сосудистую стенку, что в основном обусловлено подавлением сигнальных путей образования ядерного фактора κB (NF-κB), активация которого приводит к инициации транскрипции генов ряда цитокинов и молекул адгезии [17, 31].
В этом плане интересно, что на фоне терапии метформином отмечается снижение коэффициента нейтрофилы/лимфоциты (NLR) – независимого предиктора смерти, в т.ч. от кардиальных причин [32]. Помимо этого метформин влияет на функцию кардиоцитов и его применение ассоциировано с улучшением течения диабетической кардиомиопатии в экспериментальных моделях на животных с опосредованным АМPK переходом от апоптоза к аутофагии [33].
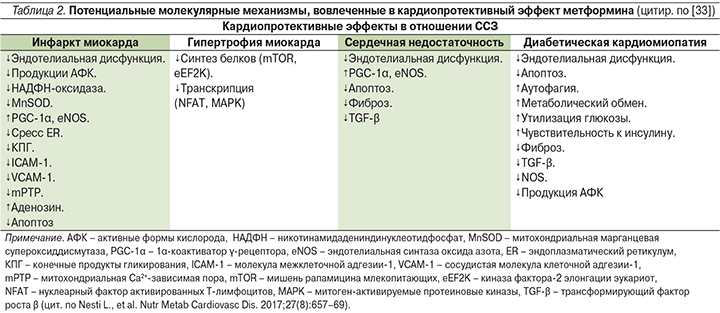
Потенциальные молекулярные механизмы, вовлеченные в кардиопротективный эффект метформина, продолжают активно изучаться (табл. 2) [33, 34].
Метформин и коморбидная патология у больных СД2
В настоящее время СД2 рассматривается как эквивалент наличия у больного клинически выраженного ССЗ, что выдвигает серьезные требования к долгосрочной кардиоваскулярной безопасности ССП [18]. Впервые благоприятное воздействие метформина на частоту развития ССЗ у пациентов с СД и ожирением установлено в исследовании UKPDS [35]: снижение риска сосудистых осложнений на 32%, инфаркта миокарда на 39%, смертности от СД и общей смертности на 42 и 36% соответственно по сравнению с традиционными методами лечения в течение 10-летнего периода. Дальнейшие исследования в этой области также продемонстрировали благоприятное влияние метформина (в монотерапии или в комбинации с другими ССП) на прогноз больных СД2 [36–38]. В частности, Канадский ретроспективный анализ базы данных пациентов (Saskatchewan Health databases, n=12272) показал значительное сокращение общей и сердечно-сосудистой смертности на 40 и 36% соответственно [36]. В другом масштабном исследовании терапия метформином ассоциировалась со значительным улучшением прогноза – снижением риска развития всех клинически значимых событий (на 28%), инфаркта миокарда (на 69%) и смертности от всех причин (на 61%) [37].
Интересны и поучительны результаты проспективного двухлетнего клинического исследования (D. Aguilar et al., 2011), в котором изучали клинические исходы (госпитализация по сердечной недостаточности, всем причинам и по смертность) у больных СД2 с хронической сердечной недостаточностью (ХСН; n=6185, из них 25,2% принимали метформин). Метформин продемонстрировал превосходство в отношении выживаемости пациентов с СД2: риск смерти в группе принимавших этот препарат был достоверно ниже на 24%. На основании этих результатов авторы сделали вывод: лечение метформином ассоциируется с более низкой смертностью пациентов с СД2 и ХСН, лечащихся амбулаторно [38].
Полученные данные демонстрируют целесообразность назначения метформина больным СД2 и ССЗ, особенно при наличии дополнительных факторов риска. Вместе с тем метформин противопоказан больным ХСН III–IV функциональных классов или ХСН, требующей госпитализации.
Эпидемиологические данные подтверждают факт частого сочетания двух патологических состояний – СД2 и неалкогольной жировой болезни печени (НАЖБП), взаимно утяжеляющих друг друга, способствуя ухудшению прогноза. Наличие НАЖБП налагает определенные ограничения на выбор сахароснижающей терапии. Наряду с контролем гликемии она должна также характеризоваться отсутствием негативного влияния на печень и массу тела. С учетом существенного повышения сердечно-сосудистого риска при сочетании СД2 и НАЖБП также важна кардиоваскулярная безопасность.
В такой клинической ситуации наряду с нормализацией гликемии метформин будет оказывать и другие позитивные метаболические эффекты. Как уже отмечалось, основной механизм действия метформина реализуется посредством активации АМРК в печени, что сопровождается снижением синтеза триглицеридов из жирных кислот, подавлением митохондриального β-окисления, снижением экспрессии фактора некроза опухоли α и транскрипционных факторов, ответственных за синтез холестерина из ацетил-коэнзима А [26]. Внимания заслуживает и антионкогенный эффект метформина. По данным мета-анализа, применение метформина пациентами с СД2 ассоциировано со статистически значимым регрессом риска развития гепатоцеллюлярной карциномы (отношение шансов – 0,38; 95% доверительный интервал – 0,24–0,59; p<0,001) [39].
Следует иметь в виду, что при признаках активности заболеваний печени любой этиологии с повышением уровня трансаминаз более чем в 3 раза следует воздержаться от применения метформина.
В последние годы большое внимание уделяется антиканцерогенному действию метформина, которое скорее всего осуществляется через активацию АМРК. Это приводит к ингибированию активности m-TOR центрального регулятора синтеза белка и клеточного роста с последующим восстановлением чувствительности к инсулину и снижением ГИ [40]. Эффект устранения ГИ метформином может играть важную роль в противоопухолевой активности, поскольку ГИ/ИР оказывает митогенные и пролиферативные эффекты и опухолевые клетки часто экспрессируют высокие уровни рецептора инсулина (IR-A) [23, 25].
Практические аспекты применения метформина
Метформин – это диметилбигуанид, абсорбирующийся в основном в тонком кишечнике, который за долгие годы применения в клинической практике показал высокую безопасность, обусловленную наличием в структуре двух метильных групп в положении N1, препятствующих образованию циклической структуры. Отсутствие длинных гидрофобных боковых цепей ограничивает способность метформина к связыванию с клеточной мембраной и активное накопление внутри клетки, чем обусловлена низкая вероятность лактацидоза [23, 25]. Биологический период полураспада в фазе абсорбции составляет 0,9–2,6 часа. Биодоступность препарата достигает 50–60%. Быстрая элиминация (период полувыведения от 1,7 до 4,5 часов) обусловливает выведение 90% метформина в неизмененном виде в течение 16–18 часов.
Профилактика СД2 все еще остается предметом изучения. В настоящее время метформин рекомендован не только как ССП, но и как средство профилактики СД2. В основных клинических исследованиях эффективности метформина для пациентов с предиабетом (DPP, DPPOS) показана возможность предотвращения СД2 у этих больных (снижение риска развития СД2 на 20–30%) [16].
Перед назначением препарата следует убедиться в отсутствии противопоказаний к его применению. Лечение метформином (Метформин Канон) инициируют с дозы 500–850 мг, принимаемой за ужином или на ночь. Со 2-й недели применения рекомендуется увеличить дозу препарата до 500–850 мг 2 раза в сутки (во время завтрака и ужина). Наиболее распространенными нежелательными явлениями при применении метформина являются расстройства со стороны ЖКТ (дискомфорт, диспепсические явления, диарея), отмечающиеся у 20–30% пациентов [22, 26]. Во избежание побочных явлений метформина необходима постепенная титрация дозы препарата, увеличение на 500–850 мг каждые 1–2 недели, а в некоторых случаях временное снижение до предыдущей дозы. Нежелательные явления обычно развиваются вскоре после инициации терапии метформином и уменьшаются по мере ее продолжения. Среди возможных молекулярных механизмов нежелательных явлений обсуждают изменения метаболизма серотонина (стимуляция продукции из энтерохромаффинных клеток кишечника, снижение транспорта серотонина) и желчных кислот. Генетические исследования показали важную роль ОСТ1 и транспортеров серотонина в переносимости метформина. С учетом роли OCT1 в нарушениях со стороны ЖКТ на фоне применения метформина необходимо принимать во внимание и влияние других препаратов на этот белок-транспортер; в частности, лицам с нежелательными явлениями на фоне терапии метформином следует избегать использования ингибиторов протонной помпы [23, 26].
Прием метформина может быть продолжен до показателя скорости клубочковой фильтрации >45 мл/мин/1,73 м² в отсутствие следующих противопоказаний [11, 21]:
- заболевания, сопровождающиеся тканевой гипоксией (сердечная или легочная недостаточность, инфаркт миокарда, анемия и др.);
- почечная недостаточность, или нарушение функции почек (клиренс креатинина <45 мл/мин/1,73 м²);
- печеночная недостаточность, алкоголизм;
- беременность, лактация;
- острые состояния, способные нарушать функцию почек (обезвоживание, острая инфекция, шок);
- диабетический кетоацидоз.
Временная отмена метформина показана за 1–2 дня до ренгеноконтрастных исследований в связи с риском развития острой почечной недостаточности и за 5–7 дней до планируемых операций с общей анестезией (усиление гипоксии).
Метформин следует использовать с осторожностью пожилым пациентам со сниженной, тощей массой тела, у которых концентрация креатинина обманчиво низка и падение уровня которого не отражает истинного снижения скорости клубочковой фильтрации.
Повысить эффективность терапии метформином на практике помогает использование лекарственной формы препарата с пролонгированным высвобождением (Метформин Лонг Канон). Принимая во внимание возможную непереносимость метформина (10–15% пациентов с СД2), эта его форма по сравнению с обычным препаратом имеет важное преимущество в виде уменьшения частоты нежелательных эффектов, что в целом способствует улучшению переносимости и повышению приверженности лечению, положительно отражаясь на результате терапии [28].
Отсутствие достижения целевого уровня НbА1с на фоне монотерапии метформином свидетельствует о значительном нарушении секреторной активности β-клеток и требует интенсификации сахароснижающей терапии. Рациональность комбинации ССП служит важнейшим условием успешного лечения СД2. В этих случаях необходимо применение комбинации метформина с ССП иного механизма действия. Метформин можно успешно комбинировать всеми другими СПП (ПСМ, меглитинидами, тиазолидиндионами, агонистами ГПП1, ингибиторами дипептидилпептидазы-4), что повышает общую терапевтическую эффективность и улучшает гликемический контроль [11, 20].
Со временем происходит постепенное ухудшение секреторной активности β-клеток, что отражает прогрессирующий характер СД2, выявленный со времен исследования UKPDS. Появление новых ССП безусловно существенно увеличило возможности выбора терапии СД2. Однако из-за высокой стоимости широкое применение инновационных лекарственных средств, как правило, ограничено. Несмотря на разнообразные механизмы воздействия на гипергликемию традиционных и инновационных ССП, пока еще не один из них в контролируемых рандомизированных клинических исследованиях не продемонстрировал способности улучшать функцию β-клеток (возможность замедления или обратного развития дисфункции) и замедлять прогрессирование СД2. Вместе с тем определяющую роль в дисфункции β-клеток имеет глюкозотоксичность (повреждающий эффект хронической гипергликемии). В связи с этим важно напомнить, что в ряду неинсулиновых препаратов самым мощным сахароснижающим эффектом обладают метформин и ПСМ [41]. Безусловно применение ПСМ ассоциируется с риском гипогликемии, но, как показывают клинические исследования, тяжелые гипогликемические эпизоды при их использовании отмечаются редко. Гипогликемии служат сдерживающим фактором и в отношении интенсификации терапии инсулином. Постепенное увеличение дозы ПСМ, обучение пациента, регулярный самоконтроль гликемии позволяют снижать риск их возникновения. Кроме того, в настоящее время для снижения риска развития гипогликемий и их тяжелых последствий для пациентов с СД2 установлены индивидуальные целевые значения показателей гликемии.
Прогрессирующее течение СД2, в целом не зависящее от характера терапии, определяет необходимость использования комбинации ССП с различным механизмом действия и в конечном итоге требует перехода на инсулинотерапию на фоне «истощения» β-клеток. Примечательно, что, по данным клинических исследований, снижение эффективности ПСМ развивается обычно через 5–10 лет приема этих препаратов. Наконец, для клинической практики чрезвычайно важны вопросы долгосрочной безопасности сахароснижающей терапии. Новые СПП уникальны по механизму действия и демонстрируют благоприятное влияние на профиль сердечно-сосудистых рисков (исследования ЕМPA-REG, LEADER и др.): снижение риска сердечно-сосудистых событий (общая и сердечно-сосудистая смертность, сердечная недостаточность). Однако их безопасность в долгосрочном плане остается предметом изучения, тем более что за последнее время появился ряд вопросов, связанных с неожиданными побочными эффектами, которые ранее не фиксировались на традиционной терапии [42, 43].
Комбинация метформина и ПСМ – препаратов с глубоко изученными механизмами действия – много десятилетий успешно используется в клинической практике и позволяет добиваться требуемого сахароснижающего эффекта [41]. Вместе с тем для эффективного лечения СД2 необходимо точное и регулярное соблюдение пациентами рекомендаций врача, т.е. высокая приверженность лечению. Современные фиксированные комбинации (ФК) ССП являются неотъемлемой частью фармакотерапии СД2. Зарегистрированная в РФ новая ФК метформина и глибенкламида (Метглиб) упрощает режим терапии, а значит, обеспечивает высокую приверженность больных лечению, что играет ключевую роль в долгосрочном результате сахароснижающей терапии и профилактике осложнений СД2. Для практикующего врача важно наличие нескольких лекарственных форм препарата Метглиб, содержащих в 1 таблетке глибенкламид и метформин в дозах 2,5/400 мг (Метглиб) и 2,5/500 или 5/500 мг (Метглиб Форс), что расширяет возможности терапии с учетом клинического профиля пациента. Следует добавить, что такая ФК позволяет при определенном соотношении доз уменьшать содержание каждого из действующих компонентов, что повышает профиль безопасности данной комбинации и снижает частоту побочных эффектов. В частности, небольшая доза глибенкламида в составе данной ФК означает меньшее воздействие на функцию β-клеткок и как следствие – предотвращает их ускоренное истощение, что важно с позиций патофизиологии СД2 и долгосрочного поддержания гликемического контроля. С позиции же безопасности сахароснижающей терапии низкие дозы глибенкламида обеспечивают меньший риск развития гипогликемии, который сам по себе допустим при сравнении с уровнем снижения гликемии.
Вопросы сердечно-сосудистой безопасности СПП, в т.ч. ПСМ, широко обсуждаются. Существенным является то обстоятельство, что, по данным исследования URPDS, лечение глибенкламидом позволило снизить риск развития микрососудистых осложнений на 30% (р=0,015), включая ретинопатию, требующую фотокоагуляции, – на 33% (р=0,008). Проблема макрососудистых осложнений СД2 представляется еще более серьезной: глибенкламид значительно уменьшал частоту инфаркта миокарда – на 22% (р=0,056) [44]. Недавний крупный мета-анализ 21 рандомизированного клинического исследования, проведенного за 1966–2005 гг., показал, что применение глибенкламида не сопровождается повышением риска развития кардиоваскулярных событий и смерти к концу периода наблюдения, причем сердечно-сосудистый риск и смертность на фоне его приема были сопоставимыми с таковыми при применении других секретогогов и инсулина [45].
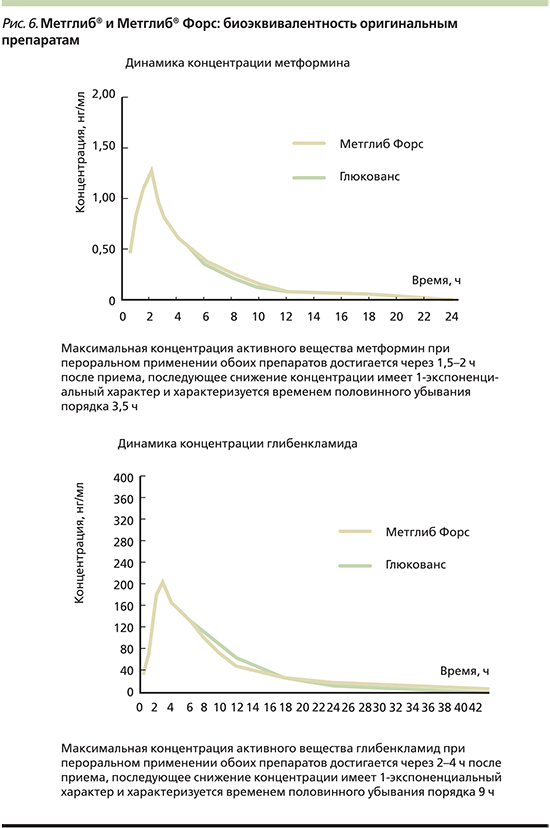
Итак, применение новой ФК метформина и глибенкламида (Метглиб) может повышать терапевтический эффект и снижать до минимума частоту побочных эффектов за счет уменьшения используемых дозировок каждого из препаратов, а ее дополнительными преимуществами являются простота назначения, титрования и невысокая стоимость. Сравнительное исследование биоэквивалентности нового отечественного препарата Метглиб и оригинального комбинированного препарата показало, что их фармакокинетические показатели по активным компонентам существенно не различаются [46] (рис. 6).
Подводя итоги, становится очевидно, что в сахароснижающей терапии важно применение лекарственных средств, воздействующих на ИР. Метформин – один из наиболее изученных препаратов и может применяться в комбинации со всеми основными ССП и инсулином. ФК метформина и глибенкламида обеспечивает более гибкую сахароснижающую терапию, помогает увеличить приверженность пациентов лечению и эффективно контролировать гликемию.


