Введение
Патология билиарного тракта – одна из наиболее актуальных проблем в гастроэнтерологической практике. Так, желчнокаменная болезнь (ЖКБ) является одним из наиболее распространенных заболеваний органов пищеварения. Эпидемиологические данные свидетельствуют о том, что ЖКБ страдают 10–20% взрослого населения, при этом заболеваемость данной патологией характеризуется устойчивым ростом [1, 2]. Вместе с ростом заболеваемости растет и количество выполняемых оперативных вмешательств: так, в России в год выполняется более 500 тыс. холецистэктомий [3]. Вместе с тем, несмотря на усовершенствование хирургических методов лечения ЖКБ, у части пациентов сохраняется или вновь появляется после холецистэктомии клиническая симптоматика, обусловленная органическими либо функциональными причинами. Для обозначения данных состояний в 1950 г. В. Pribram предложил использовать обобщенный термин «постхолецистэктомический синдром» [4]. К органическим причинам постхолецистэктомического синдрома относятся резидуальный и рецидивный холедохолитиаз, рубцовый стеноз большого дуоденального сосочка и дистального отдела общего желчного протока, рубцовая стриктура холедоха и патологически измененная культя пузырного протока, а к функциональным – билиарный и панкреатический типы дисфункции сфинктера Одди. Кроме того, постхолецистэктомический синдром за счет нарушения моторики билиарного тракта, а также в результате нарушения нейрогуморальной регуляции процессов пищеварения, возникающих после холецистэктомии, может приводить к обострению и прогрессированию ранее не диагностированных заболеваний эзофагогастродуоденальной зоны [5]. К одним из таких заболеваний относится гастроэзофагеальная рефлюксная болезнь (ГЭРБ). Согласно определению ВОЗ, ГЭРБ – это хроническое рецидивирующее заболевание, обусловленное нарушением моторно-эвакуаторной функции гастроэзофагеальной зоны и характеризующееся спонтанным и/или регулярно повторяющимся забрасыванием в пищевод желудочного или дуоденального содержимого, что приводит к повреждению дистального отдела пищевода, при этом эпидемиологические исследования показывают, что по своей частоте и распространенности ГЭРБ выходит на лидирующие позиции среди заболеваний желудочно-кишечного тракта [6]. Важную роль в ассоциации между патологией билиарного тракта и ГЭРБ играет заброс содержимого двенадцатиперстной кишки и желудка в пищевод – дуоденогастроэзофагеальный рефлюкс (ДГЭР).
В нормальных условиях между приемами пищи желчный пузырь расслаблен, происходит накопление и концентрация желчи. В ответ на поступление жиров после приема пищи энтероэндокринные клетки двенадцатиперстной кишки секретируют холецистокинин, что приводит к сокращению желчного пузыря и расслаблению сфинктера Одди. Предполагается, что после холецистэктомии за счет непрерывного поступления желчи в двенадцатиперстную кишку и качественных изменений в составе желчи происходит нарушение нейрогуморальной регуляции моторики верхних отделов желудочно-кишечного тракта в виде повышения частоты дуоденогастральных рефлюксов и повышения частоты транзиторных раслаблений нижнего пищеводного сфинктера, что в свою очередь обусловливает высокую вероятность ДГЭР. Так, было доказано, что частота дуоденогастрального рефлюкса значительно повышается у пациентов, перенесших холецистэктомию [7–10].
Взаимосвязь холецистэктомии и ГЭРБ
За последние десятилетия изучению взаимосвязи между холецистэктомией и ГЭРБ был посвящен ряд исследований. H. Hyvärinen выполнил ретроспективное исследование, в которое были включены 918 пациентов с выполненной фиброгастродуоденоскопией. По результатам исследования обнаружено, что у 125 пациентов, перенесших холецистэктомию, чаще встречались эрозивный эзофагит и дуоденогастральный рефлюкс по сравнению с 793 пациентами контрольной группы без холецистэктомии в анамнезе [11].
S. Jazrawi et al. провели неконтролируемое проспективное исследование, в которое были включены 37 пациентов, перенесших холецистэктомию, с использованием опросников симптомов, pH-метрии и манометрии пищевода до и после операции. После холецистэктомии число пациентов с подтвержденным патологическим гастроэзофагеальным рефлюксом увеличилось с 13 до 27, средний балл по DeMeester повысился с 15,2 до 34,2, а число пациентов с эзофагитом увеличилось с 8 до 19 [12].
McNamara D. et al. выполнили ретроспективное исследование, в котором происходило сравнение 212 пациентов с холецистэктомией в анамнезе с 62 – из группы контроля с использованием опросника по симптомам. Было обнаружено, что пациенты с холецистэктомией в анамнезе имели более высокую частоту изжоги, чем контрольная группа (19,3 против 3,2%) [13].
D. Manifold et al. выполнили проспективное контролируемое исследование, в которое были включены 17 пациентов с показаниями к холецистэктомии по поводу ЖКБ и 11 контрольных пациентов. Больным была выполнена суточная pH-метрия и фиброоптическая спектрофотометрия билирубина в желудке до и после операции. В этом исследовании три пациента сообщили о появлении новых симптомов после холецистэктомии, вместе с тем достоверных различий в экспозиции кислоты в пищеводе и концентрации билирубина в желудке до и после холецистэктомии не было [14].
В исследовании S. Kunsch et al. с использованием суточной pH-метрии и фиброоптической спектрофотометрии билирубина была доказана большая частота ДГЭР у пациентов с ГЭРБ и холецистэктомией в анамнезе по сравнению с пациентами с ГЭРБ без холецистэктомии [15].
О Lin et al. в своем проспективном исследовании, в которое были включены 125 пациентов с показаниями к холецистэктомии по поводу ЖКБ и 196 пациентов группы контроля, с использованием опросников до и после оперативного вмешательства не обнаружили значительных различий в симптоматике между двумя группами [16].
Несмотря на противоречивые данные в отношении взаимосвязи клинической симптоматики ГЭРБ и холецистэктомии, в нескольких исследованиях подтверждена связь между холецистэктомией и аденокарциномой пищевода.
J. Lagergren et al. выполнили популяционное когортное исследование, в которое был включен 345 251 пациент, перенесший холецистэктомию. Пациенты наблюдались на протяжении 15 лет, по результатам исследования установлено, что холецистэктомия связана с умеренным повышением риска развития аденокарциномы пищевода, однако абсолютный риск оказался небольшим. Кроме того, у пациентов с ЖКБ без холецистэктомии в анамнезе не было выявлено повышения риска развития аденокарциномы пищевода [17].
В популяционном ретроспективном когортном исследовании, проведенном J. Freedman et al., был выявлен повышенный риск развития аденокарциномы пищевода у пациентов с холецистэктомией в анамнезе по сравнению с пациентами без холецистэктомии [18].
Вопрос о взаимосвязи холецистэктомии и аденокарциномы пищевода вызывает особый интерес в свете эпидемиологических данных – за последние десятилетия произошел значительный рост заболеваемости аденокарциномой пищевода, причем пятилетняя выживаемость пациентов с данным заболеванием не превышает 18% [15]
С учетом вышеприведенных данных важная роль отводится изучению роли ДГЭР в патогенезе аденокарциномы пищевода и ее основных факторов риска – ГЭРБ и пищевода Барретта. Предполагается, что воздействие желчи, соляной кислоты, пепсина и ферментов поджелудочной железы в составе рефлюксата приводит к тому, что недифференцированные мультипотентные стволовые клетки в базальном слое эпителия пищевода либо зрелые клетки путем трансдифференциации, могут дифференцироваться в цилиндрический эпителий [19, 20].
Помимо прямого токсического воздействия желчных кислот (ЖК) в исследованиях на эксплантатах и клеточных линиях плоскоклеточных клеток пищевода показано, что воздействие неконъюгированных ЖК при нейтральном pH увеличивает экспрессию провоспалительных медиаторов (интерлейкин-8, циклооксигеназа-2, простагландин E2), таким образом вызывая цитокин-опосредованное воспаление [21, 22].
ЖК могут ингибировать рост и индуцировать апоптоз культивируемых нормальных эпителиальных клеток слизистой оболочки пищевода человека, кроме того, показано, что ЖК увеличивают экспрессию гомеобоксного транскрипционного фактора CDX2, являющегося важным патогенетическим звеном кишечной метаплазии, как в нормальных плоскоклеточных клетках пищевода, так и в линиях клеток аденокарциномы. Также, воздействие ЖК на клетки пищеводного эпителия приводит к развитию окислительного стресса и повреждению ДНК. Кроме того, показано, что ЖК повышают экспрессию гуанилатциклазы С в клетках пищеводного эпителия [8, 23–26].
Воздействие дуоденального содержимого на эпителий пищевода изучено в экспериментальных моделях: формирование дуоденоэзофагоанастамоза с тотальной гастрэктомией у крыс приводило к развитию кишечной метаплазии, тяжелой дисплазии, плоскоклеточной карциномы и аденокарциномы пищевода, а также было показано, что заброс дуоденального содержимого чаще приводит к развитию эзофагита и кишечной метаплазии по сравнению с кислотным рефлюксом [27, 28].
В исследованиях in vivo с использованием суточной pH-метрии и длительной аспирации содержимого пищевода были выявлены значительно более высокие концентрации первичных и вторичных ЖК у пациентов с рефлюкс-эзофагитом и пищеводом Барретта по сравнению с контрольной группой [29].
В исследовании D. Perng et al., посвященном изучению роли ЖК в патогенезе внепищеводных проявлений ГЭРБ, обнаружено, что их концентрации в образцах мокроты были выше у пациентов с ГЭРБ и у пациентов с рефлюкс-ассоциированной бронхиальной астмой, чем у пациентов с астмой без симптомов ГЭРБ или у здоровых людей контрольной группы [30].
Таким образом, еще более важным становится тщательное предоперационное обследование пациента с целью выявления сочетанного течения ЖКБ и ГЭРБ.
Диагностика и медикаментозная коррекция ДГЭР
На данный момент для диагностики ДГЭР могут использоваться следующие методы: динамическая сцинтиграфия гепатобилиарной системы (холесцинтиграфия), позволяющая визуализировать дренаж желчи через желчевыводящие пути в двенадцатиперстную кишку, а также забросы желчи в желудок и пищевод; фиброоптическая спектрофотометрия билирубина, которая позволяет судить о концентрации и длительности экспозиции билирубина в пищеводе; фиброгастродуоденоскопия с аспирацией гастроэзофагеального содержимого и определением концентрации ЖК и суточная импеданс-pH-метрия (рис. 1). Последняя предоставляет данные о количестве, высоте распространения и о природе эпизодов рефлюкса, а также позволяет соотносить данные показатели с симптоматикой пациента [19, 31].
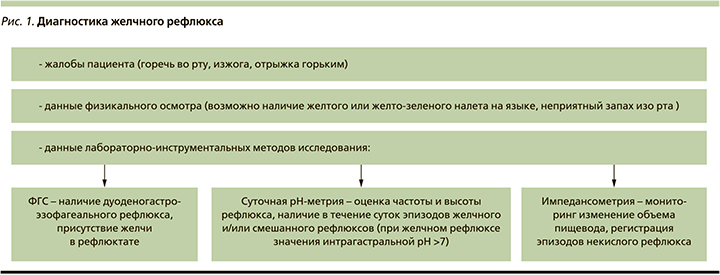
Медикаментозная коррекция ДГЭР при билиарной патологии требует индивидуального подхода и может заключаться в назначении препаратов урсодезоксихолевой кислоты (УДХК), альгинатов и эзофагопротекторов в сочетании со стандартной терапией ГЭРБ (рис. 2).

Применение препаратов УДХК при ДГЭР обусловлено необходимостью замещения пула цитотоксичных гидрофобных ЖК на гидрофильные. Назначение УДХК приводит к уменьшению явлений оксидативного стресса, уменьшению повреждения ДНК и активации NF-κB, а также повышает уровень антиоксидантных ферментов, глутатионпероксидазы 1 и каталазы [32, 33]. В исследовании Y.C. Wu et al. на клеточных линиях MKN-74 рака желудка человека было показано, что хенодезоксихолевая кислота повышает инвазивность опухолевых клеток за счет активации протеинкиназы С и циклооксигеназы 2 (ЦОГ-2) и повышения синтеза простагландина E2, в то время как УДХК подавляет синтез простагландина E2, индуцированный воздействием хенодезоксихолевой кислоты [34]. S.C. Lim и S.I. Han в исследовании на клеточных линиях SNU601 рака желудка человека и на резистентных к цисплатине клеточных линиях SNU601/R продемонстрировали, что УДХК может стимулировать апоптоз и аутофагию клеток рака желудка [35].
Проспективное исследование выполненное В.В. Цукановым и соавт., показало, что комбинация омепразола и УДХК (на примере препарата Урсосан производства компании PRO.MED.CS Praha) более эффективна при лечении пациентов с пищеводом Баррета и эзофагитом по сравнению с монотерапией омепразолом [36]. Препараты УДХК (на примере препарата Урсосан производства компании PRO.MED.CS Praha) назначают в стандартной дозировке 10–15 мг на кг массы тела в 2–3 приема, для повышения комплаенса целесообразно назначение Урсосан Форте в таблетках по 500 мг.
Назначение альгинатов способствует адсорбции ЖК и повышению устойчивости слизистой оболочки пищевода к воздействию агрессивных компонентов рефлюксата за счет формирования невсасывающегося альгинатного гелевого барьера-«плота» на поверхности желудочного содержимого, физически препятствуя возникновению ДГЭР, а также за счет нейтрализации соляной кислоты в зоне «кислотного кармана». Еще одной положительной стороной этой группы препаратов является быстрое достижение положительного клинического эффекта [37–39].
Использование ребамипида в терапии ДГЭР оправдано ввиду наличия у этого препарата уникального механизма действия, направленного на устранение повышенной проницаемости слизистой, мощному цитопротективному эффекту и профилактике канцерогенеза. Ребамипид, оптически активное производное α-аминокислоты 2(1H)-хинолинона, способствует восстановлению барьерной функции слизистой оболочки желудочно-кишечного тракта за счет улучшения кровотока в слизистой оболочке пищевода, регуляции синтеза простагландинов через ЦОГ-2 опосредованные механизмы, снижения концентрации свободных радикалов при оксидативном стрессе, а также повышения экспрессии структурных компонентов плотных контактов эпителиоцитов [40–42].
В комплексной терапии ДГЭР также целесообразно использование прокинетиков (итоприд) с целью восстановления нормальной моторики верхних отделов ЖКТ и быстрого купирования симптомов.
Заключение
Приведенные данные об особенностях ДГЭР при билиарной патологии в первую очередь у пациентов, перенесших холецистэктомию, свидетельствуют о необходимости выявления в процессе предоперационного обследования пациентов с сочетанным течением ЖКБ и ГЭРБ с целью дальнейшего наблюдения и медикаментозной коррекции в случае возникновения ДГЭР. Вместе с тем абсолютный риск развития аденокарциномы пищевода у пациента, перенесшего холецистэктомию, незначителен и не служит противопоказанием к проведению оперативного вмешательства.
Особенности механизмов повреждающего действия рефлюксата, содержащего ЖК, требуют разработки таргетной терапии для подавления цитокин-опосредованного воспаления, что позволит повысить эффективность химиопрофилактики пищевода Бар-ретта и аденокарциномы пищевода.



