Введение
В декабре 2019 г. в городе Ухань, провинция Хубэй (Китай), была зафиксирована серия острых респираторных заболеваний, которые характеризовались быстрым прогрессированием симптомов, развитием пневмонии, острого респираторного дистресс-синдрома (ОРДС) и в ряде случаев заканчивались летальным исходом [1, 2]. Число заболевших быстро увеличивалось, и инфекция распространилась на другие районы Китая. Третьего января 2020 г. из образцов жидкости бронхоальвеолярного лаважа больного был выделен новый коронавирус 2019 г. и идентифицирован как возбудитель инфекции [3]. Новый коронавирус 12.01.2020 получил временное название 2019-nCoV, присвоенное Всемирной организацией здравоохранения, 12.02.2020 переименован в SARS-CoV-2. Респираторная инфекция, вызванная новым коронавирусом, получила название COVID-19.
К концу февраля 2020 г., несмотря на все противоэпидемические мероприятия, в Китае насчитывалось 78 960 подтвержденных случаев новой коронавирусной инфекции COVID-19, 2791 из которых закончился летальным исходом. За пределами Китая к этому времени был зарегистрирован 4691 больной и 67 погибших в 51 стране [4]. К середине марта 2020 г. число случаев заболевания COVID-19 за пределами Китая увеличилось в 13 раз, число затронутых вирусом стран – втрое. Вот почему 11.03.2020 ВОЗ объявляет о начале пандемии. По состоянию на 27.04.2020 во всем мире насчитывалось чуть менее 3 млн случаев подтвержденной инфекции (в т.ч. 80 949 – в России) в 185 странах более 200 тыс. летальных исходов (в т.ч. 747 – в России). Причем абсолютное большинство новых случаев заболевания выявляется за пределами Китая, в то время как в Китае ограничительные меры ослабляются из-за практически полного прекращения распространения инфекции.
Генетический анализ показал, что SARS-CoV-2 относится к роду Betacoronavirus, так же как возбудитель тяжелого острого респираторного синдрома (ТОРС) SARS-CoV и возбудитель ближневосточного респираторного синдрома MERS-CoV [3]. Происхождение SARS-CoV-2 изучается и к настоящему моменту предполагается, что вирус является рекомбинантным между коронавирусом летучих мышей и неизвестным коронавирусом. Источником заражения людей считаются дикие животные, продававшиеся на рынке морепродуктов в Ухани [5].
В настоящем обзоре представлены известные эпидемиологические данные, особенности клинического течения, факторы риска неблагоприятного исхода, возможности лечения и профилактики.
Эпидемиология
 SARS-CoV-2 (рис. 1) высококонтагиозен и может оставаться жизнеспособным в окружающей среде до 2 часов, а на поверхностях – от нескольких часов до 2 суток [6]. Инкубационный период после заражения обычно составляет 4–8 (в среднем 5) дней, но может длиться до 14 дней [7]. Все возрастные группы восприимчивы к вирусу, при этом пожилые пациенты с сопутствующими заболеваниями более подвержены тяжелому течению болезни.
SARS-CoV-2 (рис. 1) высококонтагиозен и может оставаться жизнеспособным в окружающей среде до 2 часов, а на поверхностях – от нескольких часов до 2 суток [6]. Инкубационный период после заражения обычно составляет 4–8 (в среднем 5) дней, но может длиться до 14 дней [7]. Все возрастные группы восприимчивы к вирусу, при этом пожилые пациенты с сопутствующими заболеваниями более подвержены тяжелому течению болезни.
Основным источником инфекции служат больные люди, бессимптомные носители и лица, находящиеся в инкубационном периоде. До сих пор основным путем передачи инфекции считается воздушно-капельный и контактный. Кроме того, возможно, что фекально-оральный путь передачи также существует, поскольку нуклеиновые кислоты SARS-CoV-2 обнаруживаются в образцах кала у больных пневмонией с абдоминальными симптомами [8]. Вертикальный путь передачи между матерью и младенцем был заподозрен после того, как заражение новым коронавирусом было подтверждено у новорожденного спустя 30 часов после появления на свет в детской больнице Ухани. Однако до настоящего времени убедительного подтверждения такой путь передачи не получил. Некоторые исследователи также предполагают, что инфекция может попадать в организм через конъюнктиву глаза, поскольку конъюнктивальный эпителий может быть инфицирован аэрозолем или другими биологическими жидкостями, содержащими вирус [9].
Скорость передачи инфекции определяется базовым репродуктивным числом R0 (ожидаемое число вторичных случаев заражения, вызванное одной инфекцией в полностью восприимчивой популяции). С учетом возможных ошибок, связанных с выбором модели расчета и временнóго интервала оценки, предположительно для SARS-CoV-2 показатель R0 в настоящее время составляет 2,68. По прогнозам специалистов ВОЗ и Китайского Центра по контролю заболеваний, число инфицированных будет увеличиваться [10, 11].
Анализ генома SARS-CoV-2 показал значительное сходство с ранее идентифицированным штаммом коронавируса, вызвавшим вспышку атипичной пневмонии или ТОРС в 2003 г. [12]. Так, белок нуклеокапсида SARS-CoV-2 почти на 90% идентичен ТОРС-ассоциированному коронавирусу (SARS-CoV) по аминокислотной последовательности. SARS-CoV имеет определенную последовательность аминокислот, включающую 14 связывающих остатков, которые непосредственно взаимодействуют с человеческим ангиотензин-превращающим ферментом 2-го типа (АПФ2). Из этих аминокислот 8 представлены в SARS-CoV-2. Таким образом, АПФ2 также является рецептором для SARS-CoV-2 (рис. 2). Некоторые доклинические исследования показали, что ингибиторы ренин-ангиотензин-альдостероновой системы (РААС) могут повышать экспрессию АПФ2. Однако нет убедительных данных, что подобные взаимодействия происходят в организме человека и что это имеет сколько-нибудь важное клиническое значение для пациентов, получающих блокаторы РААС (ингибиторы АПФ и блокаторы рецепторов ангиотензна II) по поводу артериальной гипертензии (АГ) [13, 14]. В настоящее время все эксперты сходятся во мнении, что коррекция АГ у больных COVID-19 должна проводиться исходя из общих клинических рекомендаций, а отмена блокаторов РААС нецелесообразна и может приводить к клинической нестабильности и неблагоприятным последствиям для здоровья пациентов [15–17].
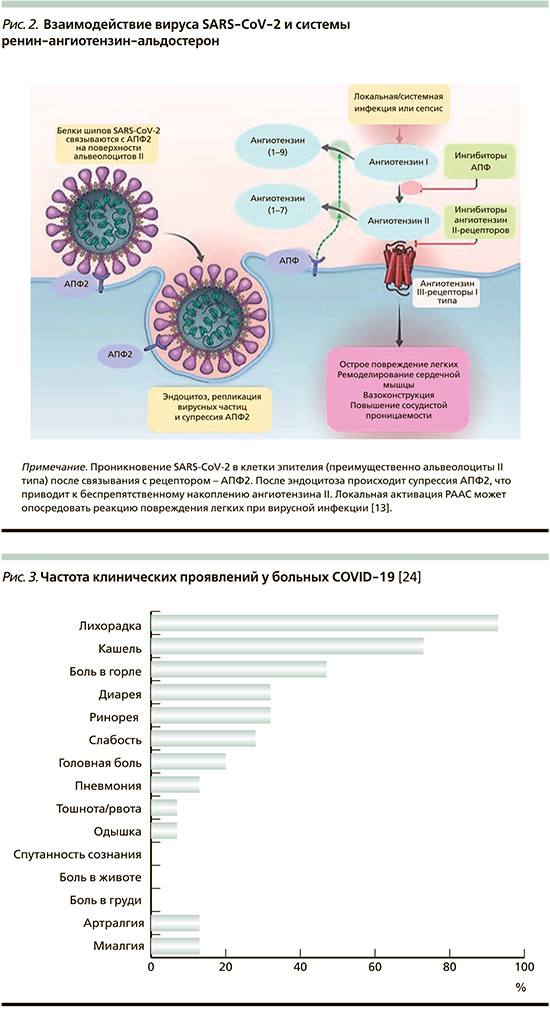
Обычно у людей коронавирусы вызывают нетяжелые респираторные инфекции. Появление новых коронавирусов изменило эти представления. Точные патофизиологические механизмы, лежащие в основе инфекции, вызванной SARS-CoV-2, неизвестны (из-за незавершенных лабораторных исследований), но геномное сходство SARS-CoV-2 и SARS-CoV может помочь объяснить особенности воспалительного ответа, приводящие к тяжелым проявлениям, включая тяжелую пневмонию [18, 19].
Клиническая характеристика
Как и любая респираторная вирусная инфекция, COVID-19 характеризуется разнообразием и малой спе-цифичностью клинических проявлений. В большинстве случаев инфекция COVID-19 протекает в нетяжелой форме с лихорадкой и кашлем как наиболее часто регистрируемыми симптомами. Тяжелое течение или фатальные исходы, как правило, имеют место у пожилых людей или у лиц с сопутствующими заболеваниями [20, 21]. Медиана времени от начала до разрешения симптомов может колебаться от двух недель для пациентов с легкой формой заболевания и до трех–шести недель для тяжелой или критической формы заболевания. Тяжелое состояние развивается в течение недели с момента появления симптомов, в критических случаях время от появления симптомов до смерти составляет от двух до восьми недель.
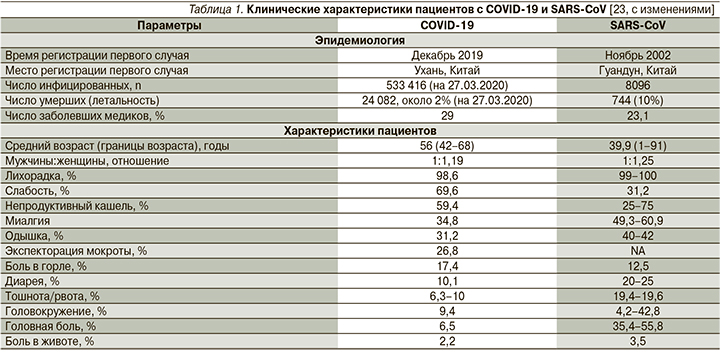
Наиболее частые симптомы – это лихорадка (98,6%), астения (69,6%), сухой кашель (или с экспекторацией мокроты) (59,4%), миалгия (34,8%), одышка (30%), сопровождающиеся заложенностью и выделениями из носа, болью в горле у значительной части пациентов [22] (рис. 3).
Наблюдение за пациентами, инфицированными SARS-CoV-2 в Ухани, показывает значительное клиническое сходство с инфекцией, вызываемой SARS-CoV. Средний возраст больных составляет 55 лет с небольшим преобладанием мужчин (54,3%). Средняя продолжительность инкубационного периода составляет от 4,1 до 7 дней (табл. 1). Лихорадка не обязательно должна быть первым клиническим проявлением. У части пациентов состояние характеризуется одышкой и гипоксемией, которые могут быстро (в течение недели) прогрессировать с развитием ОРДС, септического шока, метаболического ацидоза, нарушения коагуляционной дисфункции и синдрома полиорганной дисфункции [23].
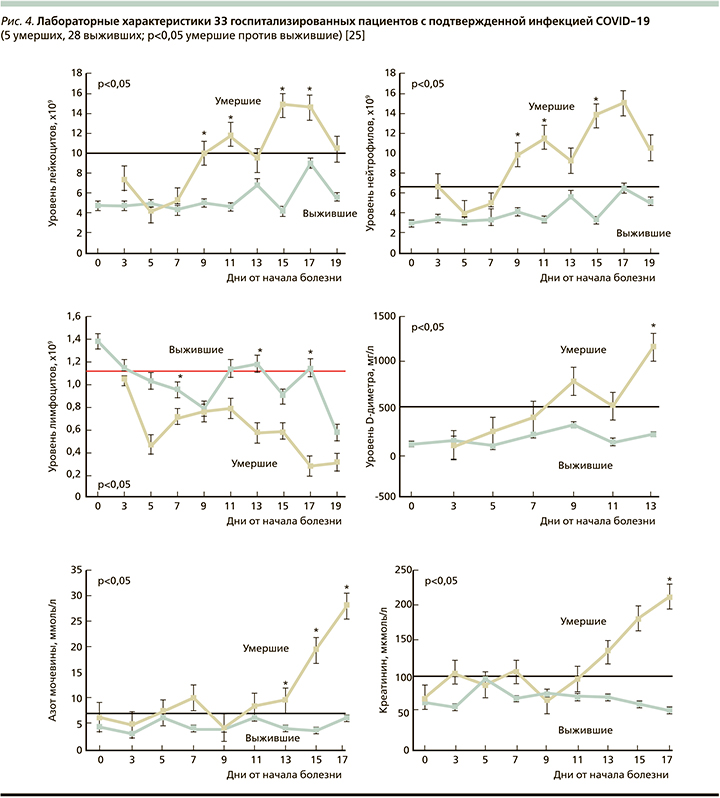
На раннем этапе заболевания могут выявляться снижение уровня лейкоцитов и лимфоцитов в периферической крови, умеренное повышение уровня С-реактивного белка (СРБ). В тяжелых случаях часто отмечается повышение уровня лейкоцитов, гранулоцитов, а также D-димера, ферритина, креатинкиназы и креатина. В университетской клинике Ухани проанализировали особенности течения 138 госпитализированных пациентов с подтвержденной инфекцией COVID-19 [25]. Менее тяжелые пациенты, находившиеся в общем отделении, и тяжелые пациенты, поступившие в отделение интенсивной терапии (ОИТ), демонстрировали значительные различия в лабораторных показателях, таких как уровень лейкоцитов и нейтрофилов в периферической крови, уровни D-димера, креатинкиназы и креатина (рис. 4).
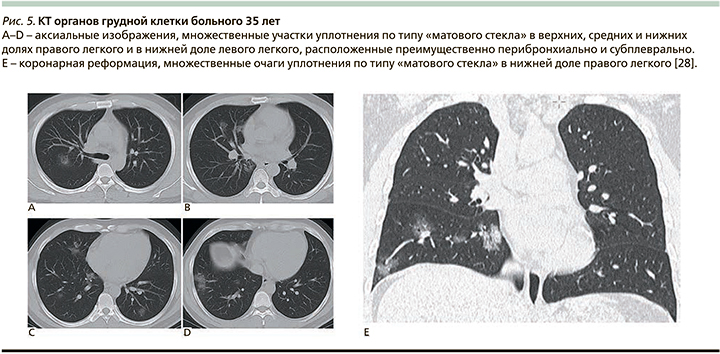
Всем пациентам с предполагаемым или подтвержденным диагнозом рекомендуется выполнять компьютерную томографию (КТ) органов грудной клетки. Рентгенография органов грудной клетки обладает недостаточной информативностью, поскольку разрешающая способность в ряде случаев не позволяет визуализировать поражения с малой степенью уплотнения легочной ткани. Чувствительность КТ при COVID-19 может превышать 90%, специфичность – 70% [26]. У большинства больных выявляются односторонние или (чаще) двусторонние изменения (75–98%), характеризующиеся множественными участками уплотнения легочной ткани по типу «матового стекла» и интерстициальными изменениями. Реже у тяжелых пациентов встречаются субсегментарные участки консолидации легочной ткани [27–29] (рис. 5–7).
В ретроспективном исследовании 121 больного с подтвержденной инфекцией COVID-19 из 4 центров в Китае с 18.01.2020 по 02.02.2020 последовательные изменения при КТ органов грудной клетки анализировались в зависимости от времени появления и прогрессирования клинических симптомов.
В зависимости от сроков выполнения КТ органов грудной клетки обозначались как ранние – 0–2 дня (36 пациентов), промежуточные – 3–5 дней (33 пациента), поздние – 6–12 дней (25 пациентов). Отличительными признаками инфекции COVID-19 были двусторонние периферические участки уплотнения легочной ткани по типу «матового стекла», а также участки консолидации. Важно отметить, что 20 (56%) из 36 ранних КТ не выявляли патологических изменений. Промежуточные и поздние КТ выявляли изменения у большинства пациентов (рис. 8). Эти изменения включали участки консолидации легочной ткани (как правило, двусторонней с периферическим расположением, с преобладанием в нижних долях), больший объем патологического процесса, линейные уплотнения, паттерн «crazy-paving» и признак «обратного ободка». Двустороннее поражение легких наблюдалось при ранней КТ у 10 (28%) из 36 пациентов, при промежуточной КТ – у 25 (76%) из 33 пациентов и при поздней КТ – у 22 (88%) из 25 пациентов [30].
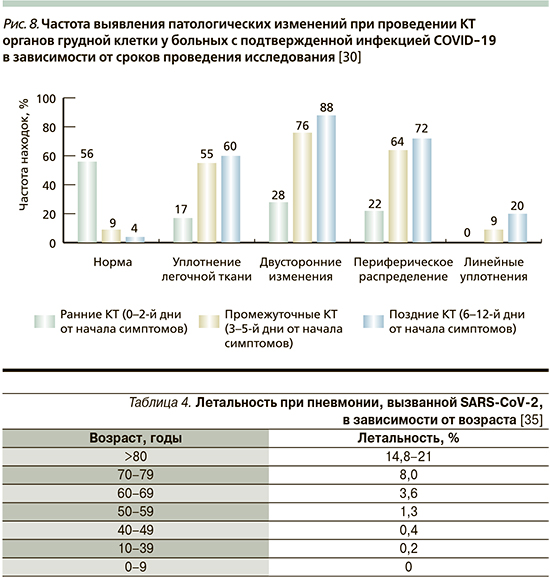
Редкими (нехарактерными) находками при проведении КТ органов грудной клетки можно считать пневмоторакс, полостные образования или лимфоаденопатию. Такие изменения, как плевральный выпот, множественные узелки, симптом «дерево в почках», вероятнее всего, предполагают развитие бактериальной суперинфекции или альтернативный диагноз [31].
Клинический случай 1
Мужчина 35 лет (рис. 5). Поступил в приемное отделение Jiangxi Provincial People’s Hospital (Корея) с лихорадкой (3 дня) и кашлем (2 дня). Семь дней назад приехала из Ухани (Китай). Значимых сопутствующих заболеваний не имеет. При обследовании: температура тела – 38,7°С, в клиническом анализе крови уровни лейкоцитов – 5520/мл, нейтрофилов – 76,2%, лимфоцитов – 16,1%, глюкоза – 7,4 ммоль/л, СРБ – 14,00 мг/л. Обратно транскриптазная полимеразная цепная реакция (ПЦР) в реальном времени выявила РНК SARS-CoV-2 в образце мокроты.
Клинический случай 2
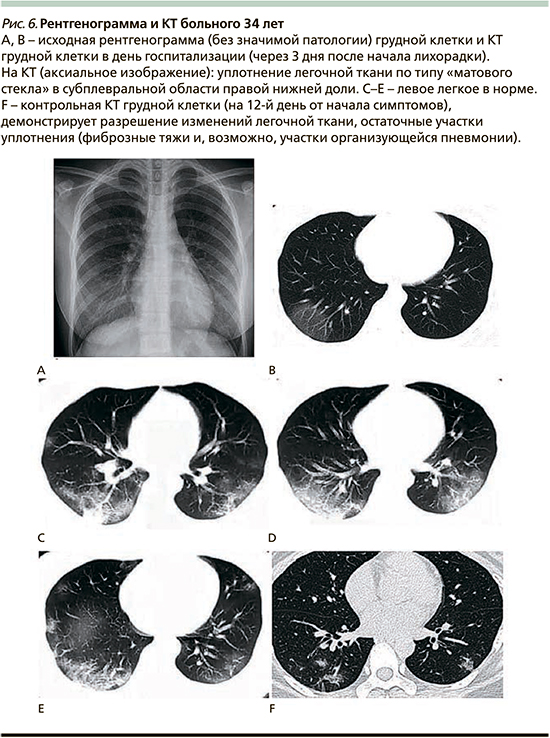
Мужчина 34 лет (рис. 6).
Последующая КТ грудной клетки (через 6 дней после начала лихорадки) демонстрирует распространение фокусов «матового стекла» в правой нижней доле, появление участков консолидации. Мультифокальные периферические (преимущественно субплевральные) участки «матового стекла» и нодулярные участки консолидации в левой нижней доле. Повторная обратно транскриптазная ПЦР в реальном времени была отрицательной, и пациент был выписан [29].
Клинический случай 3
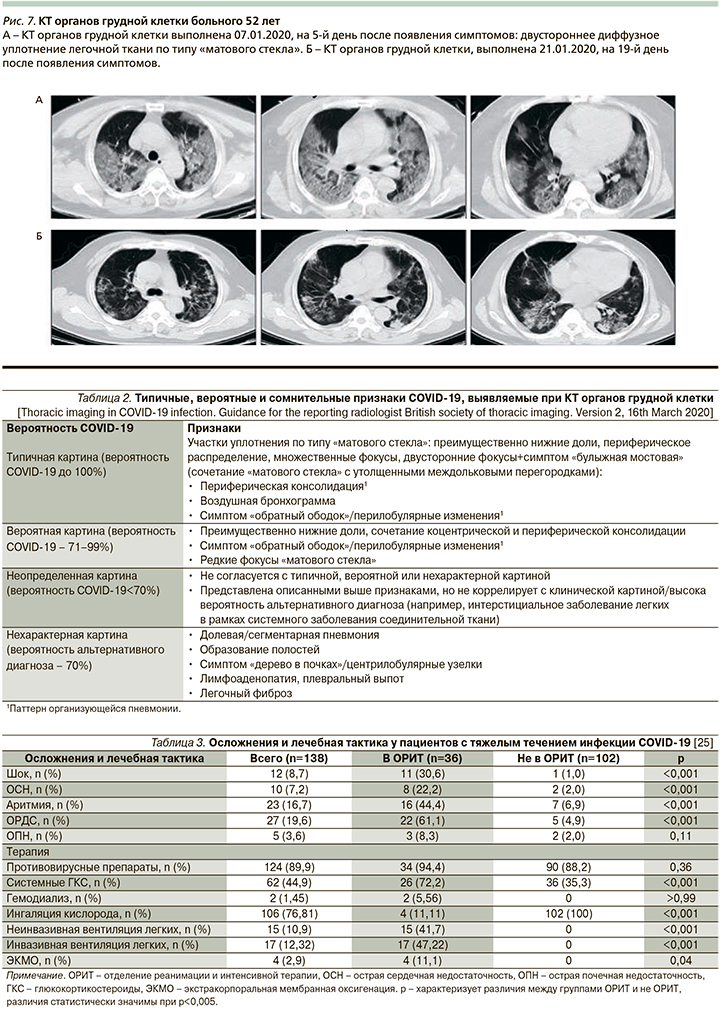
Мужчина 52 лет (рис. 7). Пациент находился в ОРИТ с 07.01.2020 по 12.01.2020, где ему проводилась экстракорпоральная мембранная оксигенация: положительная динамика в виде уменьшения участков уплотнения легочной ткани [25].
В целом КТ органов грудной клетки занимает очень важное место в диагностике и последующей оценке течения COVID-19 (рис. 8). Экспертами Британского общества торакальной радиологии были разработаны КТ-критерии, позволяющие у пациента с соответствующими клинико-эпидемиологическими данными с максимальной точностью установить диагноз COVID-19 (табл. 2) [32].
В большинстве (81%) случаев заболевание протекает в нетяжелой форме. Тяжелое и крайне тяжелое течения COVID-19 развиваются у 14 и 5% больных соответственно. Летальность у больных COVID-19 колеблется от 1 до 5% (уровень существенно различается в зависимости от страны, возраста, сопутствующих состояний, доступности медицинских ресурсов, уровня охвата населения диагностикой и готовности системы к оказанию помощи большому числу пациентов с тяжелым течением). Причиной смерти в большинстве случаев являются дыхательная недостаточность (53%), сочетание дыхательной и сердечной недостаточности (33%), сердечная недостаточность (7%) [33].
Основные осложнения во время госпитализации включают ОРДС, нарушения ритма сердца и инфекционно-токсический шок (табл. 3). Большинство больных в критическом состоянии относились к старшей возрастной группе и имели больше сопутствовавих заболеваний, чем пациенты, не поступившие в ОИТ.
Согласно данным исследований, опубликованных к настоящему времени, наиболее значимыми факторами риска тяжелого, прогрессирующего течения являются возраст заболевшего: ≥60 лет против <60 лет (отношение шансов [ОШ]=8,546; 95% доверительный интервал [ДИ] – 1,628–44,864; р=0,011), история курения: «да» против «нет» (ОШ=14,285; 95% ДИ – 1,577–25,000; р=0,018), температура тела на момент госпитализации: ≥37,3 против <37,3°C (ОШ=8,999; 95% ДИ – 1,036–78,147; р=0,046), наличие дыхательной недостаточности: «да» против «нет» (ОШ=8,772; 95% ДИ – 1,942–40,000; р=0,016), уровень альбумина в крови: <40 против ≥40 г/л (ОШ=7,353; 95% ДИ – 1,098–50,000; р=0,003), уровень СРБ в крови: >8,2 против 8,2 мг/л (ОШ=10,530; 95% ДИ – 1,224–34,701; р=0,028) [34].
При оценке клинического течения заболевания у 191 госпитализированного пациента с пневмонией, вызванной SARS-CoV-2 (137 – впоследствии выписаны с улучшением, 54 – умерли в госпитале; 91/48% пациент имел сопутствующие заболевания (в т.ч. артериальную гипертензию, сахарный диабет, ишемическую болезнь сердца), основными предикторами неблагоприятного прогноза стали возраст >60 лет (p=0,0043) (табл. 4), большее число баллов по шкале SOFA (Sequential Organ Failure Assessment – шкала для оценки органной недостаточности, риска смертности и сепсиса у пациентов в отделении реанимации и интенсивной терапии) (p<0,0001), уровень Д-димера более 1 мкг/мл (p=0,0033). Лабораторными предикторами тяжелого течения также могут быть выраженная лимфопения, повышение уровня тропонина, креатинина, лактатдегидрогеназы, значительное повышение уровня СРБ. Частота неблагоприятных исходов может зависеть от распространенности у заболевших таких сопутствующих заболеваний, как сахарный диабет, артериальная гипертензия, сердечно-сосудистые заболевания, хронические легочные заболевания.
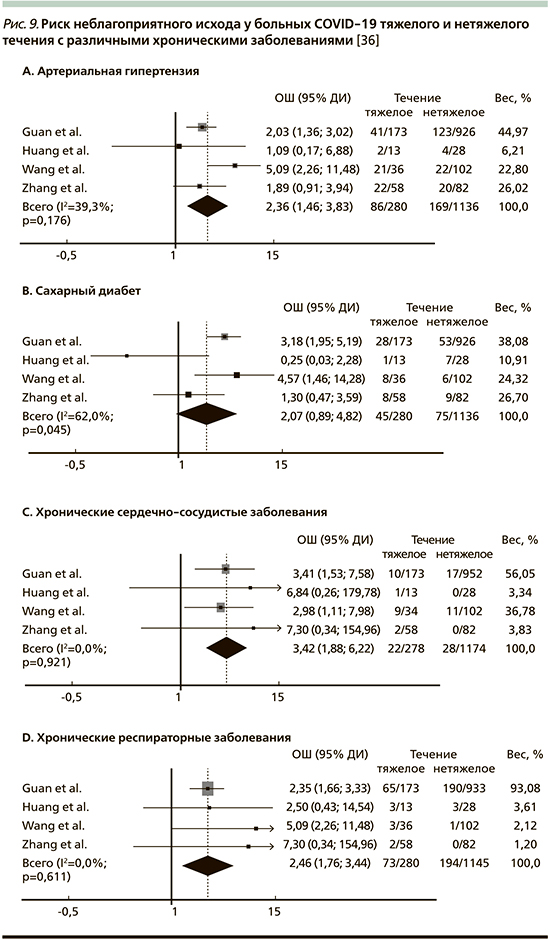
Согласно недавно проведенному мета-анализу, включившему 8 исследований с участием 46 248 больных COVID-19 (23 871 [51%] мужчина), частота хронических респираторных заболеваний в этой группе составила 2%, артериальной гипертензии – 17%, хронических сердечно-сосудистых заболеваний – 5%, сахарного диабета – 8%. Наличие любого из названных заболеваний ассоциировалось с более высоким риском неблагоприятного исхода у больных COVID-19 с тяжелым течением по сравнению с нетяжелым (рис. 9).
Диагностика
Согласно существующим на сегодняшний день рекомендациям, включая таковые Министерства здравоохранения Российской Федерации, выделяют эпидемиологические, клинические и лабораторные критерии диагностики инфекции COVID-19 [33, 37]. Диагноз устанавливается на основании клинического обследования, данных эпидемиологического анамнеза, результатов лабораторных и инструментальных исследований.
К клиническим критериям относятся острое начало симптомов, лихорадка выше 38°С, наличие клинических проявлений острого респираторного заболевания (включая кашель, бронхит и пневмонию), необходимость госпитализации. К обязательным составляющим физического обследования относятся оценка видимых слизистых оболочек верхних дыхательных путей, аускультация и перкуссия легких, пальпация периферических лимфатических узлов, исследование органов брюшной полости с определением размеров печени и селезенки, термометрия, оценка уровня сознания, измерение частоты сердечных сокращений, артериального давления, частоты дыхательных движений. Лабораторные и инструментальные методы диагностики включают клинический анализ крови, биохимический анализ крови, определение уровня СРБ, пульсоксиметрию (пациентам с признаками острой дыхательной недостаточности [SрO2 менее 90%, по данным пульсоксиметрии] рекомендуется выполнение коагулограммы и исследование газов артериальной крови с определением PaO2, PaCO2, pH, бикарбонатов, лактата), КТ органов грудной полости, электрокардиографию. К эпидемиологическим критериям диагностики относятся посещение за последние 14 дней до появления симптомов эпидемиологически неблагополучных по COVID-19 стран и регионов; наличие тесных контактов за последние 14 дней с лицами, находящимися под наблюдением в связи с подозрением на COVID-19, которые в последующем заболели; наличие тесных контактов за последние 14 дней с лицами, у которых лабораторно подтвержден диагноз инфекции COVID-19. В особую группу риска инфицирования попадают медицинские работники.
Подтвержденным считается случай инфекции, когда выявляется положительный результат лабораторного исследования на наличие РНК вируса SARS-CoV-2 вне зависимости от клинических проявлений. Основным биологическим материалом для исследования может быть мазок из носоглотки и/или ротоглотки; дополнительным – промывные воды бронхов (бронхоальвеолярный лаваж), (эндо)трахеальный, назофарингеальный аспират, мокрота, биопсийный или аутопсийный материал легких, цельная кровь или сыворотка, моча. Выделяют также подозрительный и вероятный случаи инфекции COVID-19. Подозрительным считается случай, удовлетворяющий следующим критериям: клинические проявления острой респираторной инфекции (температура тела выше 37,5°C и один или более из следующих признаков: кашель – сухой или со скудной мокротой, одышка, ощущение заложенности в грудной клетке, насыщение крови кислородом по данным пульсоксиметрии [SpO2] ≤95%, боль в горле, насморк и другие катаральные симптомы, слабость, головная боль, аносмия, диарея) в отсутствие других известных причин, которые объясняют клиническую картину вне зависимости от эпидемиологического анамнеза. К вероятным случаям относят несколько клинических сценариев: 1. Клинические проявления острой респираторной инфекции (температура тела выше 37,5°C и один или более признаков: кашель, сухой или со скудной мокротой, одышка, ощущение заложенности в грудной клетке, насыщение крови кислородом по данным пульсоксиметрии [SpO2] ≤95%, боль в горле, насморк и другие катаральные симптомы, слабость, головная боль, аносмия, диарея) при наличии хотя бы одного из эпидемиологических признаков; 2. Наличие клинических проявлений тяжелой пневмонии с характерными изменениями в легких по данным КТ или обзорной рентгенографии органов грудной клетки вне зависимости от результатов однократного лабораторного исследования на наличие РНК SARS-CoV-2 и эпидемиологического анамнеза. 3. Подозрительный на COVID-19 случай при невозможности проведения лабораторного исследования на наличие РНК SARS-CoV-2.
Лечение
Большинство пациентов с нетяжелым течением инфекции могут лечиться дома. Показания к госпитализации: частота дыхательных движений 22 и более в минуту, SpO2 менее 93%; легкое течение заболевания, при возрасте более 65 лет и/или наличии факторов риска; совместное проживающие с лицами, относящимися к группам риска и невозможности их отселения; возраст до 3 или до 18 лет при наличии факторов риска; беременность.
Пациенту рекомендованы постельный режим, мониторирование жизненно важных показателей (частота сердечных сокращений, насыщение кислородом гемоглобина – SaO2, частота дыхания, артериальное давление). Симптоматическая и патогенетическая терапия включает назначение жаропонижающих средств, таких как парацетамол, бронхолитических и мукоактивных средств, таких как гвайфенезин, для ведения продуктивного и непродуктивного кашля [25]. Необходима также инфузионная терапия для поддержания водного, электролитного и кислотно-щелочного баланса. Пациенты с тяжелой респираторной инфекцией, ОРДС, гипоксемией инфекционно-токсическим шоком требуют неотложной кислородотерапии и вентиляционной поддержки для достижения целевых показателей SpO2≥90% у взрослых и детей и ≥92–95% у беременных женщин [38, 39]. Для своевременного выявления признаков тяжелого течения и осложнений (в т.ч. органной дисфункции) необходим постоянный мониторинг показателей клинического анализа крови, уровней СРБ, прокальцитонина, печеночных ферментов, билирубина, миокардиальных ферментов, креатинина, азота мочевины, объема мочи, факторов свертывания крови, газов артериальной крови [40]. При развитии острой почечной недостаточности требуется заместительная терапия.
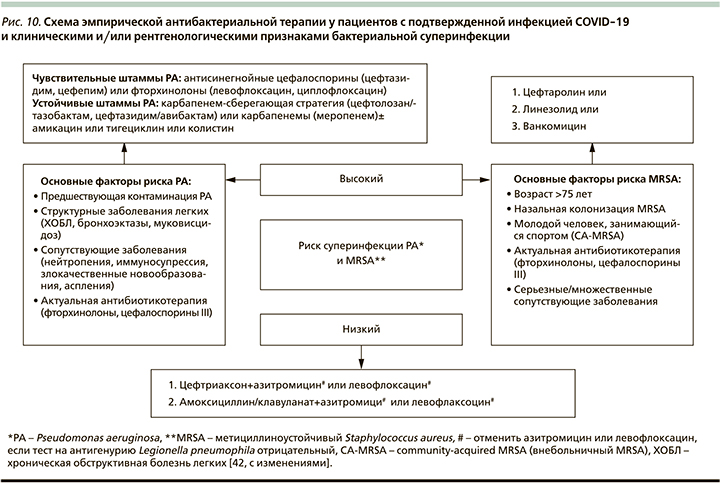
Большинству пациентов, госпитализируемых с диагнозом «внебольничная пневмония», назначается антибиотикотерапия с применением препаратов широкого спектра действий. Однако такая терапия может быть эффективной только при наличии признаков бактериальной суперинфекции и сепсиса [41]. В настоящее время отсутствуют согласованные представления о частоте, видах возбудителей и исходах бактериальной суперинфекции у пациентов, переносящих вирусную пневмонию, вызванную COVID-19. В связи с этим целесообразно проводить аналогию с соответствующими данными, полученными при анализе антибактериальной терапии, применявшейся при лечении ТОРС. Как сообщалось в 2003 г., наблюдалось увеличение частоты метициллинрезистентного золотистого стафилококка (MRSA) с 3,53% (3,53 случая на 100 госпитализаций) в период до эпидемии ТОРС до 25,3% в период эпидемии ТОРС (р<0,001), при этом повышалась частота ИВЛ (искусственная вентиляция легких) – приобретенной пневмонии в ОИТ, в основном (47,1%) вызванной MRSA. Таким образом, решающим фактором в выборе эмпирической антибактериальной терапии больных COVID-19 является оценка риска MRSA и других проблемных бактериальных возбудителей, таких как Pseudomonas aeruginosa и грамотрицательные микроорганизмы с множественной лекарственной устойчивостью, с учетом значимых хронических заболеваний (сердечно-сосудистых, респираторных, системных), тяжести пневмонии и риска побочных эффектов [42] (рис. 10). Последующее принятие решения об изменении или отмене антибактериальной терапии должно быть основано на данных микробиологического исследования и ПЦР.
Применение системных ГКС при тяжелых формах инфекции, включая ОРДС, вызывает споры, поскольку способно пролонгировать репликацию вируса в организме человека [43]. Метилпреднизолон может применяться пациентами с быстрым прогрессированием заболевания, септическим шоком.
У значительной когорты больных с тяжелым течением COVID-19 наблюдаются нарушения свертываемости крови. Гиперкоагуляция и венозные тромбозы могут стать причиной неблагоприятного исхода. Значение D-димера крови, протромбиновое время, тромбоцитопения коррелируют с уровнем 28-дневной смертности [44]. Антикоагулянтная терапия гепарином может улучшать прогноз пациентов с тяжелым течением COVID-19. Профилактические дозы низкомолекулярного гепарина (Надропарин кальция 4000 МЕ в день подкожно [или 100 ЕД на кг веса]) рекомендованы при повышении уровня D-димера, увеличении протромбинового времени, снижении количества тромбоцитов [33].
В настоящее время не существует эффективного противовирусного лечения или вакцины против SARS-CoV-2. Попытки применения противогриппозных препаратов (озельтамивира) не приводили к успеху [25].
Ретроспективные когортные исследования, отчеты об отдельных случаях и сериях случаев атипичных пневмоний, вызванных SARS-CoV и MERS-CoV, свидетельствуют о низкой доказательной базе терапии комбинированным препаратом лопинавир/ритонавир, применяемым в лечении ВИЧ-инфекции и являющимся ингибитором протеазы вируса. Данные включают возможное влияние препарата на смертность, на снижение необходимости в назначении системных ГКС, но только при раннем применении [45–48]. Данные об эффективности комбинации лопинавир/ритонавир у больных COVID-19 к настоящему времени отсутствуют.
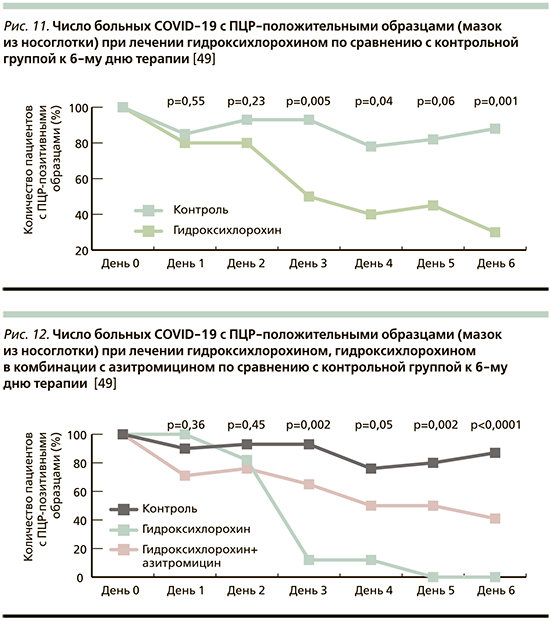
Ранее в исследованиях была показана противовирусная эффективность хлорохина (препарата для лечения малярии) in vitro [49]. Французские исследователи в небольшом исследовании с участием 36 пациентов с COVID-19 показали значимые различия в снижении вирусной нагрузки при применении гидроксихлорохина (600 мг/сут 10 дней) по сравнению с контрольной группой к 6-му дню терапии. Еще более выраженный эффект достигался при применении комбинации гидроксихлорохина и азитромицина. Диагноз COVID-19 и последующая оценка вирусной нагрузки проводились на основании выявления репликации вирусной РНК в мазках из носоглотки методом ПЦР (рис. 11, 12). С учетом малого числа участников исследования преждевременно делать однозначные выводы об эффективности терапии гидроксихлорохином. Кроме того, предстоит изучать механизм противовирусного действия этого препарата. Возможно, хлорохин препятствует гликозилированию рецепторов для SARS-CoV-2 (как это было показано ранее для SARS-CoV), а также обладает иммуномодулирующей активностью, которая может усиливать противовирусную активность in vivo [50].
Значительная часть препаратов, применяемых в настоящее время в лечении COVID-19, обладает рядом нежелательных эффектов. Особого внимания заслуживает кардиотоксичность (способность удлинять интервал QT, что увеличивает риск фатальных нарушений ритма, в т.ч. полиморфной желудочковой тахикардии). Назначение лопиновира, хлорохина, гидроксихлорохина, мефлохина, макролидов, фторхинолонов должно сопровождаться предварительным проведением ЭКГ-исследования для оценки интервала QT и последующим контролем каждые 5 дней. С особой осторожностью необходимо использовать кардиотоксичные препараты при наличии у пациентов факторов риска удлинения интервала QT, таких как нарушение электролитного баланса, сердечно-сосудистые заболевания в анамнезе, острый коронарный синдром, брадиаритмии, сердечная недостаточность, синдром удлиненного интервала QT, гипертрофическая кардиомиопатия, сахарный диабет, гипотиреоз, голодание и др. [51].
Тяжесть течения инфекции COVID-19 может определяться увеличением высвобождения различных провоспалительных факторов [интерлейкинов (IL-6, -1, -2, -7, -10), гранулоцитарно-колониестимулирующего фактора, моноцитарного хемоаттрактантного белка 1, макрофагального воспалительного белка-1 альфа, фактора некроза опухоли-α и других]. Одним из ключевых цитокинов является IL-6. Нарастание или длительное сохранение температуры тела выше 38,5°C, нарастающая лимфопения, значительное повышение уровня Д-Димера и СРБ, повышение IL-6 могут свидетельствовать о наступлении тяжелого жизнеугрожающего синдрома высвобождения цитокинов («цитокинового шторма»). Было выдвинуто предположение, будто препарат тоцилизумаб, являясь антагонистом рецепторов IL-6, оказывает супрессивное действие на избыточное системное воспаление у инфицированных SARS-CoV-2 и может улучшать состояние пациентов [52, 53]. В настоящее время тоцилизумаб включен в рекомендации по лечению тяжелых форм COVID-19 [33]. Вместе с тем продолжаются клинические исследования, призванные оценить его клиническую эффективность.
Российские эксперты обращают внимание на то, что имеющиеся на сегодня сведения о результатах лечения с применением таких препаратов, как лопинавир+ритонавир, хлорохин, гидроксихлорохин, препараты интерферонов, или находящихся в стадии клинических испытаний препаратов умифеновир, ремдесивир и фавипиравир не позволяют сделать однозначный вывод об их эффективности/неэффективности. В связи с этим их применение допустимо по решению врачебной комиссии в установленном порядке в том случае, если потенциальная польза для пациента превысит риск их применения [33].
Профилактика
В настоящее время основной подход к ведению инфекции заключается в контроле источника инфекции, использовании мер индивидуальной защиты для снижения риска передачи инфекции, в ранней диагностике, изоляции и лечении больных.
Все лица без симптомов респираторной инфекции должны подвергаться 14-дневному карантину и медицинскому наблюдению в следующих случаях: возвращения из эпидемиологически неблагоприятных стран и регионов, нахождения в тесном контакте с лицами, больными или подозрительными в отношении COVID-19. При появлении симптомов острой респираторной инфекции, особенно таких, как лихорадка, кашель, затруднение дыхания, диарея, необходимо немедленно обратиться за медицинской помощью [54, 55].
Особому риску инфицирования подвергаются медицинские работники. Медицинский персонал, оказывающий помощь пациентам с доказанной инфекцией или при подозрении на COVID-19, должен быть обеспечен средствами индивидуальной защиты: шапочки, противочумные (хирургические) халаты, респираторы. Нельзя прикасаться к глазам, носу, рту руками, в т.ч. в перчатках. Должна проводиться гигиеническая обработка рук с применением кожных спиртовых антисептиков до контакта с пациентом, перед проведением любой процедуры, после контакта с биоматериалами пациента и предметами в его окружении. При попадании биологического материала, содержащего возбудитель SARS-CoV-2, на слизистые оболочки или кожные покровы руки обрабатывают спиртсодержащим кожным антисептиком или спиртом; если лицо не было защищено, его протирают тампоном, смоченным 70%-ным этиловым спиртом, слизистые оболочки рта и горла прополаскивают 70%-ным этиловым спиртом, в глаза и нос закапывают 2%-ный раствор борной кислоты [56].
Заключение
Спустя несколько месяцев с момента первого сообщения новая коронавирусная инфекция COVID-19 достигла масштабов глобальной чрезвычайной ситуации в области здравоохранения. Во всем мире число лабораторно подтвержденных случаев продолжает расти и в настоящее время достигло 3 млн.
Известно также о более чем 200 тыс. летальных исходов. C помощью только изоляции невозможно предотвратить распространение COVID-19, и глобальное воздействие этой вирусной инфекции вызывает все большую озабоченность медицинского сообщества. Необходимы дальнейшие исследования для изучения механизма передачи вируса от человека человеку и от животного человеку, чтобы облегчить разработку вакцины, специфичной для вируса. Пандемический потенциал COVID-19 требует постоянного мониторинга для своевременного выявления и предсказания возможной адаптации и эволюции вируса, изменения вирулентности и патогенности. Эти факторы в конечном счете будут влиять на показатели смертности и прогноз. Необходимы также исследования для выявления эффективных препаратов для лечения COVID-19.
В отсутствие эффективных противовирусных средств и вакцин для лечения и профилактики COVID-19 были инициированы клинические испытания, направленные на изучение эффективности плазмы крови пациентов, благополучно излечившихся от инфекции. Совсем недавно опубликованные работы указывают на потенциальную эффективность реконвалесцентной плазмы в борьбе с SARS-CoV-2 [57].



