Введение
За последние годы в России, как и во всем мире, фиксируется неуклонный рост числа пациентов с сахарным диабетом 2 типа (СД2). Еще 5 лет назад, по данным Международной федерации диабета (IDF – International Diabetes Federation) [1], в мире число лиц с СД2 составляло более 415 млн. В России, по данным Государственного регистра больных сахарным диабетом, на начало 2019 г. были зарегистрированы около 4,5 млн человек с СД2. Следует отметить, что распространенность данного заболевания в РФ продолжает расти: от 2455 на 100 тыс. в 2013 г. до 2775 на 100 тыс. в 2017 г. [2].
Патогенез СД2 обусловлен многими факторами и включает сложное взаимодействие между нарушением действия инсулина (ИНС), изменением функции β-клеток поджелудочной железы и различными генетическими факторами и факторами окружающей среды, влияющими на метаболизм и пищевое поведение.
Натрий-зависимый котранспортер глюкозы 2-го типа (НГЛТ2) – это транспортер с низкой аффинностью, но высокой способностью транспортировать глюкозу, который экспрессируется в люминальных мембранах проксимальных почечных канальцев и ответствен за 90% реабсорбции глюкозы из сегментов S1 и S2 проксимальных извитых канальцев. Оставшиеся 10% реабсорбции глюкозы происходят с участием НГЛТ1 в сегменте S3 проксимальных извитых канальцев [3].
Преимуществом ингибиторов НГЛТ2 является то, что они способствуют снижению гипергликемии вне зависимости от патогенеза, лежащего в ее основе. Ингибирование НГЛТ2 служит механизмом, который уменьшает гипергликемию независимо от секреции или действия ИНС [4]. Кроме того, данное ингибирующее действие способствует легкому осмотическому диурезу и потере калорий, что сопровождается снижением массы тела [4]. Было показано, что ингибиторы НГЛТ2 улучшают контроль гликемии у пациентов с СД2 при применении в виде монотерапии, в комбинации с метформином (МЕТ), сульфонилмочевиной (СМ), ИНС, тиазолидиндионом, а также в комбинации с агонистами рецептора глюкагоноподобного пептида 1 (арГПП-1).
Интерес и фактическое применение ингибиторов НГЛТ2 в России растут. Тем не менее до сих пор существует настоятельная потребность в лучшем понимании того, как данная инновационная фармакотерапевтическая группа проявляет себя в реальной клинической практике на примере популяции российских пациентов. Дапаглифлозин (ДАПА), конкурентный и высокоселективный ингибитор НГЛТ2, чья клиническая эффективность и безопасность были оценены в масштабной программе клинических исследований фазы 2b/3. В то же время большой интерес представляет оценка практического использования ДАПА с точки зрения эффективности данного препарата в условиях реальной клинической практики, описания популяции, в которой он применяется, а также профиля безопасности, который наблюдается при его использовании вне рамок рандомизированных клинических исследований.
Дапаглифлозин был зарегистрирован МЗ России в ноябре 2014 г. и с декабря 2014 г. назначается пациентам с СД2. К моменту начала сбора данных в рамках данного исследования ДАПА уже применялся в России в течение примерно 2 лет. Таким образом, наряду с оценкой клинической эффективности и безопасности имелась необходимость анализа профиля пациентов, получающих препарат, оценки возможных связей между клиническими характеристиками пациентов и вероятностью достижения целевых значений гликозилированного гемоглобина (HbA1c) при приеме ДАПА в различных терапевтических режимах.
Целью данного исследования являлось описание изменений клинических показателей при приеме ДАПА между двумя временными точками – исходными данными и данными последующего наблюдения. В качестве первичной конечной точки была запланирована оценка динамики уровня HbA1c. В качестве вторичных конечных точек – описание характеристик пациентов, которым назначался дапаглифлозин, и изменений клинических показателй, которые фиксировали во время лечения: доля пациентов со снижением уровня HbA1c на 0,5% и более, доля пациентов, достигших целевого значения HbA1c (<7,0%); динамика показателей глюкозы крови натощак (ГКН), массы тела и артериального давления (АД).
Методы
Исследование имело наблюдательный, ретроспективный, многоцентровый характер. Для проведения анализа данных было проведено ретроспективное включение пациентов с ранее неконтролируемым СД2, начавших лечение дапаглифлозином в виде монотерапии, комбинации с пероральными гипогликемическими препаратами (ПГП) или в дополнение к ИНС, с доступными данными HbA1c, полученными в течение 3 месяцев до приема первой дозы дапаглифлозина.
Проведение исследования осуществлялось на базе 40 амбулаторных клиник на территории РФ врачами-эндокринологами, специализировавшимися на лечении пациентов с СД2.
В ретроспективный анализ были включены данные 922 пациентов с СД2 в возрасте 18–65 лет, которым впервые был назначен ДАПА в период начиная с декабря 2014 г. В исследование не включались пациенты с гестационным диабетом, СД1, а также пациенты с СД2, у которых имелись противопоказания к применению ДАПА или в случае, если пациенты ранее применяли препараты этой группы. В качестве исходных анализировали данные, полученные в течение 3 месяцев до приема первой дозы дапаглифлозина (инициальное событие). В случае наличия нескольких показателей в течение 3 месяцев до приема первой дозы ДАПА выбирали последнее значение, предшествовавшее началу приема препарата.
В качестве финальных данных/показателей использовали любые данные, полученные после исходных, но первичный анализ был сфокусирован на данных, полученных через 6±3 месяца после начала приема ДАПА. В случае отмены ДАПА собирали данные, полученные в течение 3-месячного срока после приема последней дозы.
Данное исследование имело наблюдательный ретроспективный характер, поэтому формальная статистическая гипотеза для тестирования отсутствовала. Тем не менее исследование должно было иметь достаточную мощность для выявления статистически значимого снижения уровней HbA1c. Выбор первичной конечной точки был основан на том факте, что она была основным показателем эффективности в большинстве данных, полученных как в наблюдательных, так и в экспериментальных исследованиях по дапаглифлозину. В рамках вышеупомянутых допущений общее число полных случаев (пациентов, по которым имеются данные о HbA1c как в течение 3 месяцев до приема первой дозы ДАПА, так и через 6±3 месяца после начала лечения данным препаратом) для анализа составило 784. С учетом 5%-ной вероятности утраченных/недостоверных данных общий размер выборки был доведен до 850 пациентов. За уровень статистической значимости было принято значение p<0,05. Значения p были представлены в отчете с точностью до тысячных.
Описание количественных показателей было проведено с использованием числа наблюдений (N), среднего значения (M), стандартного отклонения (SD), 95% доверительного интервала (ДИ) для среднего, медианы (Me), межквартильного размаха в виде двух чисел (IQR), минимального (Min) и максимального значений (Max). Описание качественных признаков было представлено в виде абсолютного числа наблюдений, долей в процентах и 95% ДИ.
Анализ первичной и вторичных переменных был стратифицирован в зависимости от: 1) продолжительности приема дапаглифлозина (менее 24 недель/более 24 недель) и 2) режима терапии (монотерапия, комбинация с ПГП, комбинация с ИНС, комбинация с ИНС и ПГП). Пациенты с указанием на досрочное прекращение приема дапаглифлозина, а также пациенты с появлением после начала приема дапаглифлозина противопоказаний к приему препаратов данного класса были цензурированы при проведении анализа.
Результаты исследования
В ходе проведения анализа данных из общего числа пациентов были исключены 32 участника либо по причине указания на раннюю отмену ДАПА, либо ввиду появляющихся противопоказаний к приему данного препарата. Из 890 индивидуальных регистрационных карт, заполненных по результатам наблюдения, 175 (18,98%) пациентов принимали препарат менее 24 недель, 710 (77,01%) – более 24 недель. В отношении 5 (0,54%) пациентов информация о продолжительности приема дапаглифлозина отсутствовала (табл. 1).
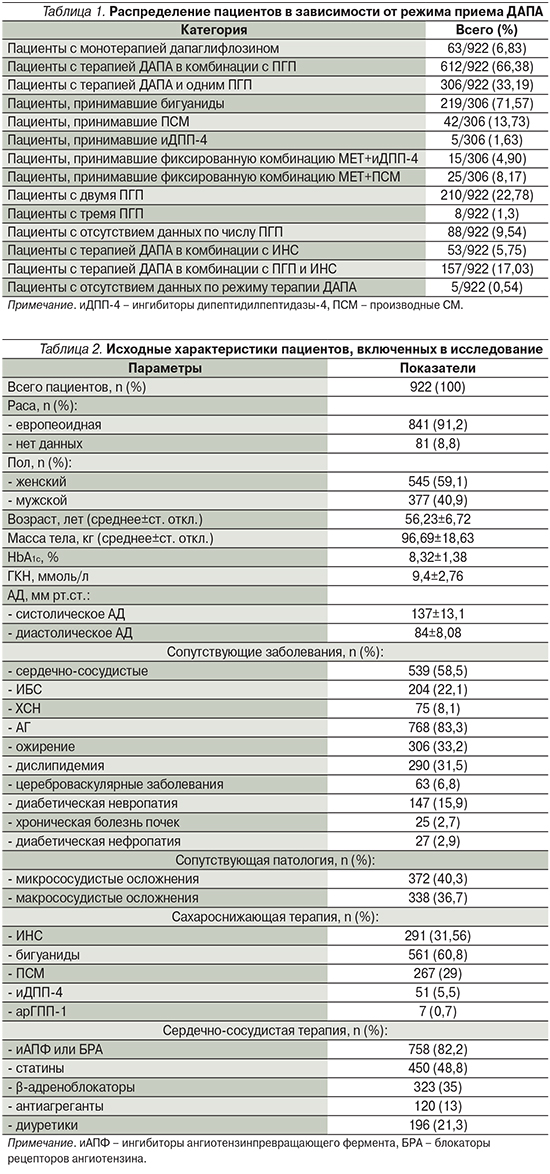
На блок-схеме в приложении представлено графическое распределение пациентов и формирование популяций исследования для анализа.
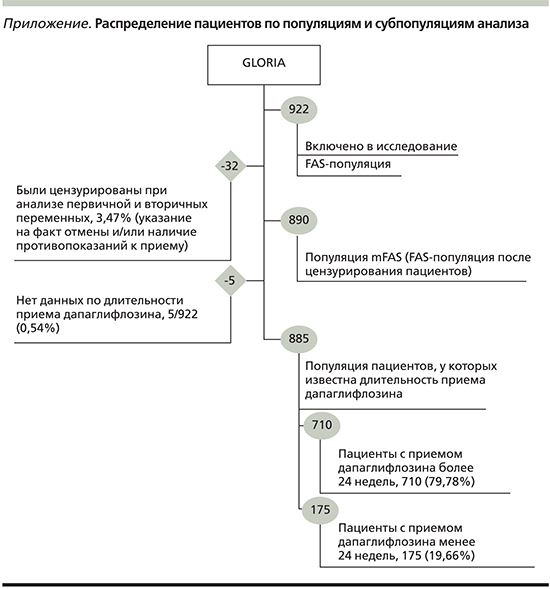
Исходные характеристики пациентов
В исследование были включены 922 (100%) пациента, среди которых к европеоидной расе относился 841 (92,5%) человек, 545 (59,1%) являлись женщинами. Средний возраст участников исследования составлял 56,2±6,72 года, средняя масса тела – 96,7±18,63 кг.
Исходные уровни HbA1c, глюкозы натощак, АД (систолического и диастолического) были равны 9,32±1,38%, 9,4±2,76 ммоль/л, 137±13,1 и 84±8,08 мм рт.ст. соответственно.
В исследовании были учтены сопутствовавшие заболевания. Так, у 372 (40,3%) пациентов наблюдались микрососудистые осложнения, у 338 (36,7%) — макрососудистые.
Пациенты на момент включения в исследование получали сахароснижающую терапию. Кроме того, они могли принимать препараты для лечения сердечно-сосудистых заболеваний. Более подробная информация по исходным характеристикам включенных в исследование пациентов представлена в табл. 2.
Анализ первичной конечной точки.
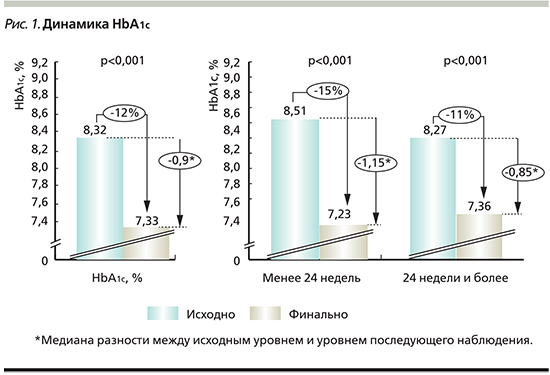
В рамках проведенного анализа первичной конечной точки (сравнение исходных и конечных уровней HbA1c) выявлено статистически значимое снижение данного показателя. Медиана разности между исходным уровнем HbA1c и его уровнем при последующем наблюдении составила 0,9% (95% ДИ – 0,85–0,95%; р <0,001).
Дополнительно проведена оценка данного показателя в зависимости от продолжительности приема ДАПА (менее и более 24 недель). Медиана разности между исходным и конечным уровнями HbA1c в подгруппе пациентов, принимавших препарат менее 24 недель, составляла 1,15% (95% ДИ – 0,95–1,30%; р<0,001). Аналогичный показатель в субпопуляции пациентов, принимавших ДАПА 24 недели и более, составлял 0,85%, (95% ДИ – 0,77–0,90%; р <0,001). Данные представлены на рис. 1.
Значимые различия в динамике величины HbA1c были показаны для ДАПА в режиме как монотерапии, так и двух- и трехкомпонентной терапии (рис. 2 и 3).
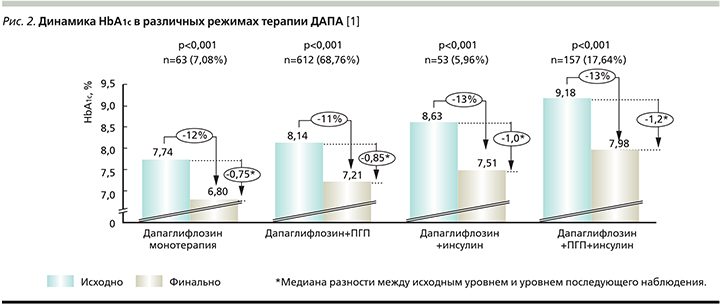
Анализ вторичных конечных точек: снижение уровня HbA1c на 0,5% и более, достижение целевого значения HbA1c≤7. Снижение уровня HbA1c на 0,5% и более наблюдалось у 795 (89,3%) пациентов. Достижение данной вторичной конечной точки наблюдалось у 58 (92,06%) пациентов, принимавших препарат в режиме монотерапии, у 548 (89,54%), принимавших ДАПА с ПГП, у 6 (11,32%) и 137 (87,26%) пациентов, принимавших ДАПА в комбинации с ИНС и ИНС+ПГП (в трехкомпонентной комбинации) соответственно. При стратификации в зависимости от длительности приема 163 (93,1%) и 627 (88,3%) пациентов достигли снижения HbA1c на 0,5% и более при приеме ДАПА менее 24 и более 24 недель соответственно.
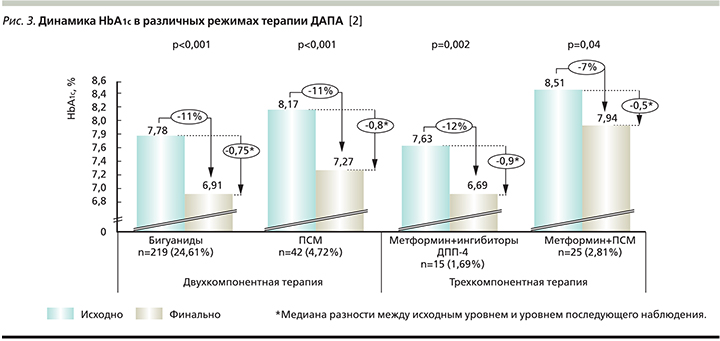
Целевого значения HbA1c≤7,0% достигли 357 (40,1%) пациентов общей популяции. При этом доля пациентов на монотерапии ДАПА, достигших целевого значения HbA1c, составила 66,67% (42 пациента). Из 612 пациентов, которые принимали ДАПА в комбинации с ПГП, 262 (42,81%) достигли целевого показателя HbA1c. Из 53 участников, принимавших ДАПА в комбинации с ИНС, целевого показателя достигли 18 (33,96%) пациентов. Из 157 пациентов, принимавших ДАПА в комбинации с ИНС+ПГП, целевого показателя достигли 30 (19,11%) пациентов. При приеме ДАПА менее 24 или более 24 недель 78 (44,6%) и 277 пациентов (39%) соответственно достигли целевого значения HbA1c≤7,0%. Доля пациентов, достигших целевых значений HbA1c ≤7,0%, составила 56,2% (129 пациентов) при приеме комбинации ДАПА+бигуаниды, 38,1% (16 пациентов) при приеме комбинации ДАПА+ПСМ, 60,0% (9 пациентов) и 24,0% (6 пациентов) при приеме комбинации ДАПА+МЕТ+иДПП4 и ДАПА+МЕТ+ПСМ соответственно.
Влияние на массу тела. Медиана разности между исходным и конечным показателями массы тела в общей популяции пациентов и при стратификации в зависимости от длительности приема дапаглифлозина представлена на рис. 4.
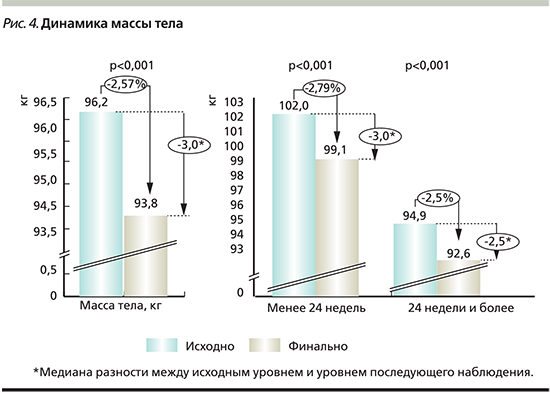
Для пациентов, принимавших ДАПА в комбинации с одним или с двумя ПГП, медиана разности показателей исходной и конечной массы тела составила 3,0 кг.
Среди пациентов, принимавших ДАПА в комбинации с ПГП, медиана разности между исходным уровнем массы тела и уровнем при последующем наблюдении составила для комбинации ДАПА+МЕТ 3,0 кг (95% ДИ – 2,5–3,5: р<0,001); ДАПА+ПСМ 2,5 кг (95% ДИ – 1,5–3,5; р<0,001); ДАПА+МЕТ+иДПП4 2,5 кг (95% ДИ – 0,0–6,0; р=0,046); ДАПА+МЕТ+ПСМ 3,5 кг (95% ДИ – 1,0–5,5; р=0,008).
У 18,4% пациентов из всей популяции масса тела снизилась на 5% и более, что, в частности, было отмечено для 24,3% пациентов, принимавших препарат менее 24 недель и для 17% пациентов, принимавших препарат более 24 недель.
Кроме того, снижение массы тела более чем на 5% было зафиксировано у 23,6% пациентов, которым была назначена монотерапия ДАПА, и у 19,2% пациентов, получавших ДАПА в комбинации с одним или несколькими ПГП. Значимость различий между исходными и комнечными показателями массы тела была достоверной во всех подгруппах (р<0,001).
Влияние на ГКН. Разность между исходным уровнем ГКН и уровнем при последующем наблюдении в общей популяции исследования составила -1,95 ммоль/л (95% ДИ – 1,8–2,05).
При монотерапии ДАПА снижение ГКН составило 1,69 ммоль/л (95% ДИ – 1,3–2,07%), в режиме ДАПА+ПГП – 1,9 ммоль/л (95% ДИ – 1,77–2,05), а также 2,2 ммоль/л (95% ДИ – 1,6–2,90) и 2,03 ммоль/л (95% ДИ – 1,65–2,51) при приеме ДАПА+ИНС и ДАПА+ИНС+ПГП соответственно.
При стратификации по длительности использования препарата снижение уровня ГКН составило 2,34 ммоль/л (95% ДИ – 1,9–2,85) при продолжительности приема менее 24 недель и 1,88 ммоль/л (95% ДИ – 5,0–7,0) при приеме более 24 недель. Значимость различий в указанных стратах сравнения составила р<0,001.
Для комбинации ДАПА с одним или двумя ПГП снижение ГКН составило 1,90 (95% ДИ – 1,7–2,1) и 1,90 ммоль/л (95% ДИ – 1,65–2,19) соответственно. Значимость различий в указанных стратах сравнения составила р<0,001.
При анализе данных в зависимости от применения ДАПА с отдельными классами ПГП медиана разности между исходным уровнем ГКН и уровнем при последующем наблюдении составила:
- в субпопуляции ДАПА+бигуаниды 1,85 ммоль/л (95% ДИ – 1,65–2,05; р<0,001);
- при приеме ДАПА+ПСМ 1,95 ммоль/л (95% ДИ – 1,45–2,45; р<0,001);
- при приеме ДАПА+бигуаниды+иДПП4: 2,65 ммоль/л (95% ДИ – 1,4–4,35; р=0,003);
- при приеме ДАПА+бигуаниды+ПСМ: 2,20 ммоль/л (95% ДИ – 0,9–3,36; р=0,002).
Доля пациентов со снижением HbA1c на 0,5% и более и уменьшением массы тела не менее чем на 5%. Число (доля) пациентов со снижением уровня HbA1c на 0,5% и более и уменьшением массы тела не менее чем на 5% при последующем наблюдении по сравнению с исходными данными составила в общей популяции исследования 17,2% (95% ДИ – 14,7–20,1).
В частности, среди пациентов, принимавших ДАПА в режиме монотерапии, 23,64% достигли снижения обоих показателей (95% ДИ – 13,65–37,33). Среди 612 пациентов, принимавших ДАПА в комбинации с ПГП, доля пациентов, достигших данной комбинированной конечной точки, составила 18,15% (95% ДИ – 15,07–21,68). При анализе данных в зависимости от длительности приема ДАПА 24,3% (95% ДИ – 17,8–32,2) пациентов, находившихся на терапии ДАПА менее 24 недель, и 15,6% (95% ДИ – 12,9–18,7) пациентов, получавших ДАПА более 24 недель, достигли данной комбинированной конечной точки.
Доля пациентов, достигших целевых показателей со снижением HbA1c на 0,5% и более и уменьшением массы тела не менее чем на 5%, составляла 16,67% при приеме ДАПА в комбинации с бигуанидами, 23,08% – в комбинации ДАПА с ПСМ, 20,00 и 20,83% при приеме ДАПА в комбинации с МЕТ и иДПП-4, а также с МЕТ и ПСМ соответственно.
Влияние на АД. Медиана разности между исходным уровнем систолического артериального давления (САД) и уровнем последующего наблюдения составила -6,5 мм рт.ст. (95% ДИ – 5,5–7,5%; р<0,001). Аналогичный показатель в отношении диастолического артериального давления (ДАД) составил -4,5 мм рт.ст. (95% ДИ – 3,5–5,0; р<0,001).
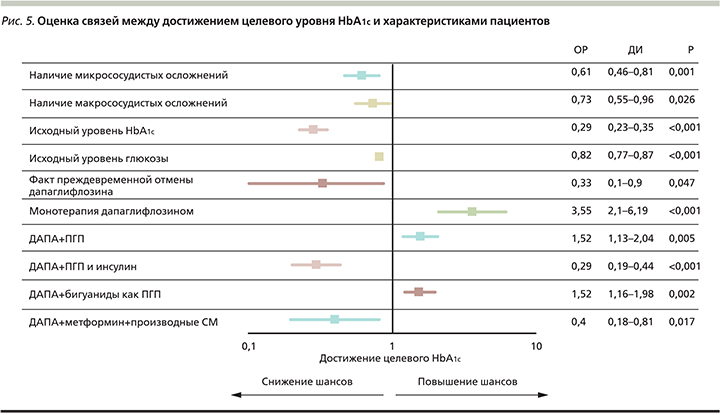
Влияние различных факторов на достижение целевых показателей HbA1c. Для оценки связи между достижением цели по HbA1c и характеристиками пациентов были разработаны логистические регрессионные модели. Модель логистического регресса признавалась статистически значимой при уровне p для модели, равном <0,05.
При оценке связей между характеристиками пациентов и вероятностью достижения целевого уровня HbA1c выявлено, что монотерапия ДАПА, использование ДАПА в комбинации с ПГП или комбинация исследуемого препарата с бигуанидами увеличивают шансы достижения целевого показателя HbA1c, в то в время как накопление рисков (более высокий уровень HbA1c, наличие микро- и макрососудистых осложнений, преждевременная отмена препарата или использование ДАПА в составе комбинированной терапии с ИНС или с МЕТ и ПСМ) снижает шансы достижения целевого показателя HbA1c. Более подробно данные представлены на рис. 5.
Показатели безопасности. Всего в исследовании было зарегистрировано 260 побочных эффектов. При этом только для 12 (4,6%) из них была обнаружена причинно-следственная связь с фактом приема препарата.
Из нежелательных явлений, связанных с приемом ДАПА, наиболее часто встречались дизурия и поллакиурия – 5 (0,5%) и 2 (0,2%) соответственно. Четыре случая дизурии были легкой степени и один – средней степени тяжести. Все два случая поллакиурии были легкой степени тяжести. Остальные нежелательные явления, связанные с применением ДАПА, а именно: боль в животе (средней степени тяжести), инфекция мочевыводящих путей (средней степени тяжести), вульвовагинит (легкой степени тяжести), встречались в единичных случаях 1/922 (0,1%); 95% ДИ – 0,01–0,7%).
В исследовании зафиксирован один случай перелома голени, не связанного с приемом исследуемого препарата.
В целом наиболее часто в исследовании встречались нежелательные явления со стороны нервной системы – 38 (4,1%) событий в основном за счет вновь диагностированной диабетической невропатии – 20 (2,2%) случаев, но ни один из указанных случаев не связывался с приемом ДАПА. Со стороны органов зрения было зарегистрировано 24 (2,6%) нежелательных явления, из которых 19 (2,0%) классифицировались как диабетическая ретинопатия, при этом ни в одном из случаев не было установлено причинно-следственной связи с приемом ДАПА. Также было отмечено 24 (2,6%) нежелательных явления со стороны желудочно-кишечного тракта, среди них 7 (0,75%) случаев дискомфорта в области живота, 4 (0,43%) случая ощущения сухости в полости рта.
Важно отметить, что частота возникновения гипогликемии у пациентов, принимающих ДАПА в том или ином режиме терапии, в данном исследовании была крайне низкой и составила 2 (0,2%; 95% ДИ – 0,04%–0,87%) случая.
Обсуждение
Ингибирование НГЛТ2 является инсулин-независимым механизмом снижения гипергликемии [5]. В предыдущих международных исследованиях было показано, что препараты класса иНГЛТ2 позволяют улучшить контроль гликемии у пациентов с СД2 как в монотерапии, так и в комбинации с другими препаратами [6–10]. Кроме того, было показано, что иНГЛТ2 вызывают осмотический диурез и способствуют снижению массы тела [11, 12].
Исследование GLORIA впервые демонстрирует эффективность и безопасность применения дапаглифлозина в когорте российских пациентов в рамках наблюдательного исследования.
В частности, в нем продемонстрировано статистически значимое снижение уровня HbA1c у пациентов с СД2, принимавших ДАПА, вне зависимости от длительности приема и комбинации с другими ПГП. Кроме того, было показано снижение уровня HbA1c более чем на 0,5%, у значительной доли пациентов – 795 (89,3%), а целевого значения HbА1c<7,0% достиг практически каждый второй пациент, включенный в исследование, – 357 (40,1%).
В данном исследовании нашли подтверждение и плейотропные эффекты ДАПА, что, в частности, отражено в наблюдаемом достоверном снижении массы тела: медиана разницы – 3,0 кг (95% ДИ – 2,50–3,00; р<0,001), АД: снижение систолического АД на 6,5 мм рт.ст. (95% ДИ – 5,5–7,5%; р<0,001), диастолического АД на 4,5 мм рт.ст. (95% ДИ – 3,5–5,0; р<0,001). Следует отметить, что у каждого 5-го (18,4%) пациента в исследовании масса тела снизилась не менее чем на 5% от исходного значения.
В данном ретроспективном наблюдательном исследовании было также получено подтверждение хорошо изученного в рандомизированных клинических исследованиях профиля безопасности дапаглифлозина, свидетельствующие о хорошей переносимости препарата и его высоком профиле безопасности. Случаи гипогликемии и инфекций мочеполовой системы встречались крайне редко. Не было зафиксировано ни одного случая диабетического кетоацидоза, перелома костей или ампутаций нижних конечностей, гипотензии, острой почечной недостаточности. В определенной степени это может быть связано с ограничениями, характерными для ретроспективного анализа данных, который не всегда позволяет полноценно собирать информацию о побочных эффектах и оценивать причинно-следственную связь с приемом исследуемого препарата. В целом данные, полученные на российской популяции пациентов, соответствуют результатам эффективности и безопасности, полученным в рамках хорошо организованных клинических исследований препарата дапаглифлозин.
Выводы
Применение ДАПА сопровождается значимым снижением показателей HbA1c, ГКН, снижением массы тела и АД. Данные изменения наблюдаются как в режиме монотерапии, так и в комбинации с различными сахароснижающими препаратами вне зависимости от длительности приема дапаглифлозина.
Монотерапия дапаглифлозином, использование дапаглифлозина в комбинации с ПГП, в частности комбинация дапаглифлозина с бигуанидами, ассоциируются с увеличением вероятности достижения целевых значений HbA1c, что, по всей видимости, указывает на целесообразность более ранней инициации терапии с ДАПА у пациентов с СД2.
В то же время продемонстрирована обратная зависимость между вероятностью достижения целевых показателей углеводного обмена при приеме ДАПА и следующими клиническими характеристиками (предикторами): преждевременная отмена препарата, наличие микро- и макрососудистых осложнений в анамнезе, применение ДАПА в составе комбинированной терапии с ИНС или в тройной комбинации вместе с МЕТ и ПСМ.
Следует отметить, что частота применения инновационных классов препаратов с доказанной сердечно-сосудистой безопасностью, таких как иДПП-4 и арГПП-1, среди российской популяции пациентов в рамках данного исследования оставалась субоптимальной (1,36% для иДПП-4 и 0,7% для арГПП-1).
Результаты ретроспективного исследования GLORIA в российской популяции пациентов с СД2 дополняют наше понимание профиля эффективности и безопасности дапаглифлозина в условиях реальной клинической практики. Данные соотносятся с результатами предыдущих масштабных международных рандомизированных исследований.



