Сахарный диабет (СД) является глобальной медико-социальной проблемой современности в силу стремительного роста численности больных во всем мире и тяжелых последствий заболевания для пациента. Более 90% случаев приходится на СД 2 типа (СД2). По данным исследования Nation, общее число больных СД в России составляет 5,4% населения страны [1]. Масштабность проблемы тем более значительна, поскольку более половины людей с СД2 не знают о наличии у них заболевания и почти одна пятая населения России находится в стадии преддиабета. Ввиду этого обследование на СД2 должно предусматриваться для популяций высокого риска. С 2011 г. для диагностики СД2 одобрено использование уровня гликированного гемоглобина (HbA1c) в качестве интегрального показателя, который отражает средний уровень гликемии за предшествовавшие 2–3 мессяца (табл. 1).
Современная стратегия сахароснижающей терапии направлена на предупреждение прогрессирования заболевания и развития хронических осложнений, ведущей причиной чего является глюкозотоксичность [2]. Следует помнить, что при впервые выявленном СД2 осложнения наблюдаются практически у половины больных.
В частности, по данным исследования CODE-2 (Cost of Diabetes in Europe – Type 2), изучавшего распространенность различных хронических осложнений у больных СД2, осложнения имели 59% обследованных, причем у 23% было два, а у 3% – три осложнения и более [3].
Основными причинами ранней инвалидизации и высокой смертности больных СД2 являются сосудистые осложнения, а главной причиной смерти – макрососудистые осложнения, такие как инфаркт миокарда, хроническая сердечная недостаточность, мозговой инсульт и др. О связи между гипергликемией и сердечно-сосудистой патологией хорошо известно [4, 5]. Пациенты с СД2 подвержены высокому риску возникновения серьезных неблагоприятных сердечно-сосудистых событий, этот риск примерно вдвое выше, чем у пациентов без диабета [6]. Высокий риск развития сердечно-сосудистых катастроф уже имеют пациенты с преддиабетом [7].
Хроническая гипергликемия как ведущий фактор развития диабетических осложнений требует оптимального лечения с достижением целевых метаболических показателей с момента диагностики заболевания [2, 7]. Успехи в области диабетологии, достигнутые в последние годы, в значительной мере обусловлены внедрением в клиническую практику современных алгоритмов ведения пациентов с СД, в которых приоритетом в выборе терапевтических средств является эффективность сахароснижающего действия препаратов при их безопасности для пациентов [8]. Согласно Российскому Алгоритму специализированной медицинской помощи больным СД, предлагается старт интенсификации сахароснижающей терапии в зависимости от исходного уровня HbA1c с поэтапным включением сахароснижающих средств. В Российских алгоритмах четко определен индивидуальный целевой показатель важнейшего параметра метаболического контроля – HbA1c (табл. 2): рекомендуется поддерживать уровень этого показателя на индивидуально выбранном уровне, ориентируясь на возраст, ожидаемую продолжительность жизни, наличие тяжелых осложнений и риска развития тяжелых гипогликемических состояний. Изменение терапии при недостаточной ее эффективности на каждом этапе рекомендуется осуществлять не позже, чем через 6 месяцев от начала лечения, а в случае ухудшения самочувствия пациента – раньше. В современных алгоритмах ведения пациента с СД2 освещается необходимость коррекции модифицируемых факторов риска с помощью антигипертензивной, гиполипидемической и антикоагулятной терапии, отказа от курения.
Прежде чем переходить к вопросам фармакотерапии СД2, следует подчеркнуть важность немедикаментозных подходов к лечению и проведения регулярного самоконтроля гликемии (СКГ), без которых любая фармакотерапия будет неэффективной. Рекомендации по диетотерапии СД2 включают следующие принципы: энергетическая ценность пищи, поддерживающая массу тела близкой к идеальной, а в случае избыточного веса ограничение калорийности рациона с целью умеренного снижения массы тела. При этом клинически значимое снижение массы тела составляет 5% от величины исходной. Процесс снижения массы тела должен контролироваться врачом, что особенно актуально для пожилых пациентов. Предусматривается максимальное ограничение жиров (животного происхождения), легкоусвояемых углеводов и умеренное потребление сложных углеводов. Полезным является включение в рацион полиненасыщенных жиров в качестве антиатерогенного средства, также необходимо снижение потребления холестерина (менее 300 мг в день) и повышение употребления продуктов с высоким содержанием пищевых волокон, сокращение приема алкоголя (менее 30 г в день).
Одновременно с изменением питания должны проводиться мероприятия, направленные на повышение двигательной активности. Физические нагрузки как уменьшают выраженность инсулинорезистентности, так и стимулируют утилизацию глюкозы инсулиннезависимыми тканями, в которых индуцированное упражнениями увеличение потребления глюкозы не зависит от действия инсулина. Физическая нагрузка подбирается с учетом возраста, осложнений СД2, индивидуальных особенностей каждого пациента, например пешие прогулки, плавание продолжительностью 30–45 минут 3–5 раз в неделю или любой посильный комплекс физических упражнений. Учитывая сложный патогенез СД2 существует несколько групп сахароснижающих препаратов с различным механизмом действия, потенциалом в отношении снижения HbA1c на фоне монотерапии, со своими преимуществами и недостатками [9].
Клинический опыт демонстрирует, что сахаронижающая монотерапия обычно эффективна в первые несколько лет заболевания, в большинстве случаев СД2 для достижения и удержания желаемого уровня глюкозы в крови приходится комбинировать различные сахароснижающие средства. Так, результаты UKPDS показали, что через три года от начала лечения только у половины больных на фоне диеты и монотерапии пероральными сахароснижающими препаратами достигается уровень HbA1c менее 7,0%, а спустя 9 лет только четверть пациентов достигают такой цели [10]. В исследовании J.B. Brown и соавт. показано, что при назначении метформина 42% пациентов теряют контроль в течение 1,5 лет [11]. Кроме того, у пациентов с впервые выявленным СД2 при высоком HbA1c (8,2–8,4%) контроля над гликемией достигают лишь 25% на фоне терапии метформином [12].
Существует два варианта комбинированной терапии: применение нескольких сахароснижающих препаратов в произвольных дозировках и использование лекарственных форм с фиксированной комбинацией (ФК) препаратов. Возможности лечения СД2 значительно расширились с внедрением в клиническую практику ФК, которые все чаще применяют в последние годы. Комбинированная терапия может быть назначена уже на старте лечения пациентам с уровнем HbA1c 7,6–9,0% [8]. Разнонаправленное действие на патогенетические механизмы развития СД2 составляющих ФК, приводит к усилению клинико-фармакологических эффектов и, соответственно, к улучшению клинических исходов [13, 14].
Хорошо известно, что при любых хронических заболеваниях, в т.ч. и СД2, приверженность снижается с течением времени. Существенным аргументом в пользу данного подхода является потенциальное улучшение приверженности пациентов к лечению, которая влияет на результаты лечения [16–17]. В этом плане интересен ретроспективный анализ большой базы данных (n=11,532), показавший, что низкая приверженность больных СД2 к лечению ассоциирована с увеличением частоты неблагоприятных исходов: с повышенным риском всех случаев госпитализации (23,2 против 19,2%; р<0,001), всех случаев смертности (5,9 против 4,0%; р<0,001) и более высоким уровнем HbA1c (8,1 против 7,7%; р<0,001), по сравнению с пациентами с хорошей приверженностью [18].

В целом ФК имеют ряд неоспоримых преимуществ [15–18]. Во-первых, спектр действия комбинированных препаратов охватывает различные патофизиологические механизмы СД2, тем самым происходит взаимное потенцирование разнонаправленных эффектов составляющих. Во-вторых, использование каждого компонента ФК в более низких суточных дозах по сравнению с монотерапией обусловливает уменьшение частоты нежелательных эффектов и закономерное улучшение переносимости лечения пациентом. Стоит добавить, что применение ФК обеспечивает значимое снижение HbA1c не только в меньших дозировках препаратов, но и за более короткие сроки. Еще одно заметное преимущество ФК – это простота назначения и процесса титрования дозы для пациента и врача, что также повышает приверженность пациентов к фармакотерапии, а в долгосрочной перспективе создает условия для повышения эффективности. Одновременный прием нескольких лекарственных препаратов является серьезным препятствием к эффективному лечению; только около трети больных СД2 в достаточной степени соблюдают рекомендованную терапию [14, 15].
Важнейшей составляющей успешного лечения СД2 признана рациональность комбинации препаратов [8, 9, 13]. В клинической практике особый интерес представляет комбинация препарата сульфонилмочевины (ПСМ) и метформина не только как наиболее изученная и обеспечивающая патофизиологический подход к лечению СД 2, но и как наиболее эффективная комбинация сахароснижающих препаратов, поскольку обеспечивает снижение уровня HbA1с на 1,7–2,0% [19, 20]. ФК метформина и глибенкламида – один из первых комбинированных сахароснижающих препаратов, зарегистрированных в РФ [21]. Целесообразность использования ПСМ не подвергается сомнению, поскольку важнейшее патогенетическое звено СД2 – это секреторный дефект β-клетки. С другой стороны, постоянный признак СД2 – это инсулинорезистентность, что обосновывает необходимость назначения метформина. Стоит добавить, что каждый из компонентов в составе этой ФК имеет достаточную доказательную базу [22–24], более подробно остановимся на каждом из ее компонентов.
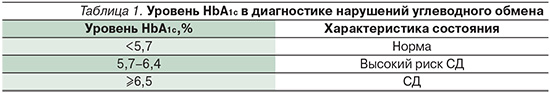
ПСМ относятся к группе секретагогов, их механизм действия основан на способности стимулировать секрецию инсулина β-клетками поджелудочной железы, особенно в присутствии глюкозы. Механизм сахароснижающего эффекта ПСМ детально изучен [25–27]. Среди ПСМ наиболее выраженным сахароснижающим эффектом обладает глибенкламид, поскольку препарат имеет максимальное сродство к АТФ-зависимым K+-каналам β-клеток. Высокая сахароснижающая активность глибенкламида также обусловлена особенностями химической структуры – наличие не только сульфонилмочевинной, но и бензамидной группировки. Итак, взаимодействуя с двумя связывающими местами рецепторов β-клеток поджелудочной железы, глибенкламид наиболее быстро способствует закрытию АТФ-зависимых К+-каналов, стимулирует деполяризацию мембраны, повышение внутриклеточного Са2+ и, следовательно, секрецию эндогенного инсулина, особенно в присутствии глюкозы (рис. 1).
Небольшая доза глибенкламида в составе этой ФК означает меньшее воздействие на β-клетки островков Лангерганса как следствие предотвращает ускоренное истощение, что важно с позиций патофизиологии СД2 и долгосрочного поддержания гликемического контроля [25–27]. С позиции безопасности сахароснижающей терапии низкие дозы глибенкламида обеспечивают меньший риск развития гипогликемии. Существенным является то, что, по данным исследования URPDS, лечение глибенкламидом позволило снизить риск развития микрососудистых осложнений на 30% (р=0,015), включая ретинопатию, требующую фотокоагуляции, – на 33% (р=0,008). Проблема макрососудистых осложнений СД2 представляется еще более серьезной: глибенкламид значительно уменьшал частоту инфаркта – на 22% (р=0,056) [22].
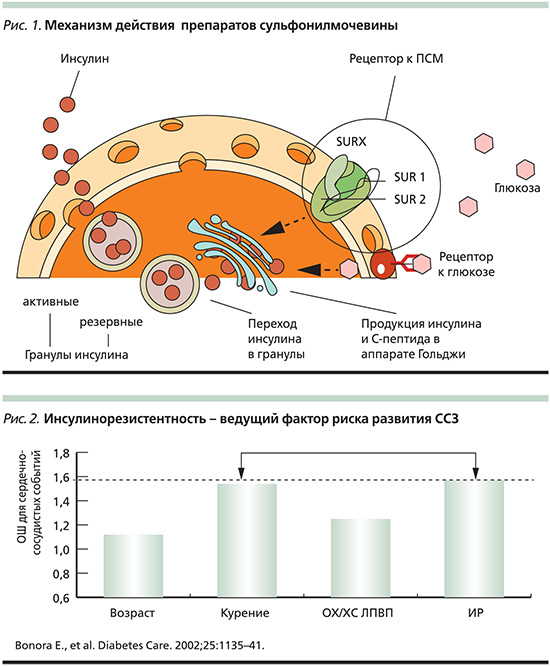
Выбор воздействия на инсулинорезистентность в качестве терапевтической мишени позволяет улучшить чувствительность органов и тканей к инсулину. Резистентность к инсулину играет существенную роль в преждевременном развитии и ускоренном прогрессировании сердечно-сосудистых заболеваний, связанных с атеросклерозом, а также в увеличении риска острых макроваскулярных осложнений (рис. 2) [23, 28, 29]. Со времени UKPDS накапливаются все больше доказательств того, что длительная терапия метформином может снижать риски развития сердечно-сосудистых осложнений. В частности, не только уменьшает показатели общей смертности больных, а также смертности, связанной с СД и инфарктом миокарда, но и на 15% снижает частоту госпитализаций в течение года больных СД2 и сердечной недостаточностью по сравнению с другими сахароснижающими препаратами [30]. Фармакологические эффекты метформина обусловлены несколькими механизмами действия, не связанными со стимуляцией секрецией инсулина β-клетками. Это результат воздействия препарата на чувствительность к инсулину на уровне печени, мышечной и жировой тканей, хотя преобладающим является влияние на гепатическую продукцию глюкозы [27, 31]. Согласно последним данным, метформин снижает продукцию глюкозы печенью, в основном подавляя глюконеогенез, что связывают с уменьшением экспрессии гена, индуцирующего этот процесс за счет фосфорилирования цАМФ – коактиватора CREB-протеина [32]. Помимо этого происходит снижение поступления субстратов глюконеогенеза в гепатоциты и ингибирование ключевых ферментов этого процесса (пируваткарбоксилазы, фруктозо-1,6-бифосфатазы и глюкозо-6-фосфатазы). Снижение уровня глюкозы под воздействием метформина происходит без риска гипогликемических состояний, что является несомненным достоинством препарата.
Важным эффектом метформина является воздействие на липотоксичность: снижение продукции и окисление свободных жирных кислот, уровня триглицеридов и холестерина липопротеидов низкой плотности, положительное влияние на постпрандиальный липидный профиль [33].
Оказывая влияние на всасывание углеводов в желудочно-кишечном тракте, замедляя его скорость, а, также снижая аппетит, метформин способствует уменьшению постпрандиальной гликемии, ассоциированной с риском преждевременной смертности от сердечно-сосудистых заболеваний [31]. Одно из существенных преимуществ метформина – это нейтральное влияние на массу тела (в ряде случаев способствует умеренному снижению) [27, 34, 35]. Недавние исследования продемонстрировали, что применение метформина сопровождается подавлением выработки орексигенного пептида грелина, повышением концентрации глюкагоноподобного пептида-1, обладающего анорексигенным действием, что отчасти объясняет некоторые метаболические эффекты [35]. Кроме того, модулируя экспрессию орексигенного нейропептида Y, метформин также может способствовать снижению массы тела [36].
СД2 представляет собой фактор высокого риска ухудшения сердечно-сосудистого прогноза. Накапливается все больше данных о кардиопротективных эффектах метформина, которые могут быть обусловлены с эффектами препарата в отношении метаболизма липидов, функции эндотелия, кардиомиоцитов и гладкомышечных клеток сосудов, системы гемостаза, реологии крови и сосудистую реактивность [37-40]. Как уже отмечалось для эффективного лечения СД2 с достижением и поддержанием целевого гликемического контроля необходимо точное и регулярное соблюдение пациентами рекомендаций врача, т.е. приверженность к лечению [41]. ФК метформина и глибенкламида в одной таблетке упрощает режим применения препарата, особенно пациентам старшего возраста, а значит, сохраняется высокая приверженность больных к лечению, что играет ключевую роль в отдаленном успехе сахароснижающей терапии, профилактике осложнений СД2. В качестве стартовой терапии целесообразно применять 1–2 таблетки ФК метформина и глибенкламида в день. Дозу препарата при необходимости корригируют каждые 1–2 недели после начала лечения в зависимости от уровня глюкозы. Оптимальным режимом считается прием препарата 2 раза в день (утром и вечером) во время еды. Не рекомендуется принимать более 5 таблеток ФК метформина и глибенкламида в сутки.
Противопоказания к назначению метформина и глибенкламида являются также противопоказаниями для назначения ФК этих сахароснижающих препаратов в одной таблетке: СД типа 1, нарушения функций почек (концентрация креатинина крови более 132 ммоль/л у мужчин, более 123 ммоль/л у женщин), заболевания крови, состояния гипоксии любой природы, а также злоупотребление алкоголем [5, 7, 19]. Следует воздержаться от назначения препарата в период беременности и лактации. Применение препарата следует прекратить до проведения радиоизотопных или рентгенологических исследований с введением йодсодержащего контрастного вещества (не менее чем за 48 часов до и после манипуляции), а также плановых операций под общим наркозом.
В заключение следует отметить, что современные ФК являются неотъемлемой частью фармакотерапии СД2. ФК метформина и глибенкламида обеспечивает более гибкую сахароснижающую терапию, помогает увеличить приверженность пациентов и эффективно контролировать гликемию.



