Гастроэзофагеальная рефлюксная болезнь (ГЭРБ)
За последние десятилетия ГЭРБ вышла на одно из первых мест по распространенности среди хронических заболеваний органов пищеварения [1]. Развитие данного заболевания обусловлено нарушениями моторно-эвакуаторной функции гастроэзофагеальной зоны, что обусловливает регулярные забросы в пищевод желудочного и/или дуоденального содержимого, повреждающего слизистую оболочку дистального отдела пищевода с развитием в нем эрозивно-язвенных, катаральных и/или функциональных нарушений.
ГЭРБ относится к числу наиболее часто встречающихся гастроэнтерологических заболеваний. Согласно систематическому обзору H. El-Serag и соавт., распространенность ГЭРБ в Северной Америке составляет 18,1–27,8%; в Европе – 8,8–25,9%; в Восточной Азии – 2,5–7,8%; на Среднем Востоке – 8,7–33,1%; в Австралии – 11,6%; в Южной Америке – 23,0%. Заболеваемость ГЭРБ в странах Западной Европы и Северной Америки составляет около 5 случаев на 1000 человек в год [1].
Российские исследования, в т.ч. проведенные в рамках программы ВОЗ MONICA, продемонстрировали эпидемиологические показатели, сопоставимые с приведенными выше зарубежными данными. В Москве, по данным эпидемиологического исследования МЭГРЕ, распространенность ГЭРБ составила 23,6%, а в России – 13,3% [2, 3].
В основе патогенетических механизмов развития ГЭРБ лежит несоответствие между силой факторов агрессии желудочного и/или дуоденального рефлюксата и эффективностью факторов защиты пищевода.
Факторы агрессии: в желудочном содержимом – соляная кислота и пепсин; в дуоденальном содержимом (при дуоденогастроэзофагеальных рефлюксах) – желчь, панкреатические ферменты и лизолецитин (лизофосфатидилхолин).
Для предупреждения повреждения слизистой оболочки пищевода имеются следующие защитные механизмы [4, 5]:
- антирефлюксная барьерная функция нижнего пищеводного сфинктера (НПС);
- клиренс пищевода:
- химический – бикарбонаты слюны, секрет слизистых желез пищевода;
- механический (объемный) – тонус гладкой мускулатуры пищевода и его перистальтика;
- своевременная эвакуация желудочного и дуоденального содержимого;
- физиологический контроль над кислотопродуцирующей функцией желудка.
Клиренс пищевода обеспечивается глотанием слюны, приемом пищи и жидкости, выделением секрета железами подслизистой оболочки пищевода, нормальной его перистальтикой и силой тяжести. Нарушение этих механизмов ведет к увеличению продолжительности контакта (экспозиции) факторов агрессии желудочного и/или дуоденального содержимого со слизистой оболочкой пищевода, что способствует развитию ГЭРБ [4–7].
Наиболее часто к снижению функции антирефлюксного барьера приводят следующие причины [4, 6]:
- грыжи пищеводного отверстия диафрагмы (ГПОД);
- снижение давления (тонуса) НПС;
- учащение спонтанных (преходящих) релаксаций НПС (СРНПС).
ГПОД характеризуются смещением в грудную полость (заднее средостение) абдоминального отдела пищевода, кардии или даже дна желудка. При этом происходит смещение НПС в проксимальном направлении, что ведет к снижению его давления и учащению СРНПС, предрасполагая к развитию ГЭРБ. По данным разных авторов, ГПОД выявляется у 54–94% пациентов с ГЭРБ [4, 7].
Именно НПС отводится основная роль в механизме закрытия кардии, препятствующем забросу содержимого желудка в пищевод. Данное анатомическое образование имеет собственную вегетативную иннервацию. Его расслабление опосредуется блуждающим нервом, а повышение тонуса – симпатической импульсацией [4–6]. Состояние покоя пищевода характеризуется тонической констрикцией его мышечных волокон, поэтому у здорового человека большую часть времени пищевод закрыт, при этом в НПС создается давление от 10 до 30 мм рт.ст. (в зависимости от фазы дыхания). Минимальное давление в НПС определяется сразу после приема пищи, максимальное – ночью. Во время глотательных движений тонус мышц НПС снижается, и после прохождения пищи в желудок просвет нижней части пищевода закрывается. При ГЭРБ имеет место гипотония и даже атония НПС, давление в нем редко достигает 10 мм рт.ст. [4–7].
Развитию гипотонии НПС способствуют следующие факторы [6, 7]:
- употребление продуктов и лекарственных препаратов, содержащих кофеин (кофе, чай, кока-кола, цитрамон, кофетамин и др.) либо перечную мяту;
- прием медикаментов, снижающих тонус НПС (седативные, транквилизаторы, трициклические антидепрессанты, средства для лечения паркинсонизма, нитраты, блокаторы кальциевых каналов, антагонисты α-адренорецепторов, агонисты β-адренорецепторов, антихолинергические средства, простагландины, миотропные спазмолитики, теофиллин, прогестерон);
- поражение блуждающего нерва, в т.ч. при автономной нейропатии у больных сахарным диабетом;
- курение табака (за счет воздействия никотина);
- употребление алкоголя (не только снижает тонус НПС, но и повреждает слизистую оболочку пищевода и сам сфинктер);
- беременность.
Однако даже в отсутствие этих факторов причиной 50–80% эпизодов патологических рефлюксов у пациентов с ГЭРБ могут быть СРНПС, причем их длительность и частота пропорциональны тяжести возникающего эзофагита. Во время СРНПС барьер между желудком и пищеводом ослабевает на короткий период, от 3 до 30 секунд (в среднем 10–15 секунд) [4, 6, 7]. Патофизиологические механизмы возникновения СРНПС не до конца расшифрованы, определенную роль в этом процессе отводят постпрандиальному растяжению желудка. СРНПС могут быть ответом на незаконченное глотание, вздутие живота, поэтому рефлюксные эпизоды часто возникают после приема пищи. СРНПС могут быть связаны с глотанием, что опосредуется нарушенной перистальтикой пищевода. К учащению эпизодов СРНПС приводят дискинезия пищевода, торопливая, быстрая и обильная еда с проглатыванием большого количества воздуха, повышающего внутрижелудочное давление до значений, превышающих давление в НПС, что ведет к забросу содержимого желудка в пищевод. К другим факторам риска относятся метеоризм, гастропарез, гастростаз и дуоденостаз любой этиологии. Способствуют СРНПС избыток в рационе жирного мяса, тугоплавких жиров, жареных блюд, мучных изделий и острых приправ, употребление газированных напитков. Эти факторы являются причиной длительной задержки пищевого комка в желудке, повышения внутрибрюшного давления и гастроэзофагеального градиента [4].

Гастроэзофагеальные рефлюксы у здоровых людей могут иметь место после приема пищи (постпрандиально), реже между приемами пищи (интерпрандиально) и совсем редко в ночное время, при горизонтальном положении тела. Причем в этих случаях снижение уровня рН в пищеводе до значений ниже 4,0 длится не более 5% общего времени рН-мониторирования пищевода [4, 6].
Ожирение
Ожирение в настоящее время становится все более значимой медицинской и социальной проблемой в развитых странах, приобретая характер неинфекционной эпидемии. В России около 30% населения имеют избыточную массу тела или ожирение, а в ряде стран данный показатель достигает 50% [8]. Считается, что наличие ожирения сокращает продолжительность жизни в среднем на 5 лет и является доказанным фактором риска таких заболеваний, как ишемическая болезнь сердца, артериальная гипертония, атеросклероз, сахарный диабет 2 типа, онкопатология различной локализации [9]. Заболевания желудочно-кишечного тракта при ожирении часто проявляются патологическими процессами в области пищевода, включая ГЭРБ (до 72% больных), гепато-билиарной системы (64%) и толстой кишки (74%) [10, 11]. В большинстве случаев ожирение имеет экзогенно-конституциональный характер, т.е. развивается в результате несоответствия между поступлением энергии в организм и ее расходом в обменных процессах, и лишь 5% больных страдают вторичным ожирением, возникающим вследствие генетических аномалий, эндокринных заболеваний, нейроинфекций, травм или опухолей мозга [12]. Помимо снижения продолжительности жизни ожирение приводит к значительным экономическим затратам. По данным Всемирной организации здравоохранения, на лечение ожирения и ассоциированных с ним соматических заболеваний приходится 8–10% всех расходов на здравоохранение в развитых странах [13].
В последние годы в патогенезе абдоминального ожирения большое значение придается регуляторным нейрогормональным факторам. Как известно, ключевая роль в регуляции чувства голода и насыщения и как следствие – изменения массы тела принадлежит гипоталамусу [14]. Гормоны (грелин, лептин) оказывают воздействие на гипоталамо-гипофизарную систему. Кроме того, нарушение синтеза этих веществ приводит к сбою регуляции пищевого поведения (ПП) и, следовательно, увеличению веса [15]. Лептин секретируется адипоцитами и клетками желудка, обладает митогенными свойствами и способен индуцировать пролиферацию клеток, в т.ч. и неопластические процессы пищевода [16, 17]. Механизм его действия основан на передаче в гипоталамус информации о состоянии жирового обмена и массе тела. Воздействуя на специфические рецепторы, располагающиеся в гипоталамической области, лептин инициирует нервные импульсы, направленные к участкам головного мозга, отвечающим за регуляцию аппетита. Так, в светлое время суток лептин ограничивает прием пищи путем подавления медиаторов, стимулирующих аппетит (гамма-аминомасляной кислоты, агути-подобного пептида), и повышения синтеза анорексигенных пептидов, (α-меланоцитостимулирующего гормона [α-МСГ], кокаин-амфетамин-регулируемого транскрипта). Лептин также часто называют гормоном насыщения, т.к. считается, что он блокирует синтез и высвобождение нейропептида Y в гипоталамусе, вызывающего чувство голода. Первичная недостаточность лептина у человека приводит к развитию тяжелой формы ожирения [18–20].

Грелин – это пептид, секретирующийся клетками легких, почек, тонкого кишечника, а также некоторых отделов головного мозга, например гипоталамуса. В противоположность лептину грелин называют циркулирующим гормоном голода, т.к. он способствует повышению аппетита, увеличению количества потребляемой пищи и вследствие этого – росту объема жировой ткани. Воздействуя на гипоталамическом уровне, грелин является участником многоступенчатого процесса регуляции энергетического обмена [18, 21]. Помимо прочего он влияет на процессы энергопотребления, непосредственно участвуя в механизмах энергообмена – синтезе АТФ, накоплении жировой массы и гликогена, а также путем коррекции сигналов голода [18, 22, 23]. Уровень грелина в плазме крови у лиц, страдающих ожирением, ниже, чем у людей с нормальным весом [22, 23]. B.O. Yildiz и соавт. в своем исследовании установили, что уровень грелина меняется в течение суток и снижается в дневное время у здоровых людей с нормальным весом. При этом у лиц, страдающих ожирением, подобной закономерности отмечено не было, т.е. уровень грелина практически не изменяется в течение суток. Имеются данные, согласно которым к ожирению может приводить малая продолжительность сна, поскольку это ведет к гормональным изменениям, повышающим аппетит: увеличению выработки грелина и снижению продукции лептина [23, 24].
В процессе изучения характера секреции лептина, грелина и нейропептида-Y было отмечено существование механизмов по типу обратной связи, регулирующих взаимодействие этих пептидов, а также определена последовательность изменений в нейроэндокринной цепи, происходящих на всем протяжении приема пищи [24–26]. Кроме того, лептин сдерживает секрецию грелина в желудке и блокирует его центральные орексигенные эффекты [25, 26].
Важнейшим условием возникновения желания приема пищи в ночные часы является отмена сдерживающего влияния лептина на структуры ЦНС, регулирующие аппетит. В норме секреция лептина адипоцитами повышается с наступлением темноты и снижается в светлое время суток (в среднем с 5 до 19 часов), что ведет к ряду последующих нейроэндокринных преобразований. А именно в ночные часы происходит снижение синтеза нейропептида-Y в дугообразном ядре гипоталамуса и истощение его запасов в паравентрикулярных ядрах, а также увеличение поступления в паравентрикулярные ядра анорексантов (α-МСГ и кокаин-амфетамин-регулируемого транскрипта), обеспечивающих сдерживающее влияние на аппетит; для дневных часов характерны прямо противоположные процессы [27].
Увеличение секреции грелина в желудке в вечерние часы у пациентов, предрасположенных к ожирению, являющееся, по мнению S.P. Каlrа и соавт., также следствием уменьшения сдерживающих влияний лептина, приводит к дополнительному усилению секреции нейропептида-Y в гипоталамусе. Колебания уровня лептина предположительно формируют не только суточную модель поступления энергии, но ициркадные, а возможно, и ультрадианные ритмы секреции грелина и нейропептида-Y [27].
Нарушения пищевого поведения и ожирение
Под ПП подразумевается ценностное отношение к пище, формирующее стереотипы питания и включающее индивидуальные для каждого человека привычки и эмоции, касающиеся еды. ПП бывает как адекватным, так и патологическим в зависимости от качественных и количественных показателей питания, а также от того места, которое занимает процесс приема пищи в иерархии ценностей человека. Адекватным ПП является употребление пищи с целью удовлетворения потребности в питательных веществах для поддержания пластического и энергетического баланса организма [12]. Среди патологических выделяют экстернальную, эмоциогенную и ограничительную формы ПП, а также нервную анорексию (НА) и нервную булимию (НБ), компульсивное обжорство (КО), психогенное переедание (ПСП) и синдром ночной еды (СНЕ). Распространенность наиболее изученных форм расстройств ПП представлена на рис. 1, а их классификация и дифференциальная диагностика – в табл. 1 и 2.
При адекватном ПП мотивацию индивидуума к приему пищи формируют внутренние метаболические и механические стимулы, такие как уровень глюкозы и свободных жирных кислот в крови, наполненность желудка и др. При экстернальном ПП для человека характерна повышенная чувствительность к внешним раздражителям, таким как реклама пищевых продуктов, вид накрытого стола или витрины продуктового магазина. При таком типе ПП пациенты едят вне зависимости от того, когда они последний раз принимали пищу. Определяющим фактором здесь является доступность пищевых продуктов. Они могут есть до тех пор, пока не закончится продуктовый запас, независимо от того, голодны ли они или нет. Именно эта особенность лежит в основе переедания «за компанию», перекусов на улице, приема избыточного количества пищи в гостях, покупки большого объема продуктов в магазинах. Экстернальный тип ПП в той или иной степени встречается практически у всех пациентов с ожирением. У здоровых людей чувствительность к внешним пищевым стимулам прослеживается только в состоянии голода и зависит от временных интервалов между приемами пищи, ее количества и состава; у больных ожирением всякие ограничители в этом отношении отсутствуют. Это связано также с тем, что помимо повышенного аппетита для таких пациентов характерно медленно формирующееся чувство насыщения. Причем чувство сытости у тучных людей ощущается при механическом переполнении желудка [12, 30, 31].
Эмоциогенное ПП является другим патологическим нарушением, выявляемым у 60% лиц с избыточной массой тела. Такое ПП называют также гиперфагической реакцией на стресс. В специальной литературе можно встретить такие образные определения этого состояния, как «углеводная жажда» и «пищевое пьянство». При этом расстройстве пациенты принимают пищу не потому, что они голодны, а в ответ на эмоциональный дискомфорт, который они пытаются компенсировать приемом высококалорийной и богатой углеводами пищи. Среди жизненных ситуаций, которые могут приводить к обострению эмоциогенного ПП, можно отметить смерть или тяжелую болезнь близких людей, развод или супружескую измену, тяжелые конфликты в семье и на работе, осознание собственного несоответствия социальным стандартам [12, 32].
Характерной чертой ограничительного ПП являются бессистемные строгие диеты и избыточные пищевые самоограничения, к которым прибегают больные ожирением, и следующие за ними приступы переедания, приводящие к еще более интенсивному набору веса, чем до начала диеты. Комплекс эмоциональных расстройств на фоне такого рода «диетотерапии» включает повышенную раздражительность, чувство внутреннего напряжения, утомляемость с ощущением постоянной усталости, тревожность и т.н. диетическую депрессию, которая в конечном итоге приводит к отказу от дальнейшего соблюдения диеты и рецидиву набора веса. После этого у больных происходит снижение самооценки, формируется чувство вины и представление о невозможности излечения [12]. В исследовании Т.Г. Вознесенской и соавт. выявлено, что пациенты с ожирением и различными нарушениями ПП при лечении только с помощью различных пищевых ограничений в 100% случаев страдали от тех или иных проявлений «диетической депрессии» [30]. Кроме того, у 30% больных ожирением, исходно не имевших клинически выраженных признаков нарушения ПП, они манифестировали на фоне монотерапии диетой, что сопровождалось эмоциональным дискомфортом и в дальнейшем приводило к отказу от лечения [33].
В ряде работ было показано, что примерно в 20% случаев на фоне диетотерапии у пациентов могут развиваться симптомы депрессии со снижением качества жизни, даже несмотря на проводимую при этом психокоррекцию. Этот факт, возможно, объясняется наличием у таких больных нарушений кодирования генов, отвечающих за избыточную массу тела и депрессивное состояние. Предполагается, что индекс массы тела (ИМТ) прямо коррелирует с состоянием депрессии и одна из 21 генетической вариации (однонуклеотидных полиморфизмов) отвечает за совместное течение ожирения и депрессии. В более раннем исследовании на близнецах было отмечено, что около 12% генетического материала, ответственного за состояние депрессии, также кодировало и ожирение [34].
С другой стороны, предполагается, что связь между депрессией и ожирением может не только иметь генетическую природу, но и быть обусловленной приемом антидепрессантов, способствующих стабилизации настроения, подавлению чувства насыщения и снижению физической активности, что ведет к набору веса [35]. Кроме того, необходимо учитывать, что в условиях инсулинорезистентности, которая часто развивается при ожирении, в результате ряда метаболических и нейрохимических процессов (снижение количества или аффинности рецепторов, нарушения передачи сигнала) происходит подавление высвобождения серотонина – нейромедиатора, ответственного за настроение и чувство сытости [36, 37]. Так, у людей с нормальным весом употребление небольшого количества углеводов вызывает достаточную секрецию инсулина, который обеспечивает не только утилизацию глюкозы, но и поступление в скелетную мускулатуру крупных нейтральных аминокислот как разветвленной (лейцин, изолейцин), так и ароматической (тирозин, фенилаланин) структуры. В этих условиях триптофан свободно проникает через гематоэнцефалический барьер в головной мозг, где превращается в серотонин. При инсулинорезистентности и ослаблении анаболических эффектов этого гормона затрудняется утилизация упомянутых аминокислот, в связи с чем возникает конкуренция между триптофаном и нейтральными аминокислотами за проникновение через гематоэнцефалический барьер, что снижает количество триптофана, проникающего в мозг. Интересно, что употребление в пищу белков, содержащих триптофан, не увеличивает (и даже скорее снижает) синтез серотонина в мозге. Это связано с тем, что в структуре молекул белков, поступающих с пищей, доля триптофана очень невелика (1–1,5%), тогда как содержание аминокислот, конкурирующих с триптофаном при проникновении через гематоэнцефалический барьер, достигает 20–25%.

Важной составляющей в формировании неадекватного ПП является также неправильное воспитание в раннем детском возрасте. Например, так бывает в тех семьях, где пища позиционируется как основной источник удовольствия, а альтернативные пути (эстетические, духовные, интеллектуальные) в полной мере не развиваются. Или когда в ситуациях любого дискомфорта у ребенка вне зависимости от его соматического или эмоционального характера мать находит решение проблемы в кормлении. В дальнейшем даже по достижении ребенком зрелого возраста это мешает ему дифференцировать соматические ощущения от эмоциональных (голод от тревоги) и формирует неправильное ПП. Выяснение всех этих ситуаций требует детального опроса пациента и проведения психологической терапии с целью коррекции ПП и достижения оптимальных результатов в снижении веса [30, 32, 37].
Роль ожирения и ПП в развитии ГЭРБ
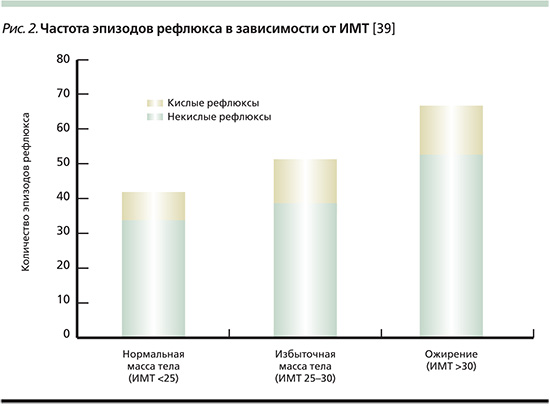
Ассоциация между ожирением и ГЭРБ достаточно хорошо изучена. На популяционном уровне было показано, что рост заболеваемости ГЭРБ ассоциирован с увеличением распространенности ожирения среди населения [1, 38]. Исследования с применением рН-импедансометрии наглядно демонстрируют, что частота возникновения кислых и некислых рефлюксов прямо коррелирует с показателем ИМТ (рис. 2) [39]. К настоящему времени в нескольких мета-анализах и систематических обзорах было показано, что ожирение является значимым фактором риска не только ГЭРБ, но и ее осложнений, включая пищевод Барретта и аденокарциному пищевода (табл. 3) [40–43]. Так, в мета-анализе, включившем 9 исследований, отношение шансов (ОШ) развития ГЭРБ у пациентов с избыточной массой тела (ИМТ от 25 до 29 кг/м2) составило 1,43, а у лиц с ожирением (ИМТ более 30 кг/м2) – 1,94 (95% доверительный интервал [ДИ] – 1,46–2,57) [40].
В другом мета-анализе было выявлено существенное повышение риска развития эрозивной формы ГЭРБ у больных ожирением: ОШ=1,87 (95% ДИ – 1,51–2,31) [42].
Существует ряд патофизиологических изменений, ассоциированных с повышенным риском ГЭРБ у лиц с ожирением (рис. 3) [44]. При этом основными механизмами, индуцирующими возникновение патологических рефлюксов при избыточной массе тела, являются [1, 4, 6, 38, 45]:
- высокое внутрибрюшное давление;
- повышенный желудочно-пищеводный градиент, в т.ч. на фоне замедления желудочной эвакуации;
- низкое давление в области НПС, в т.ч. из-за нарушения его анатомической конфигурации, например, при перерастяжении области дна желудка, характерном для пациентов с ожирением, или при наличии ГПОД;
- повышенная частота СРНПС.
В ряде публикаций рассматривается «механическая теория», объясняющая высокую распространенность ГЭРБ у пациентов с повышенной массой тела и ожирением, избытком висцерального жира в области эзофаго-гастрального соединения, что является дополнительной причиной дисфункции НПС [46]. Эти данные подтверждаются результатами нескольких работ с использованием компьютерной томографии для определения объема висцерального жира, в которых выявлена прямая зависимость между его количеством и частотой возникновения эрозивного эзофагита [47, 48].
Как было отмечено выше, перерастяжение желудка при переедании является частой ситуацией у пациентов, склонных к ожирению, поскольку является необходимым условием появления чувства насыщения. Однако такое чрезмерное растяжение, особенно в области дна и кардиального отдела, приводит к увеличению частоты и продолжительности СРПНС, что является одним из важнейших звеньев патогенеза ГЭРБ у лиц с избыточной массой тела [6].
Нарушение анатомической структуры антирефлюксного барьера (за счет растяжения эзофаго-гастрального соединения и отложения в этой области висцерального жира) в сочетании со снижением рН желудочного содержимого создает беспрепятственные условия для кислых рефлюксов в пищевод. Кроме того, после обильного приема калорийной пищи тучные люди часто стремятся придать телу горизонтальное положение, что ведет к увеличению времени желудочной эвакуации и пищеводного клиренса с последующим нарушением моторики и повреждением слизистой оболочки пищевода [38].
Употребление большого количества острых, кислых и пряных блюд способствует снижению рН в желудке и увеличению количества кислых ГЭР. А обильный прием жареной и жирной пищи значительно чаще провоцирует появление в рефлюктате примеси дуоденального содержимого, что является причиной слабокислых или щелочных ГЭР, которые могут быть не менее агрессивными, чем кислые рефлюксы, но не всегда выявляются с помощью стандартной рН-метрии [38, 44].

Фармакотерапия ГЭРБ
Согласно рекомендациям по лечению ГЭРБ как российской, так и американской гастроэнтерологических ассоциаций, препаратами выбора на сегодняшний день являются ингибиторы протонной помпы (ИПП) благодаря их эффективному контролю над симптомами ГЭРБ и положительному влиянию на морфологические изменения [16, 49–51].
Однако на практике большинству больных ГЭРБ, страдающих ожирением, недостаточно стандартных курсов терапии ИПП (при неэрозивной форме ГЭРБ курс лечения составляет 4 недели, в случае эрозивного эзофагита – 8). Общая частота случаев клинической неэффективности лечения больных ГЭРБ, выражающаяся частичным или полным сохранением имеющихся симптомов на фоне приема стандартных доз ИПП, составляет 10%, а при наличии избыточного веса эта цифра может достигать 40% [52, 53]. Только 32% пациентов, в т.ч. с ожирением, принимают ИПП однократно, остальные – 2 и более раз в день, т.к. эффекта от однократного приема зачастую бывает недостаточно [54]. При этом немалая доля коморбидных больных ГЭРБ с ожирением остается рефрактерной к лечению ИПП, что указывает на необходимость принимать во внимание и другие (помимо воздействия соляной кислоты) факторы патогенеза ГЭРБ [55].
Основными причинами неэффективности кислотосупрессивной фармакотерапии для больных избыточным весом являются [4, 6]:
- частые дуоденогастроэзофагеальные рефлюксы, определяющие слабокислый, нейтральный либо даже слабощелочной характер рефлюктата;
- замедление желудочного транзита;
- нарушения анатомической конфигурации в области эзофагогастрального перехода;
- наличие гиперсенситивного пищевода;
- в ряде случаев низкий комплаенс (приверженность пациентов лечению имеет обратную зависимость от частоты сохраняющихся симптомов).
Резистентность к стандартным схемам антисекреторных препаратов зачастую объясняется вышеуказанными патогенетическими механизмами развития ГЭРБ на фоне ожирения, что требует увеличения продолжительности курса лечения и/или дозировок препаратов для достижения и поддержания долгосрочной ремиссии. Это в свою очередь повышает риск нежелательных явлений на фоне кислотосупрессивной терапии, таких как прогрессирование атрофии слизистой оболочки желудка (особенно при наличии инфекции Н. pylori), ахлоргидрия, избыточный бактериальный рост, гипокальциемия, остеопороз и др.
Частое присутствие компонентов желчи в рефлюктате у больных ГЭРБ, страдающих ожирением, требует коррекции общепринятых схем лечения с добавлением к средствам подавления кислотопродукции препаратов урсодезоксихолевой кислоты (УДХК). При этом назначение ИПП обеспечивает защиту слизистой оболочки пищевода от повреждающего воздействия соляной кислоты, а также уменьшение общего объема рефлюктата, а эффект УДХК направлен на связывание гидрофобных желчных кислот, что также обеспечивает цитопротективный эффект и предотвращает запускаемый ими апоптоз эпителиоцитов [56]. Такая комплексная защита позволяет добиваться регресса клинической симптоматики и эндоскопических признаков повреждения слизистой оболочки желудка и пищевода [31].
Фармакотерапия ожирения
Лекарственная терапия ожирения назначается для повышения эффективности немедикаментозных методов лечения (рациональное питание, физические нагрузки), предотвращения рецидивов, улучшения метаболических показателей, а также повышения приверженности пациентов лечению. Показанием к медикаментозной терапии является снижение массы тела менее чем на 5% от исходного веса в течение 3 месяцев после начала немедикаментозных мероприятий [57].
Согласно рекомендациям Управ-ления по санитарному надзору за качеством пищевых продуктов и медикаментов США (Food and Drug Administration, FDA), для лечения ожирения могут использоваться препараты, которые в клинических исследованиях в течение года обеспечили снижение веса не менее чем у 35% пациентов, как минимум на 5% более выраженное по сравнению с плацебо. Желательно также, чтобы препарат имел минимальное количество побочных эффектов и обладал благоприятным метаболическим профилем [13].
Одобренные FDA препараты для лечения ожирения можно разделить на 2 группы: для длительного применения и для краткосрочной терапии. К первой группе относятся орлистат, лираглутид, а также комбинации фентермин/топирамат и налтрексон/бупропион. Во вторую группу входят диэтилпропион, фентермин, бензфетамин. В России на сегодняшний день зарегистрированы орлистрат и лираглутид, а также могут использоваться метформин (для лечения пациентов с ожирением с сопутствующим нарушением углеводного обмена), флуоксетин (при сочетании ожирения и депрессивных расстройств), бупропион (у пациентов с ожирением и никотиновой зависимостью) и топирамат (противоэпилептический препарат для лечения ожирения у пациентов с биполярными расстройствами).
Орлистрат – препарат периферического действия, не обладающий системными эффектами. Его способность к снижению веса основана на инактивации липазы в тонком кишечнике, что в дальнейшем препятствует расщеплению и всасыванию примерно 30% потребляемых жиров. Возникающее в результате снижение энергопотребления способствует редукции массы тела. По данным систематического обзора, средняя потеря веса при приеме орлистрата составила 8,8 кг (по сравнению с плацебо – 5,8 кг). При этом снижение массы тела более чем на 5% отмечено у 75% больных [58]. Среди побочных эффектов орлистрата следует отметить учащение дефекаций, жирный стул, маслянистые выделения из заднего прохода. Однако при коррекции рациона (потреблении жира менее 30% от общей суточной калорийности) такого рода нежелательных явлений можно избежать [58, 59].
Наибольшего внимания заслуживает лираглутид, который является аналогом человеческого глюкагоноподобного пептида-1 (ГПП-1) и имеет 97% аминокислотной гомологичности эндогенному человеческому ГПП-1, что улучшает переносимость препарата, а также снижает риск побочных явлений. Изначально лираглутид был утвержден в качестве сахароснижающего препарата, а затем в 2015 г. он получил одобрение FDA как препарат для лечения ожирения у взрослых. Он обеспечивает снижение веса пациента за счет уменьшения потребления пищи, поскольку снижает аппетит и ослабляет чувство голода [58]. В крупном многоцентровом исследовании эффективности ежедневного применения лираглутида, в котором проводилось наблюдение за 564 пациентами в течение 20 недель, было показано, что его использование в суточных дозировках 1,2; 1,8; 2,4 и 3,0 мг позволяет добиваться снижения веса на 4,8; 5,5; 6,3 и 7,2 кг соответственно. Эти результаты были достоверно выше по сравнению с группой пациентов, принимавших орлистрат в дозировке 360 мг/сут (4,1 кг) и плацебо (2,8 кг). На фоне приема лираглутида во всех дозировках отмечалось снижение артериального давления и редуцировались проявления преддиабета (84–96% пациентов). Из нежелательных явлений отмеченытошнота и рвота, которые имели кратковременный преходящий характер и редко приводили к прекращению лечения [60].
Метформин представляет большой интерес для терапии ожирения при нарушениях углеводного обмена, т.к. он снижает аппетит и замедляет всасывание углеводов из пищеварительного тракта, что в свою очередь сопровождается уменьшением запасов висцерального жира и стабилизацией массы тела.
При наличии у пациентов с ожирением депрессивных расстройств препаратами выбора могут быть флуоксетин и бупропион. Флуоксетин (селективный ингибитор обратного захвата серотонина) исследовался как препарат для лечения ожирения, однако рецидивы набора веса во втором полугодии терапии привели к прекращению его тестирования как средства монотерапии ожирения.
При изучении действия бупропиона (селективного ингибитора обратного захвата норадреналина и дофамина) помимо основного антидепрессивного эффекта в клинических исследованиях выявлены также дополнительные свойства. В частности, его используют при лечении никотиновой зависимости и, кроме того, при приеме бупропиона в дозе 400 мг/сут было отмечено снижение массы тела пациентов до 7,2%. Однако бупропион не рекомендован для лечения ожирения, если оно не ассоциировано с необходимостью отказа от курения и/или лечения депрессии.
Топирамат – препарат с противоэпилептической активностью, при назначении которого дополнительно отмечалась потеря веса до 7,3% от исходного уровня. На сегодняшний день топирамат применяется для лечения коморбидных пациентов с ожирением и биполярными расстройствами. За рубежом бупропион и топирамат входят в состав комбинированных препаратов для лечения ожирения: налтрексон/бупропион и фентермин/топирамат, однако данные комбинации не зарегистрированы в РФ [58, 59].
Препараты краткосрочного действия объединены в одну группу, т.к. имеют те же эффекты, что и норадреналин, приводя к снижению массы тела в основном за счет подавления аппетита. Они обладают симпатомиметическим эффектом, который может проявляться возбуждением, нарушением сна, нервозностью, а также сухостью во рту. Кроме того, симпатомиметики вызывают тахикардию и артериальную гипертензию, поэтому пациентам из группы риска по сердечно-сосудистым заболеваниям эти лекарственные средства следует назначать с большой осторожностью. К препаратам данной группы часто развивается толерантность, также они могут вызывать психическую и физическую зависимость. Вследствие этого симпатомиметические препараты рекомендованы к применению для лечения ожирения только короткими курсами [58].
К сожалению, несмотря на большие успехи в изучении патогенеза ожирения, в мире до сих пор не разработаны принципиально новые эффективные препараты для лечения этого заболевания. В качестве будущих подходов интересными кажутся комбинации препаратов для коррекции веса и сахароснижающих препаратов с эффектами снижения массы тела (метформин). Кроме того, при лечении пациентов с ожирением необходимы совместные усилия врачей разных специальностей, в т.ч. клинических психологов – для коррекции нарушений ПП.
Заключение
В основе патогенетических механизмов развития ГЭРБ лежит несоответствие между силой факторов агрессии желудочного и/или дуоденального рефлюктата и эффективностью факторов защиты пищевода. Наиболее часто к снижению функции антирефлюксного барьера приводят наличие ГПОД, снижение тонуса НПС, учащение СРНПС.
Основными патогенетическими механизмами, индуцирующими возникновение ГЭРБ у лиц с избыточной массой тела, являются высокое внутрибрюшное давление, повышенный желудочно-пищеводный градиент, низкое давление в области НПС. Кроме того, немаловажная роль отводится нейрогуморальным факторам (лептин и грелин).
Неадекватное ПП приводит не только к повышению массы тела, но и к возникновению, усилению и увеличению частоты симптомов ГЭРБ. Структура нарушений ПП сложна и требует комплексных исследований с участием клинических психологов в процессе проведения диагностики и при назначении лечения пациентам с избыточной массой тела и ожирением. Это обусловлено высокой распространенностью расстройств ПП среди пациентов с ожирением и частым их сочетанием с другими психологическими нарушениями, в т.ч. тревожно-депрессивного характера.


