Введение
Метаболический синдром (МС) характеризуется комбинацией физиологических, биохимических, клинических и метаболических факторов, связанных с повышенным риском развития сердечно-сосудистых заболеваний и сахарного диабета 2 типа (СД2) [1]. Эксперты Всемирной диабетологической федерации артериальную гипертензию, гипергликемию натощак, дислипидемию (повышенные уровни триглицеридов и снижение уровня липопротеидов высокой плотности) и абдоминальное ожирение считают ключевым критерием определения МС, которые представляют значительную проблему для здравоохранения [2].
МС значительно распространен во многих странах и популяциях. Эпидемиологические исследования выявляют разную распространенность по всему миру – от <10 до 84% в зависимости от географического происхождения и состава исследуемой популяции, а также критериев оценки МС [1]. Ситуация по распространенности МС расценивается как пандемия ХХI в. со стойкой тенденцией к омоложению [3, 4].
Последние данные демонстрируют потенциальную роль микробиоты кишечника (МК) как патогенного фактора, ассоциированного с МС. Микробиота, скорее всего, – наша самая тесная связь с окружающей средой. В желудочно-кишечном тракте она в основном состоит из анаэробных бактерий трех видов – грамотрицательных Bacteroidetes, грамположительных Firmicutes и Actinobacteria [5]. МК предотвращает колонизацию патогенами [6], стимулирует пролиферацию эпителия кишечника и перистальтику [7], синтезирует витамины, гормоны, биогенные амины, а также регулирует накопление жира [8]. Качественные и количественные изменения МК связаны с различными клиническими состояниями, такими как ожирение [9], инсулинорезистентность (ИР) и СД2 [10], стеатогепатит [11], онкологические заболевания [12] и т.д. Видовой состав МК важен для создания оптимального гомеостаза и иммунного ответа. Изменение состава приводит к повышению бактериальных эндотоксинов, изменению соотношений короткоцепочечных жирных кислот (КЦЖК), что стимулирует экспрессию провоспалительных цитокинов, вызывая развитие хронического системного вялотекущего воспаления (ХрСВ), и коррелирует с клиническими проявлениями многих заболеваний [13].
Высококалорийный рацион питания влияет на состав МК, повышая ее метаболическую активность с образованием энергии от съеденной пищи, способствуя усвоению питательных веществ и удлинению времени хранения в жировой ткани [14].
На сегодняшний день относительно хорошо изучены механизмы морфологических и функциональных изменений на фоне МС, однако вклад МК в этиологию и патогенез МС оказывается недостаточно изученным. Нет единого мнения о том, что собой представляет «типичная» МК при МС. Ограничения зависят от социокультурных особенностей в стране проживания, образа жизни, рациона питания, наследственности, возраста, количества выборки, а также метода исследования МК и т.д.
МК и ХрСВ
В настоящее время убедительно показано, что индуцируемый цитокинами острофазный ответ связан с дислипидемией, ИР, ожирением, атеросклерозом и т.д. [15]. Значительная роль в индукции ХрСВ отводится эндотоксину грамотрицательных бактерий – липополисахариду (ЛПС) и пептидогликанам, липотейхоевым кислотам грамположительных бактерий. Бактериальные эндотоксины представляют собой патогенассоциированные молекулярные паттерны, которые распознаются врожденным иммунитетом (рис. 1).
В последние годы оживленно дискутируется роль стимуляции рецепторов врожденного иммунитета молекулярными паттернами, что связано с повышенной секрецией цитокинов и развитием ХрСв. Toll-подобные рецепторы (TLR – Toll-like receptors) являются главными компонентами врожденной иммунной системы. Каждый TLR идентифицирует определенную группу паттернов за счет высокой специфичности их лигандов. У человека детально изучены TLR-2 и TLR-4. TLR-4 специфичны для ЛПС, находятся в большом количестве в жировой ткани, на мембране моноцитов, макрофагов, миелоидных, эндотелиальных, тучных клеток, клеток эпителия кишечника, что объясняет влияние ЛПС на различные ткани организма [16]. К лигандам TLR-4 относятся также насыщенные жирные кислоты [17].
К паттерн-распознающим рецепторам относят также мембранные рецепторы (CD14, CD18, селектины и др.) и растворимые молекулы, которые распознают ЛПС, например липополисахарид-связывающий белок (LBP – lipopolysaccharide binding protein) и компоненты системы комплемента. Посредством LBP липополисахариды связываются с протеином CD14. Его функция заключается в связывании ЛПС и формировании высокоаффинного рецепторного комплекса вместе с TLR-4 [18].
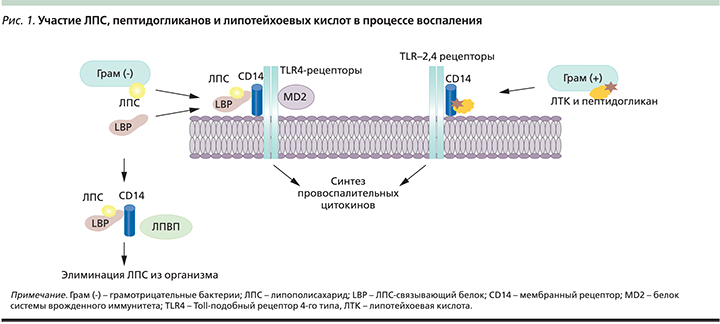
Таким образом, все эти рецепторы способны к распознаванию структур множества микроорганизмов и последующей активации ядерного транскрипционного фактора, инициирующего синтез воспалительных медиаторов. ХрСВ обусловливает развитие феномена «воспаления жировой ткани», проявляющегося инфильтрацией макрофагами, повышением секреции адипокинов, хемокинов. Увеличение инфильтрации жировой ткани макрофагами ведет к эктопическому накоплению липидов и ИР. Продукция интерлейкинов (ИЛ) макрофагами стимулирует липолиз в белой жировой ткани, что приводит к усилению глюконеогенеза.
Выявлено, что с ИЛ-6 и ИЛ-8 обратно ассоциируется представленность Clostridium кластера XIVa, Bifidobacterium, Faecalibacterium prausnitzii [19, 20] и положительно – Proteobacteria [19].
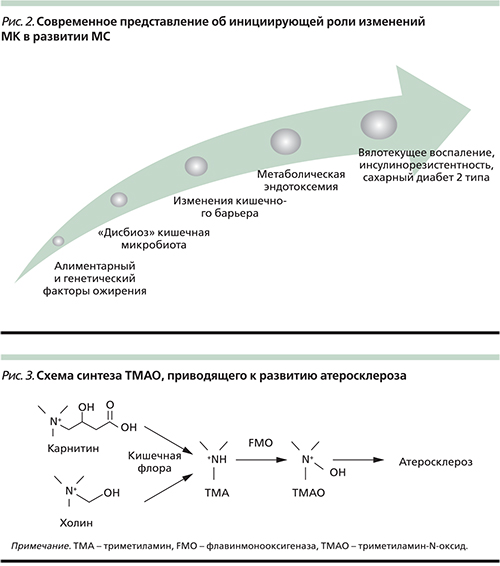
Однако нужно отметить, что развитие метаболической эндотоксемии связано не только и не столько с увеличением бактериальной нагрузки (особенно содержания условно-патогенных и патогенных видов), сколько с изменением проницаемости кишечного барьера. Установлено, что нарушение состава МК сопровождается повреждением белков, т.н. tight-junction – плотных контактов (ZO-1 и окклюдина), ответственных за эффективность барьерной функции кишечного эпителия [21] (рис. 2).
Таким образом, качественные и количественные изменения МК приводят к повреждению этих белков, патофизиологическим финалом которого на системном уровне становится развитие ХрСВ и ИР в печени, мышечной и жировой тканях, что способствует развитию ожирения, СД2, атеросклероза [22, 23].
МК и СД2
Первое свидетельство о влиянии МК на метаболизм глюкозы в эксперименте было опубликовано в 2004 г. [24]. На сегодняшний день наиболее полные работы по выявлению метагеномных маркеров СД2 сделаны в Китае [25] и Швеции [26]. Несмотря на некоторые расхождения, связанные с национальностью, диетой и приемом сахароснижающих препаратов, в этих исследованиях выявлено, что при СД2 меньше представленность бутират-продуцирующих бактерий (Roseburia и Faecalibacterium prausnitzii). Аналогичные данные были получены P.J. Pussinen и соавт. [27]. Более ранние клинические и экспериментальные исследования связывали ожирение и нарушение гликемии с изменением соотношения основных отделов – уменьшением Bacteroidetes и увеличением Firmicutes [28, 29].
В эксперименте и клинике выявлено, что еще до начала развития заболевания в тканях могут быть обнаружены живые грамотрицательные бактерии (Proteobacteria до 85–90%) у лиц с предрасположенностью к СД [30, 31]. Авторы предположили, что количество 16S-rDNA в крови может служить биомаркером развития СД [31].
Есть данные, согласно которым с активностью L-клеток кишечника, секретирующих глюкагон-подобный пептид-1, связаны бактерии Akkermansia muciniphila, которые составляют 3–5% общей численности микрофлоры. Они также образуют тесное симбиотическое сообщество с клетками, выстилающими внутреннюю поверхность кишечника, укрепляют кишечный барьер, уменьшая его проницаемость. Следовательно, снижение представленности A. muciniphila ассоциировано с метаболическими нарушениями и гипергликемией [32, 33].
МК и ожирение
Экспериментальные данные показали, что животные с ожирением имеют меньше бактерий Bacteroidetes и больше Firmicutes, чем худые [34]. В отличие от животных у человека данные неоднозначны, что объясняется влиянием многочисленных генетических и экологических факторов МК [35].
В исследовании R.E. Ley и соавт. выявлено, что при ожирении представленность Bacteroidetes снижается, а Firmicutes, наоборот, увеличивается [36]. Такие же данные получены P.J. Turnbaugh и соавт. [37].
H. Zhang и соавт. показали, что число бактерий семейства Prevotellaceae, относящегося к отделу Bacteroidetes, значительно снижается при ожирении. Соотношение основных отделов Firmicutes/Bacteroidetes отражает динамику массы тела – при увеличении числа Bacteroidetes человек с ожирением худеет. В своем исследовании H. Zhang доказал, что здоровый образ жизни нормализует МК и способствует поддержанию нормальной массы тела [38]. Однако в ряде исследований не подтвердили наличие таких ассоциаций и, наоборот, выявили противоположные [39] или вовсе не обнаружили связи между МК и массой тела [40].
В 2013 г. выявлено, что представленность грамположительной бактерии Oscillospira находится в обратной корреляции с индексом массы тела [41]. Эти данные были подтверждены в другом исследовании, где выявлено снижение численности Oscillospira у людей с ожирением [42]. У пациентов с избыточной массой тела, ожирением и СД2 снижена также представленность бактерий рода Bifidobacterium [43].
МК и атеросклероз
Помимо влияния ХрСВ на риск развития эндотелиальной дисфункции и атеросклероза данные исследований последних лет показали, что холиновая половина фосфатидилхолина насыщенных жиров пищи используется некоторыми кишечными бактериями для синтеза интермедиата триметиламина (ТМА), который быстро абсорбируется и окисляется ферментами семейства FMO (флавинмонооксигеназа) в печени до триметиламин-N-оксида (ТМАО), вызывающего развитие атеросклероза [44].
Использование кишечными бактериями триметиламинной группы холина для синтеза ТМА ставит вопрос о существовании подобных метаболических путей для аналогичных соединений, включающих эту группу. Одна из таких молекул – L-карнитин. С учетом сходства в структуре между L-карнитином и холином (рис. 3) выдвинута гипотеза, будто L-карнитин пищи, как холин и фосфатидилхолин, может стать источником TMA и TMAO и быть связан с атеросклерозом.
Данные о синтезе ТМАО из L-карнитина подтвердились в 2013 г. [44], хотя предшествовавшие эксперименты на крысах не выявили этой связи [45].
L-карнитин и холин-содержащие липиды составляют примерно 2% «западной» диеты [46, 47]. Рандомизированное исследование в течение 4,8 года показало 30%-ное снижение сердечно-сосудистых событий у людей, потребляющих средиземноморскую диету, по сравнению с людьми, следующими обычной диете [48].
Достоверное повышение уровней TMAO наблюдалось при доминировании бактерий Prevotella по сравнению с Bacteroides [49].
Коррекция дисбиотических нарушений и МС
Результаты проведенных исследований оправдывают поиск методов влияния на МК с целью лечения МС. Изучается несколько возможных направлений. Попытки модифицировать образ жизни показали положительные результаты. Выявлено, что уменьшение количества углеводов в рационе приводит к диетозависимому снижению представленности Firmicutes [50]. Анализ МК взрослых, у которых в рационе доминировали богатые растительной клетчаткой продукты, выявил большое разнообразие состава флоры и бóльшую представленность рода Prevotella по отношению к Bacteroides [51].
Накоплено значительное количество данных о применении пре-, пробиотиков, а также синбиотиков и полифенолов, за счет которых достигаются целенаправленные изменения МК. Эти добавки ведут к улучшению целостности кишечного барьера, уменьшению метаболической эндотоксемии и, соответственно, к улучшению метаболического статуса [52, 53].
Экспериментально выявлено, что у мышей с ожирением примерно в 3000 раз меньше бактерий рода A. muciniphila. При добавлении в корм культуры этих бактерий и доведении их содержания в организме до стандартного уровня мыши начинали худеть. При введении A. muciniphila уменьшалась ИР и наблюдалась коррекция индуцированной диетой гипергликемии за счет подавления глюконеогенеза [54].
В эксперименте и клинике продемонстрировано, что при ожирении после проведения желудочного шунтирования наблюдается снижение массы тела и увеличение представленности Gamma proteobacteria (Escherichia) и Verrucomicrobia (Akkermansia) [55].
В последнее время появляется все больше данных о метформин-индуцированных изменениях в МК. Метформин – патогенетический препарат первой линии в лечении СД2. Интересен факт, что метформин также приводит к увеличению содержания A. muciniphila. У экспериментальных мышей наблюдалось метформин-индуцированное его повышение и улучшение углеводного обмена [56].
При исследовании состава МК у мышей с диетоиндуциированным ожирением, как и ожидалось, на фоне лечения метформином отмечалось уменьшение метаболических нарушений: гликемии, общего холестерина и массы тела. Выявлено увеличение представленности бактерий A. muciniphila (на 12,44%) и Clostridium cochleatum (на 0,10%). На фоне лечения метформином были активированы 30 метаболических путей KEGG (Kyoto Encyclopedia of Genes and Genomes – база данных по систематическому анализу функций генов). После исключения путей, связанных с диетическими изменениями, выявлено, что 18 были ассоциированы исключительно со специфическими эффектами метформина (включая метаболизм сфинголипидов и жирных кислот) [57].
В другом исследовании продемонстрировано, что метформин увеличивает продолжительность жизни Caenorhabditis elegans и представленность Akkermansia в кишечнике, что усиливает синтез глюкагонподобного пептида-1, Т-регуляторных клеток (супрессоры различных иммунокомпетентных клеток) и снижает ХрСВ в жировой ткани животных с ожирением [58].
Заключение
С развитием молекулярно-генетических технологий появились новые факты о связи измененной МК не только с заболеваниями желудочно-кишечного тракта, но и с метаболическими нарушениями. Очевидно, что поддержание гомеостаза и нормального обмена веществ невозможно без восстановления разнообразия нормальных ассоциаций микроорганизмов кишечника. Несмотря на доказанный эффект диетотерапии, пре- и пробиотиков, а также метформина, необходимы дальнейшие исследования с целью разработки дифференцированных схем воздействия на МК и достижения таким путем улучшения метаболизма и для лечения МС.



