Введение
Увеличение распространенности сахарного диабета (СД) привело к росту числа макро- и микрососудистых осложнений СД, в т.ч. диабетической нефропатии (ДН) и терминальной стадии почечной недостаточности (ТПН) [2]. ДН является многофакторным осложнением и одной из основных причин ТПН, связанной с повышенной сердечно-сосудистой заболеваемостью и смертностью [3]. Диабетическую болезнь почек также определяют как ДН и диагностируют по альбуминурии (соотношение альбумина в моче к креатинину ≥30 мг/г), снижению скорости клубочковой фильтрации (<60 мл/мин/1,73 м2) или по их сочетанию [4]. ДН является единственным сильным предиктором смертности среди пациентов с СД [4, 5] Поэтому необходимо раннее определение ДН и интенсификация ее терапии. Кроме окислительного стресса и гемодинамических изменений повреждение гликозаминогликанов (ГАГ) является дополнительным фактором, ведущим к гломерулопатии у пациентов с СД [6]. В связи с этим восстановление синтеза гепараносульфата препаратами ГАГ можно рассматривать как патогенетическое лечение ДН [7]. Терапия ДН препаратами ГАГ началась около 20 лет назад, и сулодексид является наиболее широко изученным ГАГ, используемым для снижения альбуминурии у пациентов с СД [8, 9]. Сулодексид состоит из низкомолекулярного гепарина и дерматансульфата, может влиять на морфологию и функцию гломерулярных базальных мембран (ГБМ) почек [10]. Сулодексид может защищать от инициации и прогрессирования ДН, о чем свидетельствует снижение альбуминурии [11]. Однако два исследования, которые оценивали эффективность сулодексида у пациентов с СД2, не смогли продемонстрировать нефропротекцию как для микро- (начинающейся), так и для макро- (явной) альбуминурии [12, 13] Поэтому мы сообщаем результаты мета-анализа, суммирующего влияние сулодексида на прогрессирование ДН у пациентов с СД1 и 2 [1].
Материал и методы
Стратегия поиска
Проведен поиск в PubMed, MEDLINE и Web of Science, Scopus и EMBASE в апреле 2015 г. с использованием следующих поисковых терминов: «диабетическая нефропатия», «протеинурия», «альбуминурия» и «сулодексид». Сначала были просмотрены публикации по названиям, а затем по аннотациям. После исключения нерелевантных публикаций и выявления дубликатов из разных баз данных проанализирована полнотекстовая версия источника. Языки публикации ограничены английским и китайским. Были выбраны все клинические исследования, кроме отчетов о случаях [1].
Критерий выбора
В мета-анализе собраны все подходящие статьи о связи между сулодексидом и микро/макроальбуминурией и клиническими исходами при ДН. Были применены следующие критерии включения: (1) тип дизайна исследования представлял собой рандомизированное контролируемое исследование, в котором сулодексид сравнивали с плацебо, отсутствием лечения или другими антигипертензивными препаратами (за исключением ингибиторов ангиотензинпревращающего фермента [ИАПФ] и блокаторов рецепторов ангиотензина [БРА]), экскрецию альбумина с мочой; (2) все участники были пациентами с СД и протеинурией; (3) в исследовании сообщалось об изменениях экскреции белка с мочой по сравнению с исходным уровнем; (4) продолжительность исследования превышала 3 недели. Применены следующие критерии исключения: (1) статьи, в которых отсутствовала информация о протеинурии или которые не могли быть рассчитаны по показателю экскреции альбумина средних значений из предоставленной информации; (2) отчеты о случаях, письма, обзоры, мнения экспертов, тезисы конференций, редакционные статьи и статьи не на английском и не на китайском языках; (3) все статьи с использованием клеточных линий, ксенотрансплантатов человека и исследований in vitro/ex vivo [1].
Извлечение данных
Подходящие исследования отобраны двумя исследователями независимо друг от друга. Разногласия разрешались путем обсуждения и консенсуса. Для каждого исследования записывалась следующая информация: имя первого автора, год публикации, количество пациентов, источник образца, микро- и макропротеинурия, клинико-патологические параметры. Два исследователя просмотрели все статьи, соответствовавшие критериям включения и исключения. Неоднородность данных оценена, чтобы определить, можно ли анализировать результаты различных исследований. Данные по характеристикам и клиническим результатам исследования обобщены и представлены в виде таблицы [1].
Статистический анализ
Для этого анализа использовали RevMan 5.2 (Северный Кокрейновский центр, Копенгаген; Дания) и Stata 12.0 (Stata Corporation, Колледж-Стейшн, Техас; США). Сравнения дихотомических показателей определялись с помощью объединенных оценок отношения шансов (ОШ), а также их 95% доверительных интервалов (ДИ). Неоднородность определяли с помощью критерия хи-квадрат, при этом значимость установлена на уровне р<0,10; общая вариация между исследованиями оценивалась как I2, при этом значимость установлена как I2 >50%. Значение р<0,05 считалось статистически значимым. Авторы использовали модель со случайным эффектом для объединения ОШ при неоднородности исследований; в противном случае выбиралась модель с фиксированным эффектом. Для сравнения результатов альбуминурии или протеинурии в разных единицах решено обобщить терапевтические эффекты сулодексида на экскрецию белка с мочой с использованием соотношения средних терапевтических эффектов в опытной группе по сравнению с контрольной с использрванием методы Kunz et al. [14]. Это примерно сопоставимо для разных единиц измерения и может быть непосредственно применено в клиническом контексте [15].
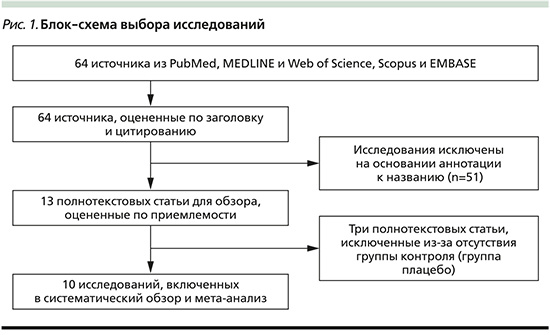
Сначала было отобрано 64 статьи из PubMed, MEDLINE и Web of Science, Scopus и EMBASE. Потом после первоначальной проверки заголовков и рефератов на соответствие требованиям извлечены 13 полнотекстовых исследований для более детальной оценки. Из них были исключены три перекрестных исследования без группы плацебо в качестве контроля [16–18]. В конечном итоге отобрано 10 публикаций, которые соответствовали критериям включения в этот мета-анализ [12, 13, 19, 20–23, 51–53]. Процесс поиска статей и отбор исследований показаны на рис. 1.
Результаты
Дизайн исследования
Для этого мета-анализа отобрано 10 подходящих исследований, опубликованных с 2005 по 2013 г., и включены 2770 пациентов с СД1 и 2 из Китайской Народной Республики, Австралии/Новой Зеландии, Нидерландов, Польши, Испании, Великобритании, Канады и США [12, 13, 19–23, 51–53]. Все публикации соответствовали критериям включения в мета-анализ и содержали информацию о количестве пациентов, их возрасте, исходные параметры протеинурии и среднее артериальное давление до лечения (табл. 1) [1]. Было показано, что сопутствовавшие факторы, влиявшие на экскрецию альбумина с мочой, были сопоставимыми в группе сулодексида и в контрольной группе и не влияли на мета-анализ (табл. 2) [1].

Антипротеинурический эффект сулодексида
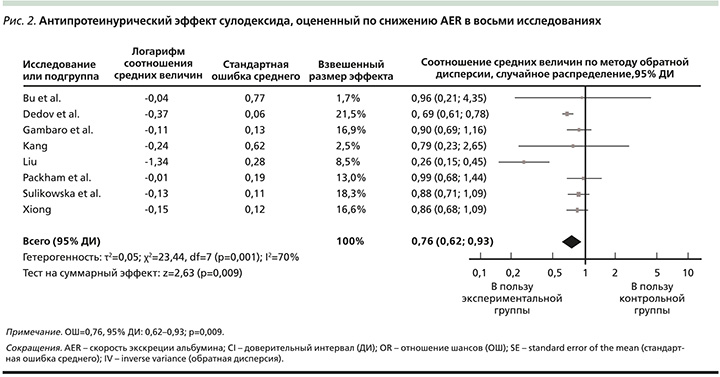
Несмотря на различные типы СД (1 или 2), стадию протеинурии (микро- или макроальбуминурия), периоды наблюдения и расы, которые могли влиять на результаты лечения сулодексидом в отношении протеинурии, все данные были объединены для мета-анализа. В каждом исследовании, если было доступно несколько периодов наблюдения, выделен максимальный и проведено сравнение средних значений отношения скорости экскреции альбумина с мочой (AER) между группами сулодексида и плацебо до и после терапии. В целом терапия сулодексидом сопровождалась значительным снижением скорости экскреции белка с мочой. Средние значения между группами сулодексида и плацебо из восьми исследований составило 0,76 (95% ДИ: 0,62–0,93, z=2,63; р=0,009), I2=70% (рис. 2), что указывает на однородность и качество исследований [1].
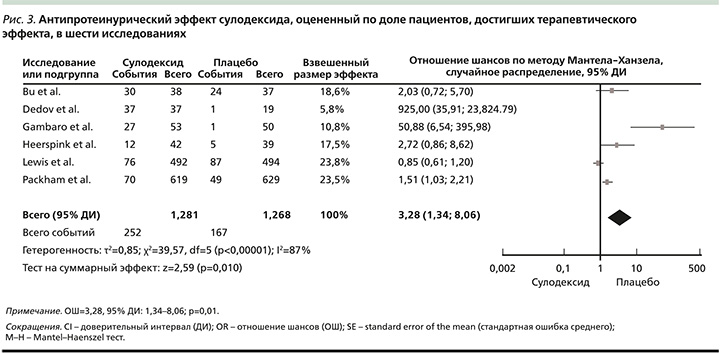
Затем исследователи сравнили доли пациентов, достигших терапевтического успеха, определяемого как снижение AER [12] не менее, чем на 50%, при лечении сулодексидом. Этот показатель аналогичен тому, который Heerspink et al. [22] оценивали как бинарную составную конечную точку, включившую: 1) конверсию в нормоальбуминурию (отношение альбумина к креатинину <20 мг/г) и 25%-ное снижение отношения альбумина к креатинину по сравнению с исходным уровнем или 2) снижение отношения альбумина к креатинину на 50% по сравнению с исходным уровнем. Heerspink et al. также показали положительную корреляцию между скоростью экскреции альбумина мочи за 24 часа и средним геометрическим трех отношений альбумина к креатинину в первой утренней порции мочи. Таким образом, в шести квалификационных исследованиях 50%-ного снижения скорости экскреции альбумина с мочой достигли 220 (19,5%) пациентов в группе сулодексида и только 165 (13,0%) в группе плацебо. Примечательно, что в двух исследованиях [19, 24] в одной ячейке не было испытуемых и мы изменили данные с нуля в соответствии с предыдущими публикациями. Согласно мнению Wilson [25], обычный способ решить эту проблему – добавить 0,5 к каждой из четырех ячеек таблицы 2×2 – это известно как приближение Холдейна. В мета-анализе приближение Холдейна также может быть применено одним из двух подходов: добавить 0,5 только к испытаниям с нулевой ячейкой или ко всем испытаниям в мета-анализе. Мало известно, какой подход лучше использовать в сочетании с различными определениями ОШ: обычное отношение шансов, ОШ Пето или ОШ Мантеля–Хензеля? Кроме того, Friedrich et al. [26] также пришли к выводу, согласно которому для включения всех соответствующих данных независимо от выбранной меры эффекта, обозреватели должны также включать испытания с нулевым общим числом событий при расчете объединенных оценок с использованием ОШ и ОР. К двум испытаниям с нулем были добавлены «1» (поскольку минимальный ввод в ячейке RevMan 5,3 равен «1»). Затем были повторно проанализированы данные и измененные данные были представлены в разделе «Результаты». После исключения двух исследований из мета-анализа, несмотря на высокую гетерогенность, ОШ существенно не изменилось. ОШ сравнения доли пациентов с терапевтическим успехом между группами сулодексида и плацебо из шести квалификационных работ составило 3,28 (95% ДИ: 1,34–8,06, z=2,59; р=0,01; рис. 3) [1].
Изменения сывороточного креатинина и клиренса креатинина
Не было никаких существенных различий в изменении сывороточного креатинина и клиренса креатинина между двумя группами. Соотношение средних, сравнивавших средние значения пациентов между группами сулодексида и плацебо, составило 1,03 (95% ДИ: 0,89–1,19, р = 0,69; рис. 4) [1].
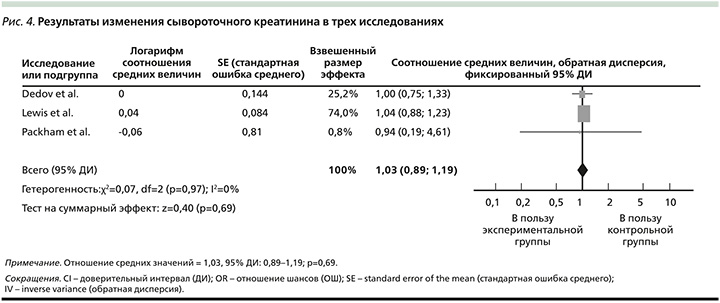
При анализе влияния сулодексида на скорость экскреции альбумина (рис. 2) и сывороточный креатинин (рис. 4) неоднородности не наблюдалось, поэтому использовалась модель с фиксированным эффектом. При анализе влияния сулодексида на достижение терапевтического успеха обнаружена неоднородность (рис. 3), поэтому использовалась модель случайного эффекта [1].
Побочные эффекты
Нежелательные явления были кратко описаны в четырех испытаниях [12, 13, 19, 22]. Частота «вероятно связанных» побочных эффектов была одинаковой в группах сулодексида (от 10,9 до 35,2%) и плацебо (от 12,2 до 32,3%). Считалось, что серьезных нежелательных явлений, связанных с исследуемым препаратом, не было. Наиболее частыми жалобами были сердечно-сосудистые нарушения; почечные и мочевые расстройства; желудочно-кишечные и гепатобилиарные расстройства; инфекции и инвазии; дыхательные, торакальные и медиастинальные расстройства; рана; отравления и процедурные осложнения; нарушения обмена веществ и питания; новообразования (доброкачественные, злокачественные и неуточненные); нарушения опорно-двигательного аппарата и соединительной ткани; общие расстройства; состояние в месте введения; заболевания глаз; расстройства нервной системы; сосудистые расстройства; эндокринные, репродуктивные и молочные расстройства; заболевания крови и лимфатической системы; нарушения слуха и лабиринта [12, 13, 19, 22].
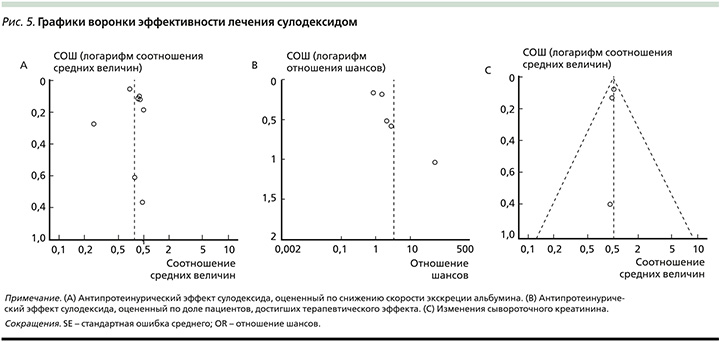
Ошибка публикации и анализ чувствительности
Анализ чувствительности проводился методом последовательного удаления одного исследования за 1 раз. Объединенное соотношение средних и ОШ существенно не изменилось, что указывает на стабильность результатов данного мета-анализа. Симметричные графики воронки подтверждают отсутствие предвзятости публикаций, включенных в мета-анализ эффективности лечения сулодексидом (рис. 5) [1].
Обсуждение
ДН встречается у 20–40% больных СД и является основной причиной заболеваемости и смертности пациентов с СД1 и 2 [27]. Самым ранним клиническим признаком нефропатии является нарастание микроальбуминурии (более 30 мг/с) до макроальбуминурии (более 300 мг/с) [28–30]. Клинические исследования показали медленное улучшение функции почек при использовании таких агентов, как ИАПФ и БРА, для блокирования ренин-ангиотензин-альдостероновой системы в сочетании с диуретиками и блокаторами кальциевых каналов [30]. По мере того, как исследователи получали более четкое представление о патофизиологических механизмах ДН, несколько новых терапевтических агентов подвергнуты клиническим испытаниям, включая моноклональные антитела к трансформирующему фактору роста β (TGF-β) [31] и моноклональные антитела к фактору роста соединительной ткани (CTGF) [32].
ГАГ могут изменять толщину и анионные заряды ГБМ, таким образом влияя на ее проницаемость [33, 34]. Снижение состава ГАГ в ГБМ, особенно в гепаринсульфате, связано с диабетической болезнью почек. Потеря целостности ГБМ может быть причиной трансформации микро- в макроальбуминурию и в протеинурию и ускорить прогрессирование ТПН [35]. Сулодексид представляет собой экстракт ГАГ легких и печени свиньи, и его основными компонентами являются низкомолекулярный гепарин и дерматансульфат [36]. Многие предварительные данные показали, что пероральный прием сулодексида способен снижать экскрецию оксида алюминия с мочой пациентов с СД [37–42]. Однако в двух крупных рандомизированных двойных слепых плацебо-контролируемых исследованиях под руководством Lewis et al. у пациентов с СД, микро- и макроальбуминурией сулодексид не снижал экскреции альбумина с мочой по сравнению с плацебо [12, 13]. Таким образом, от терапии сулодексидом ДН рекомендовано отказаться [43].
Gambaro [24] и Cocceri [44] также исследовали влияние сулодексида на ДН и не согласились с выводами Lewis et al. Они объясняли отрицательные результаты, полученные Lewis et al., тем, что, во-первых, препарат, использованный в исследовании совместной исследовательской группы Lewis et al. [12], протестирован только на активность гепариновой фракции без учета дерматансульфата, который составляет пятую часть активных ингредиентов препарата. Во-вторых, лечение максимальными дозами сопутствующих препаратов, таких как ИАПФ и БРА, почти не учитывало наложенный эффект сулодексида. В-третьих, у пациентов, включенных в Collaborative Study Group, была более тяжелая форма ДН, чем в предыдущих исследованиях. Настоящий мета-анализ показал, что терапия сулодексидом может значительно как снижать экскрецию белка с мочой (рис. 2), так и увеличивать долю пациентов, достигших терапевтического успеха (рис. 3) [1].
Сулодексид может оказывать нефропротективный эффект путем восстановления ионной селективности ГБМ и ее проницаемости, но точный механизм до сих пор неясен. Предполагают, что сулодексид снижает протеинурию и улучшает функцию почек посредством ингибирования протеинкиназы С-β III (PKC-βIII), киназы, регулируемой внеклеточным сигналом, фактора роста фибробластов-2 (FGF-2) и гепараназы-1, предотвращая эпителиально-мезенхимальный переход [45, 46]. Другой предполагаемый механизм не зависит от селективности проницаемости ГБМ, при котором сулодексид улучшает эндотелиальную дисфункцию за счет снижения уровня фактора роста эндотелия сосудов [47–49].
Заключение
Таким образом, результаты данного мета-анализа и как клинических исследований и экспериментальных работ можно рассматривать как основание для продолжения изучения нефропротективных эффектов сулодексида и его применения в клинической практике.



