На 7-ом Международном симпозиуме «Диабет, гипертония, метаболический синдром и беременность» (The 7th Internetional DIP Symposium on Diabetes, Hypertension, Metabolic Syndrome, and Pregnancy) в марте 2007 г., были представлены данные о росте распространенности сахарного диабета (СД) у беременных женщин и более высоком уровне неонатальной заболеваемости и перинатальной смертности у женщин с различными формами СД по сравнению со всей популяцией. Эксперты констатировали, что цели Сент-Винсентской декларации 1989 г. [1], провозгласившей необходимость достижения благополучного вынашивания беременности женщинами с СД, аналогичного здоровым, до сих пор не достигнуты. В докладах по инсулинотерапии было отмечено, что на сегодняшний день накоплено не так много доказательств преимущества использования аналогов инсулина во время беременности, однако своевременное их применение может сыграть значимую роль в достижении целей Сент-Винсентской декларации [2]. Эти обстоятельства подчеркивают актуальность обсуждения возможностей применения современных инсулинов для лечения СД при беременности.
Инсулинотерапия служит основой терапии СД 1 типа (СД1) у беременных женщин, а также гестационного сахарного диабета (ГСД) и СД2 во время беременности, когда компенсации углеводного обмена и профилактики осложнений не удается достигнуть путем соблюдения диеты и модификации физической активности. Наибольший опыт применения во время беременности имеют препараты человеческих инсулинов, использование которых улучшает прогноз как для матери, так и для плода и новорожденного [3].
Доказанные преимущества аналогов инсулина в отношении улучшения гликемии натощак (при использовании базальных аналогов инсулина), постпрандиальной гликемии (при использовании аналогов инсулина ультракороткого действия), гликированного гемоглобина (HbA1c) при меньшем риске гипогликемий по сравнению с человеческими инсулинами [4] создали предпосылки к их использованию в отношении беременных женщин. В результате тщательной оценки эффективности и безопасности аналогов инсулина некоторые из них были одобрены к использованию при беременности: инсулин аспарт (НовоРапид), детемир (Левемир). Оба, согласно FDA (Food and Drug Administration), относятся к категории безопасности В.
Гипергликемия и прогноз беременности
Контроль углеводного обмена при беременности ассоциирован со снижением риска материнских, фетальных и неонатальных осложнений [5]. Принципиальными особенностями гликемического контроля во время беременности являются безупречный контроль гликемии уже в I триместре, в дальнейшем поддерживаемый на протяжении всей беременности, максимально приближенный к нормальным значениям уровень HbA1c при минимальном риске гипогликемий.
Гипергликемия в I триместре представляет наибольшую опасность в отношении невынашивания беременности [6–8] и формирования пороков развития плода, частота которых в группе беременных с СД1 в 2–10 раз превышает общепопуляционные значения [9–11]. Риски этих событий зависят от выраженности гипергликемии [12, 13] и значительно возрастают уже при уровне HbA1c, превышающем на 3 стандартных отклонения (СО) и более уровень HbA1c у здоровых женщин (>6,3%) [14–18].
После 12-й недели гестации гипергликемия приводит к гиперинсулинемии плода, его ускоренному росту и увеличению количества жировой ткани. Макросомия (масса тела новорожденного >4000–4500 г) развивается у 27–62% беременных женщин с СД, что в 3–6 раз чаще, чем у женщин без СД, у которых частота развития крупного плода составляет примерно 10% [19]. Макросомия в свою очередь ассоциируется с увеличением частоты оперативных родов и акушерского травматизма, антенатальной гибели плода, неонатальных осложнений, включая гипогликемию, гипертрофическую кардиомиопатию, полицитемию, гипербилирубинемию [14]. Долгосрочные наблюдения за детьми, рожденными от матерей с декомпенсацией углеводного обмена во время беременности, свидетельствуют о более частом развитии у них интеллектуальных и психомоторных нарушений [14]. Макросомия и фетальная гиперинсулинемия увеличивают риск ожирения и нарушений углеводного обмена в течение последующей жизни [14, 20].
Достижение целевых значений гликемии во время беременности – трудновыполнимая задача. Добиться стабильной эугликемии удается только 40–60% женщин с прегестационным СД, что объясняется наличием во время беременности дополнительных факторов, препятствующих обеспечению уровня инсулинемии, соответствующего уровню гликемии. К этим факторам относятся постоянно изменяющаяся потребность в инсулине; снижение чувствительности к инсулину в результате физиологического гиперкортизолизма, физиологической гиперпролактинемии, увеличения массы жировой ткани, увеличения активности плацентарной инсулиназы (что в свою очередь способствует значительному уменьшению периода полувыведения препаратов инсулина, а также необходимости увеличения частоты инъекций базального инсулина); нарушение распознавания гипогликемий; явления токсикоза, способствующие несоответствию дозы введенного инсулина короткого/ультракороткого действия и потребляемых углеводов [21].
Сахарный диабет и фетальное программирование
Согласно данным Датского когортного исследования, целью которого было наблюдение до 30-летнего возраста за детьми (n=1 781 576) [22], рожденными от матерей с прегестационным СД2, выявлено значительное увеличение риска злокачественных новообразований (относительный риск [ОР]=2,2, 95% доверительный интервал [ДИ – 1,5–3,2). В то же время у детей, рожденных женщинами с прегестационным СД1, отмечен повышенный риск развития сердечно-сосудистых заболеваний (ОР=2,2, 95% ДИ – 1,6–3,0) и СД2 (ОР=1,4, 95% ДИ – 1,1–1,7), ГСД (ОР=1,3, 95% ДИ – 1,1–1,6).
Результаты крупных исследований свидетельствуют, что большая масса тела новорожденного, часто являющаяся следствием СД у матери, увеличивает риски онкологических заболеваний: рака молочной железы [23], рака простаты [24], колоректального рака [25], рака эндометрия [26], астроцитом [27–29], острого лимфобластного лейкоза и миелолейкоза, причем в большей степени в детском возрасте [30].
 Уже в раннем возрасте дети, рожденные от матерей с СД, имеют более выраженную инсулинорезистентность и более высокие кардиометаболические риски [31, 32]. Результаты длительного наблюдения показали положительную корреляцию уровня гликемии на протяжении беременности у матери с СД1 и значениями гликемии натощак, индекса массы тела, систолического артериального давления у их детей во взрослом возрасте [33]. Итак, можно предположить, что гипергликемия матери оказывает особый внутриутробный «отпечаток» (imprinting) на их детей. То есть имеет место комплексный вклад фетального программирования и генетических факторов в формирование различных патологических состояний в будущем у детей, рожденных от матерей, страдавших СД. В подобной ситуации важно учитывать любые детали, способствующие адекватному контролю СД во время беременности.
Уже в раннем возрасте дети, рожденные от матерей с СД, имеют более выраженную инсулинорезистентность и более высокие кардиометаболические риски [31, 32]. Результаты длительного наблюдения показали положительную корреляцию уровня гликемии на протяжении беременности у матери с СД1 и значениями гликемии натощак, индекса массы тела, систолического артериального давления у их детей во взрослом возрасте [33]. Итак, можно предположить, что гипергликемия матери оказывает особый внутриутробный «отпечаток» (imprinting) на их детей. То есть имеет место комплексный вклад фетального программирования и генетических факторов в формирование различных патологических состояний в будущем у детей, рожденных от матерей, страдавших СД. В подобной ситуации важно учитывать любые детали, способствующие адекватному контролю СД во время беременности.
Вариабельность гликемии, риск гипогликемий и исходы беременности
В I триместре беременности глюкоза активно поглощается формирующейся плацентой и периферическими тканями, снижается уровень субстратов глюконеогенеза (в первую очередь аминокислот) и, соответственно, продукции глюкозы печенью, что приводит к снижению гликемии, особенно в утренние часы. Как следствие, потребность в инсулине снижается на 10–20% от исходной [34]. В результате этого частота тяжелых гипогликемий при СД1 в этот период может возрастать практически в 3 раза, а гипогликемических ком – более чем в 2 раза по сравнению с прегестационным периодом [35].
Установлены предикторы тяжелых гипогликемий в I триместре беременности: тяжелые гипогликемии до беременности, длительность СД более 10 лет, HbA1c<6,5%, суточная доза инсулина >1 ЕД/кг массы тела [35]. Развитию гипогликемий в I триместре беременности может также способствовать ранний токсикоз беременных и вынужденный отказ от адекватного потребления углеводов.
На этом фоне важно учитывать особенности фармакокинетики базальных инсулинов. Так, введение инсулина НПХ (нейтральный протамин Хагедорна) перед сном нередко является причиной ночных гипогликемий вследствие особенностей фармакокинетики этого инсулина, т.к. пик его действия приходится на 3–4 часа ночи. Кроме того, одним из главных препятствий на пути к достижению оптимального гликемического контроля нередко является вариабельность фармакокинетического и фармакодинамического профиля препаратов инсулина [36, 37]. Вариабельность абсорбции инсулина НПХ из области инъекции колеблется от 10 до 52%, что объясняет непредсказуемость его действия и повышение риска гипогликемий у беременных женщин [38].
Инсулин детемир (Левемир) характеризуется более медленной и плавной абсорбцией благодаря высокой способности к самоассоциации молекул в гексамеры в подкожно-жировой клетчатке и к обратимому связыванию с альбуминами крови через остаток миристиновой кислоты, присоединенной к лизину в положении В29 [39]. Поэтому инсулин детемир характеризуется более медленным началом действия, менее выраженным пиком действия и более продолжительным действием по сравнению с инсулином НПХ [40, 41].
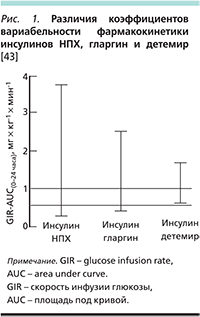
Фармакодинамические исследования показали, что при СД1 и СД2 инсулин детемир обладает значительно меньшей вариабельностью действия (на 21% и 41% ниже, чем инсулины гларгин и НПХ) [41–43] и как следствие – более предсказуемым сахароснижающим эффектом, чем другие базальные инсулины (рис. 1). Впоследствии меньшая вариабельность действия инсулина детемир была продемонстрирована в ряде клинических исследований пациентов с СД [44, 45].
Невысокая вариабельность абсорбции детемира лежит в основе меньшего риска гипогликемий по сравнению с инсулином НПХ [46]. В клинических исследованиях пациентов с СД1 и СД2 показано снижение общего числа гипогликемий и ночных гипогликемий при использовании детемира по сравнению с инсулином НПХ [47–49]. Большой практический интерес представляют данные исследования, проведенного с участием здоровых добровольцев, показавшего, что введение детемира сопровождается улучшением чувствительности и распознавания гипогликемий по сравнению с человеческим инсулином [50].
Кроме того, установлена связь вариабельности гликемии с автономным дисбалансом [51] и выраженностью оксидативного стресса [52] у пациентов с СД1 и СД2. Ранее было показано, что оксидативный стресс является ведущим звеном патогенеза обусловленных гипергликемией пороков развития у плода [53, 54], а также способствует увеличению частоты спонтанных абортов, привычного невынашивания беременности, преэклампсии, задержки внутриутробного роста плода [55]. Доказано также негативное влияние оксидативного стресса, обусловленного высокой вариабельностью гликемии, с риском микро- и макрососудистых осложнений СД [56, 57].
Следует также учитывать, что терапия с использованием аналогов инсулина способствует улучшению качества жизни, удовлетворенности пациентов лечением, повышению приверженности терапии [58], что имеет особое значение при лечении диабета у беременных женщин. Эксперты IDF (International Diabetes Federation) считают, что с учетом ограниченного опыта использования аналогов инсулина решение о выборе препарата инсулина во время беременности должно быть согласовано с самой пациенткой, принимая во внимание возможность достижения лучшей компенсации углеводного обмена при их применении [59].
Влияние детемира на массу тела
Контроль массы тела при планировании беременности и ее ведении у пациенток с СД особенно важны. Ожирение у матери повышает риск пороков развития плода [60, 61], а также ассоциировано с повышенным риском неблагоприятных исходов беременности, включая артериальную гипертензию, преэклампсию, ГСД, потребность в индуцировании родов, кесарева сечения, мертворождений, перинатальной смертности, макросомии, преждевременных родов, ожирения у ребенка и возникновения СД2 у потомков [61, 62].
Установлено, что до трети беременных женщин имеют избыточную прибавку массы тела за время беременности [63]. Прибавка массы тела более 16 кг за беременность у пациенток с ГСД, получающих инсулинотерапию, может увеличивать риск большого плода для данного гестационного возраста в 6 раз [64]. При этом прибавка массы тела в I триместре в большей степени определяет конечную массу тела плода, чем прибавка в III триместре. Так, увеличение массы тела на каждый 1 кг в I триместре увеличивает прибавку массы тела плода на 31 г (р<0,0007), во II триместре – на 26 г (р<0,007), а в III триместре не оказывает статистически значимого влияния на массу тела плода [65]. В целом сочетание СД и ожирения во время беременности вносит значительный вклад в фетальное программирование, приводящее к негативным последствиям в последующих поколениях (рис. 2).
Несмотря на негативное влияние ожирения на течение и исходы беременности, беременным женщинам не рекомендованы диеты, направленные на уменьшение массы тела. В то же время у беременных женщин с ГСД и избыточной массой тела снижение калорийности рациона до 30% от привычного потребления [66] не приводит к развитию кетоза и не оказывает какого-либо негативного влияния [67]. Согласно данным Кокрановского систематического обзора клинических исследований, соблюдение диеты способствует уменьшению прибавки массы тела во время беременности (в среднем на 1,92 кг; р=0,03) и риска кесарева сечения (ОР=0,75; 95% ДИ – 0,60–0,94; p=0,013). При этом соблюдение диеты значимо не влияет на массу тела новорожденных, риск преэклампсии, ГСД, преждевременные роды [68].
Традиционно улучшение гликемического контроля на фоне инсулинотерапии ассоциируется с увеличением массы тела [69]. Отсутствие негативного влияния на динамику массы тела при СД1 [48, 70] и менее выраженная тенденция к прибавке массы тела у пациентов с СД2 [49, 7] на фоне терапии инсулином детемир могут иметь дополнительные преимущества в отношении прогноза при лечении СД на фоне беременности.
Подобное влияние инсулина детемир (Левемир) на массу тела может быть обусловлено его центральным влиянием, а также способностью участвовать в регуляции чувства голода и насыщения в центральной нервной системе, снижением риска гипогликемий, большей гепатоселективностью, более низким липотропизмом и способностью снижать инкретиновую дисфункцию через повышение секреции глюкагоноподобного пептида-1 [72–75]. Эти результаты, полученные при анализе данных больных диабетом вне беременности, позволяют предполагать новые дополнительные возможности в терапии пациенток, испытывающих трудности в контроле прибавки массы тела во время беременности.
Особенности подходов к инсулинотерапии ГСД
Распространенность ГСД продолжает расти во всем мире. Исследование HAPO (Hyperglycemia and Adverse Pregnancy Outcome), одного из крупнейших исследований в истории акушерства [76], показало, что риски неблагоприятных исходов беременности возрастают даже при минимально выраженной впервые возникшей гипергликемии. На основании результатов данного исследования, эксперты IADPSG (International Association of the Diabetes and Pregnancy Study Groups), а также Российской ассоциации эндокринологов и Российской ассоциации акушеров-гинекологов приняли новые критерии диагностики ГСД и целей самоконтроля [77, 78]. В соответствии с ними для минимизации риска неблагоприятных исходов беременности необходимо стремиться к поддержанию гликемии натощак и перед приемами пищи от 3,3 до 5,1 ммоль/л и до 7,0 ммоль/л через час после приемов пищи.
Характерной особенностью ГСД является ведущий вклад инсулинорезистентности в патогенез гипергликемии, для преодоления которой в ряде случаев требуется использование высоких доз экзогенного инсулина, что сопровождается увеличением риска гипогликемий.
При наличии у беременной женщины с ГСД потребности в прандиальной коррекции гликемии базис-болюсный режим инсулинотерапии доказал преимущества по сравнению с использованием готовых смесей инсулина и инсулина короткого действия как в отношении достижения лучшего метаболического контроля, так и исходов беременности [79].
При проведении инсулинотерапии ГСД достижение стабильных показателей гликемии в узком терапевтическом диапазоне диктует необходимость выбора препаратов со стабильным фармакокинетическим и фармакодинамическим профилем, слабо выраженным пиком действия при минимальном риске гипогликемий и отсутствии негативного влияния на массу тела.
Использование детемира во время беременности: взгляд с позиций доказательной медицины
Первые публикации о результатах ретроспективного анализа случаев применения детемира (инсулина Левемир) при беременности появились в 2009–2010 гг. Была продемонстрирована удовлетворительная безопасность детемира для матери и плода при наблюдении за 11 пациентками с СД1 [80, 81]. Ранее было показано более низкое сродство детемира к рецептору инсулиноподобного фактора роста-1 (ИФР-1) и, соответственно, более низкий митогенный потенциал по сравнению с человеческим инсулином [82]. Это позволило предположить его безопасность в отношении тератогенеза, что подтвердили результаты недавно опубликованного клинического исследования с участием 470 женщин с СД1 [83].
В отличие от гларгина детемир (Левемир) изучался у беременных женщин с СД1 в специально спланированном проспективном рандомизированном исследовании, в котором сравнивали эффективность и безопасность применения инсулина детемир и НПХ (оба в комбинации с инсулином аспарт) (n=310) [84]. Рандомизация проведена в течение 12 месяцев до зачатия (48%) или на 8–12-й неделях беременности (52%).
Результаты исследования показали, что при лечении СД1 у беременных инсулин детемир не уступает инсулину НПХ по степени достигнутой компенсации углеводного обмена. Уровень HbA1c на 36-й неделе беременности (первичная конечная точка) в группах терапии детемиром и НПХ значимо не различался (6,27 и 6,33% соответственно). При этом уровень гликемии натощак был значительно ниже в группе детемира как на 24-й (5,4 против 6,3 ммоль/л; р=0,012), так и на 36-й неделях беременности (4,8 против 5,4 ммоль/л; р=0,017) при сравнимой частоте легких и тяжелых гипогликемий.
Последующий анализ влияния терапии детемиром (инсулином Левемир) и НПХ на исходы беременности показал отсутствие достоверных различий в частоте развития неблагоприятных исходов беременности для матери и плода (в т.ч. формирования пороков развития) при использовании инсулинов детемир и НПХ [83]. У 8 новорожденных каждой группы были выявлены врожденные пороки развития [5,6% (n=8/142) на детемире и 5,5% (n=8/145) на НПХ]. Частота развития других побочных эффектов также существенно не различалась в группах лечения.
В группе детемира и НПХ были 128 и 136 живорожденнных детей, 11 и 9 ранних самопроизвольных абортов, 1 и 2 случая перинатальной смерти соответственно. Не было получено достоверных различий в отношении исходов беременностей, частоте самопроизвольных абортов, частоте развития преэклампсии, пороков развития, макросомии плода, преждевременных родов, мертворождений, перинатальной смертности, неонатальной гипогликемии. Родоразрешение было достоверно на более позднем гестационном сроке в группе детемира по сравнению с НПХ: 38,2 против 37,8 недели соответственно, различие – на 0,49 недели (95% ДИ 0,11–0,88; p=0,012). Схожие результаты в отношении родоразрешения женщин на более позднем сроке гестации были получены также в исследовании, сравнивавшем терапию СД1 во время беременности другим аналогом инсулина аспарта по сравнению с человеческим инсулином короткого действия [85], что предполагает достижение большей зрелости плода на момент родов.
Исследование E.R. Mathiesen и соавт. убедительно продемонстрировало, что терапия детемиром (инсулином Левемир), инициированная на этапе планирования беременности, позволяет достигать более низких уровней гликемии натощак и HbA1c без увеличения риска гипогликемий [84]. Эти показатели чрезвычайно важны для снижения риска неблагоприятных исходов беременности. Таким образом, в настоящее время имеется достаточно доказательств того, что инсулин детемир (Левемир) имеет подтвержденные исследованиями клинические преимущества перед другими базальными инсулинами при лечении диабета у беременных женщин, и у практикующего врача нет объективных оснований для ограничения его применения или замены на инсулин НПХ во время беременности.
Заключение
Результаты исследования HAPO, получившего всемирную известность [76], наглядно обозначили континуум связи впервые возникшей гипергликемии с риском развития неблагоприятных исходов беременности. Также не вызывает сомнений ассоциаация между степенью нарушения углеводного обмена при прегестационном СД с риском пороков развития, невынашивания беременности и макросомии плода [7, 18, 86].
В то же время достижение околонормальных значений гликемии во время беременности представляется чрезвычайно сложной задачей, часто остающейся нерешенной, особенно при СД1. В частности, имеются сложности при имитации физиологического профиля базальной и прандиальной секреции инсулина, необходимых для поддержания стабильных значений гликемии, не решена проблема гипогликемий. Ограничены доказательства, позволяющие установить «золотой» стандарт в инсулинотерапии прегестационного СД во время беременности.
Рассмотренные в настоящем обзоре преимущества инсулина детемир (Левемир) в реальной клинической практике могут оказаться значимыми при выборе базального инсулина для лечения СД во время беременности. Улучшенные фармакокинетический и фармакодинамический профили детемира (в т.ч. слабо выраженная вариабельность действия), а также результаты клинических исследований у пациентов с СД1 и СД2 вне беременности говорят о достижении лучшего контроля гликемии при более низком риске гипогликемий и нейтральном влиянии на массу тела. Клинические преимущества детемира (инсулина Левемир) были подтверждены в исследованиях у беременных пациенток с СД. Эти данные послужили основанием к пересмотру и изменению категории безопасности инсулина детемир (Левемир) во время беременности с С на В (согласно FDA) и внесению изменений в информацию по его медицинскому применению с расширением показаний к использованию детемира в отношении беременных женщин (Инструкция по применению препарата ЛевемирФлексПен® для специалистов. Доступна на: http://www.vidal.ru/poisk_preparatov/levemir-flexpen.htm).
Все вышесказанное является весомым аргументом в пользу предпочтительности использования детемира (инсулина Левемир) как на этапе планирования беременности для достижения целевых значений гликемического контроля и околонормального уровня HbA1c, так и во время беременности, что способно приводить к снижению рисков врожденных пороков развития и невынашивания беременности.


