Рак молочной железы (РМЖ) – социально значимое заболевание, лидирующее в структуре онкологической заболеваемости и смертности женщин не только в Российской Федерации, но и практически во всех странах [1]. Во всем мире продолжаются исследования значения биологических характеристик опухоли (включая иммуногистохимические и молекулярно-генетические параметры) в предсказании чувствительности к конкретному виду системного лечения раннего (операбельного), местно-распространенного (условно-операбельного) и метастатического (диссеминированного) РМЖ. Важной особенностью РМЖ является его биологическая гетерогенность в пределах одного гистологического типа и стадии заболевания. Нередко остается неясным, какой вид системной терапии (химио- [ХТ], эндокрино-, таргетная терапия) является предпочтительным для каждого конкретного больного.
Открытие рецепторов эстрогенов в 1970-х гг. и клонирование гомолога рецептора эпидермального фактора роста (HER2) в 1980-е стали ключевыми этапами бурного развития биологически направленной терапии рака РМЖ в «эру таргетной терапии». Открытие РМЖ-ассоциированных супрессорных генов BRCA1 и BRCA2 – главное достижение молекулярной биологии в 1990-х гг. На долю этих мутаций приходится до 5–10 % РМЖ. Гены BRCA1 или BRCA2 кодируют белки, играющие ключевую роль в репарации двухцепочных разрывов ДНК посредством механизма гомологичных рекомбинаций. Предполагается выраженная уязвимость BRCA-ассоциированного РМЖ по отношению к ДНК-повреждающим агентам. При этом детекция мутаций BRCA1 и BRCA2 все еще остается трудоемким процессом, требующим секвенирования всей кодирующей последовательности упомянутых генов, а лечение больных BRCA1-ассоциированным РМЖ по-прежнему вызывает много вопросов [2].
На сегодняшний день отсутствуют абсолютные признаки чувствительности РМЖ к основным цитостатикам: антрациклиновым антибиотикам и таксанам. Данные, полученные в клинических исследованиях по изучению экспериментальных предиктивных маркеров к этим препаратам, – TOP2α (топоизомераза 2α), β-тубулина типа III (субъединица димерного белка тубулина) и BRCA1 (breast cancer 1) – противоречивы и требуют продолжения изучения [3]. Дальнейший прогресс молекулярной генетики позволил детализировать биологические характеристики РМЖ и выделить ряд генетических подтипов: люминальный А и В, HER2-экспрессирующий, базально- и нормоподобный РМЖ; для каждого из этих подтипов имеются иммуногистохимические «суррогатные» аналоги [4, 5].
Если рассматривать РМЖ как единообразное заболевание, отличающееся лишь по стадии опухоли, гистологическому типу и возрасту больной без относительно биологических признаков (экспрессия гормональных рецепторов, HER2, степень злокачественности, Ki-67), выбор адекватного системного лечения становится случайным.
В поиске путей, ускоряющих внедрение новых более эффективных лекарственных средств и режимов, чрезвычайно важным оказалась предоперационная (неоадъювантная) их оценка. Еще 15–20 лет назад перед неоадъювантной ХТ ставились две задачи: неоперабельные (местно-распространенные опухоли) превратить в операбельные посредством «снижения» стадии; сравнить сверхраннее начало ХТ (до операции) с адъювантной (послеоперационной) терапией с целью улучшить показатели выживаемости. Вторая задача оказалась невыполнимой, т. к. при операбельных опухолях сроки начала адъювантной системной терапии и, соответственно, сроки хирургического вмешательства не имеют существенного прогностического значения, если они не выходят за рамки 6 месяцев [6].
Сейчас наблюдается возврат к неоадъювантным клиническим испытаниям, включающим небольшое число больных с малыми сроками проведения, что имеет несомненное преимущество перед многолетними (5 и более лет) адъювантными испытаниями, включающими тысячи больных. Не отрицая их практического значения (более частое выполнение органосохраняющих операций), основная цель современных неоадъювантных испытаний заключается в том, чтобы найти те «промежуточные» (суррогатные) маркеры, которые бы предсказывали улучшение показателей выживаемости при исследовании нового вида системного лечения (препарата, режима и т. п.).

В этом смысле особое значение приобретают биологические характеристики опухоли (экспрессия гормональных рецепторов, HER2, гистологическая степень злокачественности, маркер пролиферации Ki-67), определяющие многообразие (гетерогенность) заболевания по клиническому течению и прогнозу.
Неоадъювантная ХТ становится все более широко применяемым методом системной терапии РМЖ [7]. При этом полный патоморфологический ответ (pCR) на неоадъювантное системное лечение считается «суррогатным» маркером улучшения показателей выживаемости больных потенциально операбельным местно-распространенным РМЖ. В 2011 г. X. Kong предоставил результаты мета-анализа 16 исследований, которые подтвердили, что pCR (pT0/is pN0) является благоприятным прогностическим индикатором для безрецидивной выживаемости [8]. Аналогичные выводы были сделаны и в других обобщающих работах [9–11]. Однако до сих пор общепринятые стандарты неоадъювантной ХТ отсутствуют. Например, остается дискутабельной целесообразность проведения предоперационной ХТ больным местно-распространенным РМЖ с высокой экспрессией рецепторов стероидных гормонов.
В исследование III фазы «Таксаны в комбинации с антрациклинами (ТАС) и без антрациклинов (ТС) в неоадъювантном лечении больных местно-распространенным РМЖ» (рис. 1), проведенном в НИИ онкологии им. Н.Н. Петрова (с 2010 по 2013 г.), 120 больных рандомизировались в соотношении 1 : 1 на получение поли-ХТ по схеме ТАС или ТС. По различным причинам 14 (11,7 %) больных не завершили исследование, в связи с чем дальнейшему анализу подлежали только 106 больных.
Первичным критерием оценки был анализ непосредственных результатов неоадъювантной ХТ (частоты клинических ответов и главное – степени патоморфологического регресса опухоли и регионарных метастазов). Вторичные критерии включали оценку предиктивного значения молекулярных маркеров (стандартных и экспериментальных) и методов получения изображения (маммосцинтиграфии и соноэластографии) в мониторинге эффективности системного неоадъювантного лечения.
Материал и методы
Перед включением в исследование больные подписывали информированное согласие на основе ознакомления с условиями его проведения. Протокол клинического испытания был одобрен этическим комитетом ФГБУ «НИИ онкологии им. Н.Н. Петрова» Минздрава России. Основные критерии включения больных в исследование включали возраст женщин не менее 18 лет включительно; гистологически подтвержденный местно-распространенный РМЖ (со стадией T1 и N2-3 или T2-4 с любым N и M0); функциональный статус по ECOG 1–2; отсутствие выраженных отклонений в гематологических и биохимических показателях; исходное значение фракции выброса левого желудочка 50 % и более по результатам оценки при помощи эхокардиографии.
Всем больным выполнены следующие исследования: на этапе скрининга – компьютерная томография органов грудной и брюшной полости, остео-сцинтиграфия; до начала лечения, в процессе лечения (каждые 2 цикла) и перед операцией – ультразвуковое исследование (УЗИ) молочных желез с эластографией, маммография и маммосцинтиграфия с Технетрилом-99mTc, кардиологический мониторинг (включая фракцию выброса левого желудочка), консультация гинеколога, УЗИ и магнитно-резонансная томография малого таза по показаниям. Объективный эффект проводимого лечения регистрировался каждые 2 цикла в соответствии с критериями RECIST 1.1. Распространенность заболевания в исследовании определена согласно международной классификации по системе TNM (7 Edition AJCC, 2006).
Все больные имели гистологически верифицированный РМЖ. Исследование опухоли проводилось дважды: на этапе скрининга и по завершении предоперационной химиотерапии. Оценка экспрессии эстрогеновых (ЭР) и прогестероновых рецепторов (ПР) выполнена полуколичественным иммуногистохимическим методом (Allred scoring system).
Экспрессия HER2 считалась позитивной при иммуногистохимической оценке 3+ либо 2+ c последующим подтверждением методом флюоресцентной гибридизации in situ (FISH). Изучение степени злокачественности опухоли выполнено по Ellis–Elston: I степень злокачественности − низкая, соответствовала опухоли с суммарной оценкой 3–5 баллов; II – промежуточная (умеренная), 6–7 баллов; III степень злокачественности – высокая, 8–9 баллов.
Детекция экспрессии генов TOP2A и β-тубулина типа III проведена методом полуколичественной полимеразной цепной реакции (ПЦР) в реальном времени с использованием TaqMan-проб. Данный метод признан как наиболее точный и хорошо воспроизводимый в условиях большинства лабораторий современных клиник и доступный по стоимости. Основным требованием к исследуемому материалу было наличие в образце более 80 % опухолевых клеток. С учетом этого условия использование определенного метода обработки срезов с парафиновых блоков путем микродиссекции с последующим проведением количественной ПЦР позволяет определять уровень экспрессии генов метаболизма с высокой точностью. Оценка уровня экспрессии генов в образцах кДНК проводилась на основании построения относительной стандартной кривой количества копий таргетного гена по соотношению с референсным геном (SDHA – GenBank: NM_004168). Уровень экспрессии генов оценивался путем вычисления разности между пороговыми циклами амплификации гена мишени и гена-рефери. Таким образом, чем меньшим было значение гена-рефери, тем более высоко оценивалась экспрессия маркера. Классификация экспрессии мутации генов по уровням (высокий, низкий, средний) производилась на основании пороговых значений гена-рефери, разработанных лабораторией молекулярной онкологии ФГБУ «НИИ онкологии им. Н.Н. Петрова» Минздрава РФ.
Анализ наличия мутаций в гене BRCA1 проведен методом аллель-специфической ПЦР в режиме реального времени с использованием флуоресцентного красителя SYBRGreenI и термоциклера iCycleriQRealTimeDetectionSystem (Bio-Rad). Генотипирование каждого образца методом аллель-специфической ПЦР требовало постановки двух ПЦР-реакций одновременно в разных пробирках. В первой пробирке добавлялся общий праймер и праймер, специфичный к аллелю дикого типа, во второй – тот же общий праймер и праймер, специфичный к мутантному аллелю. Определение генотипа было основано на разнице пороговых циклов. В случае нормальной гомозиготы амплификация происходит преимущественно в первой пробирке (содержащей пару праймеров, специфичных к нормальной последовательности) и ∆Ct составляет не менее 7–10 циклов. В случае гетерозиготы эффективность амплификации с обеими парами праймеров одинакова, и ∆Ct составляет не более 1–2 циклов. При наличии в исследуемом образце потери аллеля дикого типа реакция проходит преимущественно во второй пробирке и кривые амплификации принимают положение, обратное случаям с нормальной гомозиготой.
Степень лечебного патоморфоза опухоли оценивалась по критериям классификации I. Miller, S. Payne [12]:
- I степень (ответ отсутствует) – малозаметные изменения отдельных опухолевых клеток, но без уменьшения их числа;
- II степень (ответ отсутствует) – незначительное уменьшение количества опухолевых клеток, но в целом клеточность остается высокой (до 30 %);
- III степень (частичный патоморфологический ответ) – расчетное снижение опухолевых клеток до 90 %;
- IV степень (частичный патоморфологический ответ) – выраженное исчезновение опухолевых клеток более 90 %, определяются лишь широко рассеянные небольшие гнезда клеток;
- V степень (полный патоморфологический ответ [pCR]) – нет опухолевых клеток в секционных срезах из места расположения первичной опухоли, может присутствовать протоковая карцинома in situ.
Больные относительно операбельными формами РМЖ в соответствии с рандомизацией в первой группе получали 4–8 (в среднем 4,6) циклов ХТ по схеме ТАС (доцетаксел 75 мг/м2, доксорубицин 60 мг/м2, циклофосфамид 600 мг/м2) 1 раз в 3 недели; во второй – 4–8 (в среднем 4,9) циклов ХТ по схеме ТС (доцетаксел 75 мг/м2, циклофосфамид 600 мг/м2) 1 раз в 3 недели на фоне стандартной пре- и постмедикации дексаметазоном. Больным HER2+ РМЖ одновременно с полихимиотерапией назначалась таргетная терапия трастузумабом в стандартных дозах.
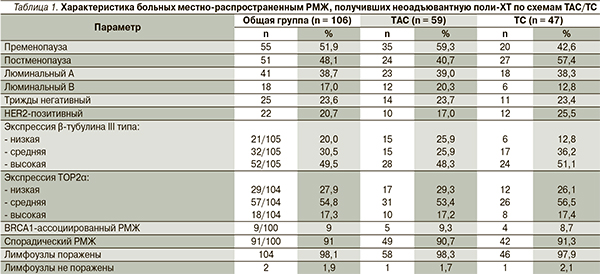
В случае отсутствия объективного ответа (полного или частичного регресса) на фоне ХТ по схеме ТС больные переводились в группу ТАС (cross-over). Всего больным был проведен 501 цикл полихимиотерапии. Общая характеристика больных представлена в табл. 1.
Результаты
Анализ частоты объективных ответов опухоли на проведенную ХТ показал статистически достоверное преимущество схемы ТАС перед схемой ТС (80,0 против 74,5 %; р < 0,05). Основной целью данного неоадъювантного лечения стало достижение полного патоморфологического регресса первичной опухоли и регионарных метастазов (pCR), имея в виду его роль суррогатного (предиктивного) маркера улучшения показателей выживаемости. Доказанный микроскопическим исследованием операционного препарата полный регресс опухоли (pСR) косвенно свидетельствовал о мощном цитотоксическом воздействии не только на первичную опухоль, но и на скрытые отдаленные микрометастазы. Сравнительный анализ данных о частоте и степени pCR опухоли после неоадъювантной ХТ по схеме TAC по сравнению со схемой ТC представлен в табл. 2.
Из табл. 2 следует, что полный патоморфологический ответ (pT0 + pN0) наблюдался достоверно чаще в группе ТАС с учетом перехода из группы ТС в группу ТАС (cross-over) по сравнению со схемой ТC (р = 0,04). Значимый лекарственный патоморфоз на проводимое лечение (4 + 5-я ст. регресса по Miller–Payne) регистрировался в 2 раза чаще в группе ТАС против группы TC (39 против 19,1 %; p < 0,05). После проведения неоадъювантной ХТ по схемам ТАС и ТС все неоперабельные опухоли стали операбельными, при этом 11,3 и 8,5 % больных, соответственно, удалось выполнить органосохраняющие операции.
В целом анализ токсического профиля двух изучаемых комбинаций не выявил значимых различий за исключением более частой фебрильной нейтропении в группе ТАС (р = 0,016).
В группе ТАС по сравнению с группой ТС после 4–8 циклов отсутствовала выраженная кардиотоксичность (снижение контрактильной функции миокарда, подтвержденное эхографией и проявляющееся снижением фракции выброса левого желудочка более чем на 10 % ниже нормы или на 20 % ниже исходной). В целом же риск кардиотоксичности возрастал при превышении кумулятивных доз для доксорубицина > 450 мг/м2, что очень важно помнить при продолжении применения антрациклиновых антибиотиков в адъювантном режиме.
С учетом патогенетического разнообразия РМЖ и уже доказанного существования нескольких молекулярно-генетических подтипов заболевания, отличающихся по прогнозу, несомненный интерес представляет оценка чувствительности к неоадъювантной ХТ различных биологических подтипов опухоли [13]. В нашем исследовании в группе больных с люминальным подтипом А значимый лекарственный патоморфоз (4–5-я ст. по Miller–Payne) был достигнут лишь 7 (17,1 %), в группе люминального подтипа В (HER2+) – в 27,8 % случаев, в группе трижды негативного РМЖ – в 36,0 % и в группе HER2+ (нелюминального) рака – половиной пациенток (p < 0,003). Как и ожидалось, частота значимого лекарственного патоморфоза в опухоли в ответ на ХТ была выше в группе трижды негативного и HER2+ РМЖ по сравнению с люминальными подтипами А и В (р < 0,005). Важно отметить значимые различия в достижении значимого патоморфологического ответа (4–5-я ст. по Miller–Payne) опухоли у больных люминальным В (ЭР+) и HER2+ РМЖ (27,8 против 50 %; p = 0,0001). По сравнению с группой больных люминальным А РМЖ отмечено дву-, трех- и четырехкратное увеличение частоты рCR в группах больных люминальным В, трижды негативным и HER2+ подтипами РМЖ (рис. 2).
Несколько исследований показали, что резистентность опухолевых клеток к препаратам, воздействующим на микротрубочки, обусловлена гиперэкспрессией β-тубулина типа III, что может снизить лечебный эффект таксанов [14–18].
Предиктивное значение β-тубулина типа III как маркера чувствительности опухоли к таксанам было изучено нами на 105 больных местно-распространенным РМЖ. В зависимости от выраженности экспрессии маркера в опухоли были сформированы 3 подгруппы больных: с низкой – 21 (20 %), средней – 32 (30,5 %) и высокой экспрессией – 52 (49,5%) пациентки. В каждой из подгрупп оценивался pCR и значимый лекарственный патоморфоз опухоли по Miller–Payne (4 + 5-я ст.) как критерии эффективности ХТ.
В подгруппе с низкой экспрессией β-тубулина типа III значимый лекарственный патоморфоз был достигнут 10 (47,6 %), в подгруппе со средней экспрессией – 7 (21,9 %) и в подгруппе с высокой экспрессией – 31 (26,9 %) больной (р < 0,005). Полный лекарственный патоморфоз (pCR) в группе больных с низкой экспрессией маркера также достигался достоверно чаще (23,8 против 12,5–15,4 % в группах со средней и высокой экспрессией; р < 0,03). Аналогичная корреляция между низким уровнем экспрессии β-тубулина типа III и эффективностью лечения была получена и при межгрупповом анализе групп ТАС/ТС. Таким образом, низкая экспрессия гена β-тубулина типа III в ткани РМЖ является достоверным предиктивным признаком достижения полного патоморфологического ответа (pCR) и значимого лекарственного патоморфоза в ответ на таксан-cодержащую ХТ.
Положительный результат при назначении антрациклинов более вероятен, когда в опухоли активирована мишень для препаратов этой группы – TOP2α: сложный белок, необходимый для процесса репликации. Антрациклиновые антибиотики связываются с TOP2α, образуя двухцепочные разрывы ДНК [19].
В ряде работ показано позитивное предиктивное значение высокой экспрессии TOP2α в отношении частоты объективных эффектов на ХТ, включающую антрациклиновые антибиотики [20–21]. Существует некоторое противоречие, обусловленное отсутствием прямой взаимосвязи амплификации гена ТОР2α и экспрессии белка [22]. Отсутствуют данные о значении гиперэкспрессии гена ТОР2α (установленной методом полуколичественной ПЦР) в качестве предиктивного фактора выраженного лекарственного патоморфоза на неоадъювантную антрациклин-содержащую ХТ. Предиктивное значение ТОР2α как маркера чувствительности опухоли к антрациклинам изучено на 58 больных местно-распространенным РМЖ. В зависимости от экспрессии ТОР2α в опухоли было сформировано 3 подгруппы больных: с низкой – 17 (29 %), средней– 31 (53%) и высокой экспрессией – 10 (18 %). У 2/3 больных ТОР2α -потенциальная мишень к антрациклиновым антибиотикам была активирована.
В подгруппе с низкой экспрессией ТОР2α-значимый лекарственный патоморфоз на ХТ с включением антрациклиновых антибиотиков был достигнут в 17,6 % случаев, в подгруппе со средней экспрессией – в 45,2 % и в подгруппе с высокой экспрессии – в 50 % (р < 0,05). Следовательно, высокая и средняя экспрессия ТОР2 в 2,6 и 2,8 раза повышает частоту значимого лекарственного патоморфоза по сравнению с низкой.
Анализ экспрессии ТОР2α в зависимости от биологического подтипа опухоли показал, что в группе больных HER2+ РМЖ данный маркер активирован в 84,9 % случаев, что свидетельствует о нередкой коамплификации генов HER2 и ТОР2α. Данные молекулярных исследований показали их близкое расположение, на основании чего было выдвинуто предположение, будто коамплификация ТОР2α и HER2 объясняет высокую эффективность антрациклинов у этих больных [23–24]. Отмечено 2,4-кратное увеличение частоты полного патоморфологического ответа на анти-HER2-таргетную терапию трастузумабом больных HER2+ РМЖ со средней экспрессией TOP2α по сравнению с низкой (60 и 25 % соответственно; p = 0,007).
В последнее время мутации генов наследственной предрасположенности придается все большее значение в планировании системной терапии. На долю мутаций BRCA1 или BRCA2 приходится большинство «семейных» РМЖ [25]. Гены BRCA1 или BRCA2 кодируют белки, играющие ключевую роль в репарации двухцепочных разрывов ДНК посредством механизма гомологичных рекомбинаций. Предполагается наибольшая уязвимость BRCA-ассоциированного РМЖ к ДНК-повреждающим алкилирующим агентам. Т. Byrski и соавт. (2008) выявили более низкие показатели ответа на неоадъювантную ХТ в подгруппе носителей BRCA1, получавших доцетаксел в комбинации с доксорубицином [26]. С другой стороны, в исследовании Р. Chappius и соавт. (2002) больные РМЖ – носители BRCA1/2 мутаций, получавшие антрациклин-содержащую комбинированную терапию и паклитаксел, достигли полного ответа (объективного и pCR) в 93 и 44 % случаев соответственно против 30 и 4 % в группе спорадического РМЖ [27]. Следует согласиться с мнением S. Schott и соавт. (2011), будто существующие исследования неоадъювантной и адъювантной ХТ у больных BRCA1/2-ассоциированным РМЖ в основном ретроспективные и по числу пациентов по-прежнему крайне малы [28]. Поэтому до сих пор в мировой практике нет специфических рекомендаций по оптимальному лечению носителей мутации BRCA1/2.
В нашем исследовании мутация BRCA1 выявлена у 9 из 100 больных (9 %). Средний возраст женщин равнялся 44 годам (от 32 до 68 лет). У всех больных BRCA1-ассоциированным РМЖ был отмечен наследственный анамнез по РМЖ или раку яичников. Спорадический (ненаследственный) местно-распространенный РМЖ был зарегистрирован среди остальных 91 % больных. Из 9 женщин с мутацией 5382insC в гене BRCA1 у пятерых диагностирован трижды негативный у 4 – люминальный А подтип РМЖ. Из них получали неоадъювантную ХТ по схеме ТАС 5, а по схеме ТС – 4 женщины.
В группе больных BRCA1-ассоциированным РМЖ объективный ответ (полный + частичный) на неоадъювантную таксан-содержащую ХТ был зарегистрирован в 8 (88,9 %) случаях. Полный клинический регресс имел место у 33,3 % женщин. Полный патоморфологический ответ (pCR) со стороны больных BRCA1-ассоциированным РМЖ был зарегистрирован в 44,4 % случаев, тогда как среди остальных больных спорадическим местно-распространенным РМЖ – только в 15,4 % (p < 0,05). Следовательно, от больных BRCA1-ассоциированным РМЖ можно получать ответ на таксан-содержащую терапию в 3 раза чаще, чем при спорадическом РМЖ. С учетом высокой эффективности неоадъювантной ХТ на основе таксанов у указанного контингента больных представляется оправданным продолжить скрининг на наличие мутации BRCA1 у всех пациенток с РМЖ.
В целом в ходе проведенной работы на большом клиническом материале достигнута цель исследования и выполнены поставленные задачи; на основе полученных результатов сформулированы следующие выводы.
Проспективное рандомизированное клиническое исследование эффективности неоадъювантной ХТ по схеме ТАС (доцетаксел + доксорубицин + циклофосфамид) против схемы ТС (доцетаксел + циклофосфамид) выявило значительное различие схем по частоте объективных клинических ответов (89,8 против 74,5 %; p < 0,05) и показателей патоморфологического полного ответа (22,0 против 10,6 %; р < 0,05).
Обнаружены достоверные отличия в частоте патоморфологических полных ответов опухоли и региональных лимфатических узлов (pCR) после завершения неоадъювантной таксан-содержащей ХТ (схемы ТАС и ТС) при различных биологических подтипах РМЖ. При люминальном подтипе А частота pCR составила 7,3 %, люминальном В – 16,7 %, трижды негативном – 24 %, HER2+ – 27,3 % (р < 0,05).
Низкий уровень экспрессии гена β-тубулина типа III РМЖ является достоверным предиктивным фактором полного патоморфологического ответа на таксан-содержащую ХТ 23,8 % больных против 12,5 и 15,4 % больных со средней и высокой экспрессией маркера (р < 0,05).
Высокий и средний уровни экспрессии гена ТОР2α повышают в 2,6 и 2,8 раза частоту значимого лекарственного патоморфоза (4 + 5-я ст. по Miller–Payne) по сравнению с низким уровнем его экспрессии (p < 0,05), что позволяет рассматривать ТОР2α в качестве предиктивного маркера чувствительности к антрациклиновым антибиотикам.
Мутация BRCA1 выявлена у 9 % больных: у 5 (55 %) из них с мутацией 5382insC в гене BRCA1 диагностирован трижды негативный и у 4 (45 %) – люминальный А-подтип РМЖ. Установлена высокая эффективность неоадъювантной ХТ по схемам ТАС и ТС больных BRCA1-ассоциированным РМЖ: общий объективный ответ (полный + частичный регресс) наблюдался у 8 (88,9 %), полный патоморфологический ответ (pCR) – у 4 (44,4 %) больных.
Таким образом, новые клинические подходы, включающие оценку биологического подтипа опухоли и определение молекулярных маркеров (экспрессия β-тубулина типа III, TOP2α, мутация BRCA1) облегчают планирование наиболее адекватной (персонифицированной) неоадъювантной ХТ на основе антрациклиновых антибиотиков и доцетаксела в лечении больных местно-распространенным РМЖ.


