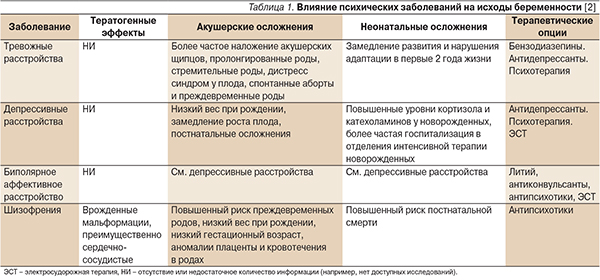
Проблема лечения психических заболеваний (ПЗ) в период беременности крайне актуальна в связи с широкой распространенностью и неблагоприятными последствиями для матери и ребенка как самих заболеваний (табл. 1), так и лекарственных средств (ЛС), применяемых для их лечения. ПЗ наблюдаются среди 10–16 % беременных [1]. Наиболее распространенными из них являются депрессивные и тревожные расстройства.
Беременность не оказывает протективного действия в отношении развития рецидивов большинства ПЗ [2]. Риск развития рецидива существенно увеличивается в случае отмены лекарственной терапии в период беременности, особенно если отмена препаратов проводилась быстро. С точки зрения развития рецидивов наиболее опасен послеродовый период.
Вопрос о применении психотропных препаратов (ПТП) в период гестации должен решаться индивидуально в каждом конкретном случае после тщательного взвешивания соотношения польза/риск ЛС и отсутствия фармакотерапии. При легком течении заболевания возможно применение психотерапевтических методов лечения, однако у большинства женщин со среднетяжелыми и тяжелыми формами ПЗ польза от фармакотерапии, как правило, превышает ее риск. При решении вопроса о продолжении приема ЛС в период беременности следует учитывать пожелания самой женщины, которой необходимо в доступной форме объяснить преимущества и недостатки лекарственной терапии, а также потенциальные последствия нелеченого заболевания. Все необходимые изменения в фармакотерапии по возможности следует проводить в предгравидарном периоде, чтобы не подвергать плод множественному лекарственному воздействию, поэтому для больных ПЗ крайне важным является планирование беременности. Женщинам с тяжелыми ПЗ попытки зачатия рекомендуется начинать не ранее чем через год после наступления ремиссии [2]. До этого срока им следует обеспечить надежную контрацепцию.
Общие принципы лечения ПЗ в период беременности
Вопрос об отмене ЛС, хотя бы на первые 6–10 недель, можно рассмотреть для женщин с легким течением заболевания [2]. По возможности отмену лекарственного препарата следует проводить постепенно, поскольку такая тактика позволяет снизить риск развития обострения. В то же время быстрая отмена позволяет уменьшить продолжительность воздействия препарата на плод. Вопрос о скорости отмены лекарственного препарата в случае наступления беременности следует решать индивидуально с учетом пожеланий самой женщины.
Несмотря на то что применение многих ПТП во время беременности ассоциируется с повышенным риском неблагоприятных исходов (см. ниже), проводить смену препарата, способного хорошо контролировать заболевание в предгравидарный период, обычно не рекомендуется, поскольку беременность не является лучшим периодом для экспериментирования с эффективностью лекарств. По возможности следует использовать монотерапию, т. к. применение высоких доз одного ЛС более безопасно, чем применение комбинации двух ЛС в низких дозах.
При выборе конкретного ЛС необходимо учитывать:
- предыдущий ответ на ПТП (если есть опыт их применения в анамнезе);
- для женщин, не принимавших ранее ЛС, – ответ на ПТП у ближайших родственников (если есть семейный анамнез заболевания);
- ожидаемый ответ и эффективность лечения конкретной женщины;
- профиль побочных реакций препарата;
- сопутствующие ЛС и риск лекарственных взаимодействий;
- потенциальное негативное влияние ЛС на мать и плод;
- безопасность ЛС в период грудного вскармливания.
Даже в случае если женщина не планирует кормить ребенка грудью, следует по возможности отдавать предпочтение ЛС, безопасным во время лактации. Это обусловлено тем, что планы на грудное вскармливание могут измениться, а переключение на другой препарат женщины, находящейся в стабильном состоянии, в послеродовом периоде не рекомендуется.
Безопасность ПТП в период беременности
Потенциальные нежелательные эффекты ПТП на плод и новорожденного включают:
- Структурные нарушения (врожденные аномалии).
- Острые неонатальные эффекты, проявляющиеся интоксикацией и синдромом отмены.
- Внутриутробную смерть.
- Замедление внутриутробного роста. 5. Нейроповеденческую тератогенность.
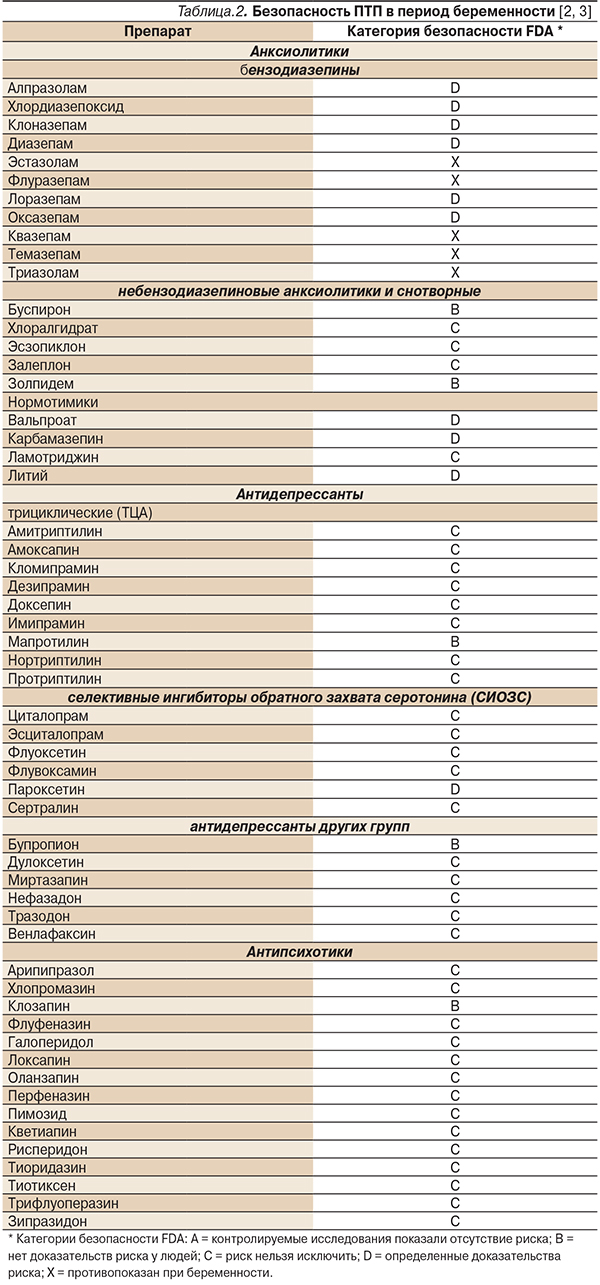
Данные об их безопасности в период беременности в соответствии с классификацией FDA представлены в табл. 2.
Безопасность антипсихотиков
Контролируемых исследований антипсихотиков во время беременности не проводилось. Большая часть данных о безопасности препаратов первого поколения для людей получена несколько десятилетий назад при их применении в низких дозах в качестве противорвотных средств при неукротимой рвоте беременных. В мета-анализе, включившем данные 2591 ребенка, подвергшегося воздействию типичных антипсихотиков в I триместре беременности, было выявлено небольшое, но статистически достоверное повышение относительного риска (OP = 1,21) возникновения врожденных аномалий под влиянием препаратов этой группы без преобладания какого-либо определенного типа дефектов [3]. Применение антипсихотиков первого поколения приводило к развитию одного дополнительного случая врожденных аномалий на каждые 250 беременностей, причем низкопотентные антипсихотики (например, хлорпромазин) ассоциировались с более высоким потенциалом тератогенности, чем препараты с мощным антипсихотическим действием (например, галоперидол). При оценке результатов мета-анализа следует учитывать, что сама шизофрения повышает риск развития мальформаций у плода примерно в 2 раза.
В двух мета-анализах был продемонстрирован повышенный риск преждевременных родов, перинатальной смертности, низкой массы тела детей при рождении от больных шизофренией, получавших во время беременности типичные антипсихотики, однако повышение риска этих неблагоприятных исходов также могло быть связано с заболеванием матери [4, 5].
При применении антипсихотиков первого поколения на поздних сроках беременности возможно развитие перинатального синдрома, который проявляется симптомами угнетения дыхания, нарушения кормления, гипертонусом, синдромом вялого младенца, слабой выраженностью или отсутствием рефлексов, экстрапирамидными нарушениями, тремором, патологическими движениями, повышенной возбудимостью и раздражительностью [3]. Эти симптомы возникают достаточно редко и обычно саморазрешаются в течение нескольких дней [3], однако в отдельных случаях могут персистировать на протяжении первого года жизни ребенка [6]. Проявления перинатального синдрома зависят от использованного препарата – низкопотентные антипсихотики чаще ассоциируются с развитием антихолинергических эффектов у новорожденных, в то время как высокопотентные – экстрапирамидных симптомов.
В феврале 2011 г. Агентство США по контролю пищевых продуктов и лекарственных средств (FDA) внесло в инструкции по применению всех антипсихотиков (типичных и атипичных) предостережение о потенциальном риске развития синдрома отмены и экстрапирамидных нарушений для детей, матери которых получали эти препараты в III триместре беременности. Однако в целом риск неблагоприятных исходов при применении антипсихотиков первого поколения в период гестации оценивается как невысокий [6]. В качестве препаратов выбора рассматриваются хлорпромазин, трифлуоперазин и галоперидол.
Данные о применении атипичных антипсихотиков беременными значительно более ограничены. Наибольшее беспокойство вызывают их неблагоприятные метаболические эффекты, т. к. ожирение и сахарный диабет являются дополнительным фактором риска развития осложнений во время беременности и родов, включая повышенный риск врожденных аномалий [8]. У новорожденных, матери которых страдали ожирением во время беременности, значительно увеличена масса тела при рождении, а также повышена вероятность развития метаболических нарушений непосредственно при рождении, в подростковом возрасте и на протяжении всей жизни [8, 9]. Метаболические нарушения, преимущественно гестационный диабет, наиболее часто вызывают оланзапин и клозапин. Единичные случаи развития гестационного диабета также описаны при применении во время беременности рисперидона. До настоящего времени нет сообщений о развитии этого осложнения при лечении беременных женщин арипипразолом, амисульпиридом, кветиапином, сертиндолом и зипразидоном [6].
Среди антипсихотиков второго поколения самым хорошо изученным препаратом в период беременности является оланзапин. Имеющиеся данные об исходах в 419 случаях беременности не позволяют предположить повышенный риск развития врожденных аномалий под влиянием данного препарата [6].
Данные о наличии тератогенного потенциала у клозапина противоречивы. Особое беспокойство вызывает его способность вызывать агранулоцитоз. Случаи агранулоцитоза у плода не описаны, однако агранулоцитоз может развиваться у детей в первые 6 месяцев жизни, приводя к летальным исходам треть из них [10]. Клозапин может вызывать ортостатическую гипотонию, приводящую к ухудшению плацентарного кровотока. Он повышает секрецию окситоцина и может усиливать сократительную активность миометрия.
Применение рисперидона на основании результатов анализа исходов 713 беременностей представляется достаточно безопасным [11]. Однако следует помнить, что рисперидон, так же как антипсихотики первого поколения, способен вызывать гиперпролактинемию, которая ассоциируется с достоверным повышением риска потери беременности как на ранних, так и на поздних сроках и замедлением внутриутробного роста плода [12]. Кроме того, у женщин, принимающих антипсихотики, вызывающие гиперпролактинемию, повышен риск развития аутоиммунных заболеваний, включая антифосфолипидный синдром и связанные с ним нарушения репродуктивной функции [12, 13].
Имеющаяся на сегодняшний день информация недостаточна для оценки безопасности применения кветиапина на ранних сроках беременности, хотя на ее основании нельзя предположить наличие у него тератогенного потенциала.
Зипразидон в исследованиях на животных вызывал тератогенные эффекты (преимущественно дефекты межжелудочковой перегородки и аномалии почек) в дозах, аналогичных терапевтическим у людей [6]. В доступной литературе удалось найти лишь одно сообщение о применении этого препарата на протяжении всей беременности больной шизофренией, родившей ребенка с расщелиной неба [14]. Таким образом, тератогенный потенциал зипразидона, а также амисульприда, сертиндола и арипипразола для людей остается неизвестным.
Безопасность антидепрессантов
В качестве препарата выбора для беременных с рекуррентной депрессией и с впервые выявленными в период гестации тревожными расстройствами рассматриваются СИОЗС. Данные о влиянии препаратов этой группы на исходы беременности неоднозначны [15]. В ряде исследований, опубликованных в начале 2000-х гг., было показано повышение в 1,8 раза риска врожденных сердечнососудистых дефектов при применении пароксетина во время беременности. В последующих исследованиях СИОЗС получены противоречивые результаты. В некоторых из них подтверждались данные о повышенном риске возникновения врожденных аномалий под влиянием пароксетина, в других был выявлен повышенный риск их развития при применении на ранних сроках прочих препаратов СИОЗС (сертралина, циталопрама и флуоксетина), но не пароксетина. Анализ данных 9622 детей с врожденными дефектами и 4092 контрольных детей, включенных в исследование National Birth Defects Prevention Study в Канаде, не выявил при применении СИОЗС во время беременности повышения частоты врожденных дефектов в целом, но обнаружил повышенную частоту 3 специфических видов аномалий: анэнцефалии, краниосиностоза и омфалоцеле [17]. В других исследованиях и мета-анализах применение пароксетина и других СИОЗС во время беременности вообще не ассоциировалось с повышением риска тератогенности [18–20]. Несмотря на то что производитель Паксила (пароксетина) в 2005 г. ввел в инструкцию по медицинскому применению предостережение о повышенном риске развития врожденных аномалий, этот риск окончательно не доказан. В совместном заявлении Американской психиатрической ассоциации и Американского колледжа акушеров и гинекологов указывается на то, что доказательства связи между использованием Паксила (пароксетина) во время беременности и проблемами сердечно-сосудистой патологии не убедительны.
В ряде исследований наблюдалась ассоциация между применением беременными антидепрессантов, включая СИОЗС, повышением риска спонтанных абортов и преждевременных родов [21, 22]. Согласно результатам метаанализа 6 когортных исследований, частота спонтанных абортов при применении антидепрессантов составила 12,4 % и была достоверно выше (на 3,9 %), чем в контрольной группе [23]. При этом разницы между применяемыми классами антидепрессантов не отмечено. Однако самопроизвольные аборты и преждевременные роды могли быть обусловлены самими депрессивными расстройствами. При применении СИОЗС во время беременности также описаны замедление внутриутробного роста, низкий вес при рождении, уменьшение окружности головы новорожденного и снижение количества баллов по шкале Апгар, однако причинно-следственная связь между СИОЗС и этими исходами также не установлена [24].
В фармакоэпидемиологическом исследовании с участием 5731 беременной женщины была выявлена ассоциация между применением СИОЗС и повышением риска преэклампсии [25]. Риск развития преэклампсии у женщин, прекративших прием СИОЗС до конца I триместра беременности, по сравнению с не принимавшими препараты этой группы, повышался в 1,4 раза, а у женщин, продолжавших принимать СИОЗС после I триместра, – в 4,9 раз. Сведения о более высоком риске развития гестационной гипертонии с или без преэклампсии у беременных, получавших СИОЗС, были подтверждены и в гнездовом исследовании типа случай–контроль, базирующемся на данных Регистра беременности провинции Квебек (Канада) [26].
С точки зрения последствий для ребенка наибольшее беспокойство вызывают нарушение адаптации в раннем неонатальном периоде и легочная гипертензия у новорожденных [27]. Однако, по данным систематического обзора 6 исследований, абсолютное повышение легочной гипертензии составляет менее 1 % и не должно рассматриваться в качестве причины отмены СИОЗС беременным [28].
Отдаленные последствия внутриутробного воздействия СИОЗС для нейропсихического развития детей изучены плохо. Результаты анализа Датской национальной когорты рождений (Danish National Birth Cohort) позволяют заподозрить наличие ассоциации между применением на поздних сроках беременности антидепрессантов в целом и замедлением моторного развития, особенно у мальчиков [29]. Недавно было показано, что применение СИОЗС во время беременности может приводить к снижению у новорожденных уровня рилина – гликопротеина, важнейшей функцией которого является регулирование миграции и позиционирования нервных стволовых клеток в период фетального и раннего послеродового развития, необходимых для нормального формирования коры и других структур головного мозга [30].
В качестве препаратов выбора из группы СИОЗС рекомендуют флуоксетин, циталопрам или сертралин [31, 32]. Следует отметить, что длительный период полувыведения флуоксетина предрасполагает к кумуляции препарата у новорожденного. Кроме того, флуоксетин лучше других СИОЗС проникает в грудное молоко, поэтому менее безопасен при лечении депрессии в постнатальном периоде у кормящих женщин. Сертралин имеет фармакокинетические преимущества перед другими СИОЗС и хорошо совместим с грудным вскармливанием, Применения пароксетина во время гестации рекомендуется избегать во всех международных руководствах по лечению депрессии у беременных. Однако его можно оставить женщинам, забеременевшим в период лечения данным препаратом или не желающим отказаться от него в связи с хорошим терапевтическим ответом [32].
ТЦА на основании результатов эпидемиологических исследований представляются достаточно безопасными для плода. Повышения частоты пороков развития при их применении на ранних сроках беременности не выявлено как в отдельных, в т. ч. достаточно крупных, исследованиях, так и в мета-анализе, включившем данные 30 тыс. родившихся живыми детей, включая 414 детей, подвергшихся воздействию ТЦА в I триместре [3].
В ряде исследований применение ТЦА ассоциировалось с повышением риска невынашивания беременности [23, 33]. У детей, подвергшихся действию ТЦА в поздние сроки беременности, описаны симптомы отмены [3]. При использовании кломипрамина в поздние сроки беременности сообщалось о синдроме плохой адаптации новорожденных.
Среди препаратов ТЦА Американская Академия педиатрии отдает предпочтение нортриптилину и дезипрамину, вызывающим меньше побочных эффектов у матери [34]. Амитриптилин, обладающий более выраженным седативным действием, чем нортриптилин и дезипрамин, может применяться в низких дозах для лечения бессонницы у беременных.
Применение ингибиторов моноаминооксидазы (МАО) во время беременности не рекомендуется, т. к. в исследованиях на животных они приводили к задержке внутриутробного роста, а информация об использовании препаратов этой группы у беременных женщин крайне ограничена [3]. Ингибиторы МАО часто вызывают нежелательные эффекты у матери, в т. ч. обострение гипертензии [34].
Сведения о влиянии бупропиона, миртазапина, нефазодона, тразодона и венлафаксина на течение и исходы беременности ограниченны. Венлафаксин рассматривается в качестве препарата выбора для стартовой терапии при тяжелой тревоге у беременных, требующей срочных терапевтических мероприятий [35]. В исследовании с участием 450 беременных женщин, 150 из которых принимали венлафаксин(всевIтриместре,вт.ч.34– напротяжениивсейбеременности),150– препараты группы СИОЗС и 150 – нетератогенные препараты, частота врожденных аномалий при применении венлафаксина не превышала среднепопуляционный уровень (1–3 %) [36]. Его применение во II триместре в исследовании типа случай–контроль ассоциировалось с повышением риска низкого для гестационного возраста веса новорожденных [37]. В большом исследовании типа случай–контроль (5124 случая спонтанных абортов и 10 контролей на каждый “случай”), использовавшем данные Регистра беременности провинции Квебек (Канада), венлафаксин наряду с пароксетином и комбинациями препаратов оказался связан с наиболее высоким риском спонтанных абортов среди антидепрессантов трех групп (ТЦА, СИОЗС и СИОЗСН) [38]. Этот риск существенно повышался при использовании препарата в суточной дозе выше 150 мг. При применении венлафаксина на поздних сроках беременности, как и при СИОЗС, описан синдром плохой адаптации новорожденного [39].
Миртазапин наряду с лечением депрессивных расстройств относительно широко применяется в терапии рефрактерной неукротимой рвоты беременных. Результаты нескольких исследований по его применению беременными женщинами не позволяют предположить повышение риска развития врожденных аномалий. В ряде исследований внутриутробное воздействие миртазапина ассоциировалось с повышением риска преждевременных родов и, возможно, спонтанных абортов [40, 41].
По результатам многоцентрового проспективного контролируемого исследования применение тразодона (n = 58) и нефазодона (n = 89) в I триместре беременности не ассоциируется с повышенным риском развития врожденных дефектов [42]. Эти результаты подтверждаются данными отдельных наблюдений (более 100 случаев для нефазодона и 70 случаев – для тразодона) и отсутствием тератогенных эффектов у животных.
Безопасность нормотимиков
Считается, что препараты лития повышают риск возникновения врожденных сердечно-сосудистых дефектов, особенно аномалии Эпштейна. У детей, матери которых принимали их на ранних сроках беременности, частота этой врожденной аномалии составляет 0,05–0,1% и превышает частоту ее развития в общей популяции примерно в 20–40 раз [43]. Однако, согласно данным мета-анализа 385 исследований, риск мальформаций под влиянием лития остается недоказанным [44]. В любом случае абсолютный риск развития врожденных аномалий сердца при применении лития во время беременности достаточно низок. Кроме того, аномалии Эпштейна развиваются только в том случае, когда воздействие лития на плод по срокам совпадает с периодом формирования сердца в процессе органогенеза (преимущественно 3–6-я неделя гестации). Женщине, планирующей беременность, препараты лития рекомендуется по возможности отменять, по крайней мере во время I триместра. В случае наступления беременности на фоне лечения литием целесообразно подробно обсудить с женщиной пользу и риски, связанные с продолжением лечения, и вместо отмены препарата предложить ей тщательный мониторинг концентраций лития в крови и состояния плода. Это связано с тем, что постепенная отмена лития на протяжении 2–4 недель при наступившей беременности не позволяет снизить риск тератогенного действия, а его резкая отмена сопряжена с высоким риском развития рецидива. В связи с невысоким абсолютным риском тератогенности и достаточно хорошей изученностью литию рекомендуется отдавать предпочтение и женщинам, которым показано применение нормотимиков во время беременности [45].
При воздействии лития на плод во II и III триместрах возможно развитие зоба [34, 44]. На поздних сроках беременности и в период родов вследствие изменений фармакокинетики лития повышен риск развития токсических эффектов у матери и плода/новорожденного. Применение лития может приводить к развитию гипоили гипертиреоза у матери. Литий может усугублять полидипсию и полиурию, которые часто встречаются у беременных, вызывать поражения почек и нефрогенный (несахарный) диабет [44].
Токсические эффекты лития у новорожденного обычно проявляются летаргией и синдромом “вялого младенца” (floppy baby syndrome), для которого характерны респираторные нарушения, цианоз и снижение мышечного тонуса. Эти симптомы являются дозозависимыми и развиваются на фоне высокого уровня лития в крови в поздние сроки беременности. Обычно они носят легкий и транзиторный характер [34, 46]. Влияние лития на отдаленные исходы развития детей остается неизвестным [47].
Безопасность терапии литием для матери и ребенка позволяет существенно повышать мониторинг концентраций препарата в крови (рекомендуемый уровень: 0,6–0,8 ммоль/л – при поддерживающей терапии и 0,8–1,2 ммоль/л – при лечении маниакальных состояний). Экскреция лития почками повышается по мере увеличения сроков беременности, что обычно вызывает необходимость повышения его доз. Во время родов почечный клиренс лития резко падает. С целью предотвращения токсических эффектов рекомендуют его отмену или снижение дозы за 7–10 дней до родов с последующим возобновлением приема после родов.
Данные о безопасности антиконвульсантов во время беременности получены преимущественно в исследованиях с участием женщин, страдающих эпилепсией, поэтому при их оценке надо учитывать, что сама эпилепсия способствует повышению риска врожденных аномалий примерно в 4 раза [48]. Предполагают, что риск развития больших врожденных аномалий при применении во время беременности монотерапии антиконвульсантами удваивается, а при применении комбинированной терапии утраивается по сравнению с популяционным уровнем [49]. Использование противосудорожных препаратов на ранних сроках гестации может приводить к развитию дефектов сердца, нервной трубки, конечностей, гениталий, характерных черепно-лицевых аномалий, микроцефалии, расщелин губы и неба, а также замедлению внутриутробного роста. Максимальный риск при монотерапии препаратами этой группы ассоциируется с применением высоких доз вальпроевой кислоты [50]. Результаты исследований постоянно указывают на то, что риск развития больших врожденных аномалий при применении беременными вальпроата в 2–4 раза выше, чем при применении карбамазепина и ламотриджина. В мета-анализе, включившем данные 59 исследований (65 533 беременные женщины с эпилепсией и 1 817 024 здоровые женщины), риск развития больших врожденных аномалий при монотерапии вальпроатом составил 10,73 % (95 % доверительный интервал [ДИ] – 8,16–13,29) [51]. Тератогенный эффект вальпроата носит дозозависимый характер [52]. Врожденные аномалии редко развиваются при ее использовании в суточной дозе ниже 1000 мг и концентрациях в крови ниже 70 мкг/мл. При применении в дозе ≤ 1000 мг/сут прежде всего снижается частота поражений нервной трубки. Дальнейшее уменьшение дозы, по данным анализа пяти европейских исследований, не приводит к снижению риска врожденных аномалий [53].
Частота больших врожденных аномалий у детей, матери которых получали во время беременности карбамазепин, согласно результатам мета-анализа Meador и соавт., включившего 4411 женщину, составила 4,6 % (95 % ДИ – 3,48–5,76) и оказалась достоверно ниже, чем при применении других антиконвульсантов [51].
Данные о тератогенном потенциале ламотриджина достаточно противоречивы. Согласно результатам анализа регистров беременности и других исследований, большие врожденные аномалии наблюдаются среди 2,6–3,2 % детей, внутриутробно подвергшихся действию этого препарата, что не отличается от частоты врожденных аномалий у населения в целом [54– 56]. Однако в регистре беременности Великобритании был показан повышенный риск развития лицевых расщелин под влиянием ламотриджина (0,89 % из 564 случаев) [52]. Аналогичные результаты были получены и в другом исследовании [58]. Анализ регистра беременности Великобритании также позволил выявить дозозависимый характер тератогенного эффекта ламотриджина. Повышение риска развития лицевых расщелин наблюдалось при его применении в суточных дозах выше 200 мг [52].
Ограниченность и противоречивость данных не позволяют сделать окончательное заключение о наличии тератогенного потенциала у ламотриджина, однако он представляется более безопасным для беременных препаратом, чем вальпроат и карбамазепин [49].
Использование топирамата во время гестации сопряжено с повышенным риском возникновения расщелин губы и неба. По данным Североамериканского регистра противоэпилептических препаратов относительный риск ротолицевых расщелин под влиянием топирамата повышается по сравнению с общепопуляционным уровнем в 21,3, по данным регистра Великобритании – в 16,0 раз [58]. На основании этих данных в апреле 2011 г. FDA перевело его из категории безопасности С в категорию D.
Безопасность окскарбазепина для беременных изучена плохо. В нескольких исследованиях повышенного риска врожденных аномалий при монотерапии препаратом не выявлено [59].
Риск развития тератогенных эффектов наиболее высок при сочетанном применении антиконвульсантов [47, 49]. В систематическом обзоре показано, что риск врожденных дефектов при политерапии повышается в том случае, если комбинации включают вальпроат, фенобарбитал или фенитоин [48]. Наиболее опасной с точки зрения развития врожденных дефектов считают комбинацию вальпроата с карбамазепином. По данным Североамериканского регистра, частота мальформаций при применении во время беременности данной комбинации составляет 15,4 % [60]. В последние годы беспокойство также вызывает сочетанное применение вальпроата и ламотриджина. По данным Регистра беременностей Великобритании, большие врожденные аномалии наблюдались у 9,6 % детей, матери которых принимали комбинацию вальпроата и ламотриджина (n = 141) и полностью отсутствовали у детей, подвергшихся воздействию комбинации карбамазепина и ламотриджина (n = 118) [52]. Сходный риск при использовании комбинации вальпроата с ламотриджином (9,1 %) был продемонстрирован и в исследовании, основанном на данных Североамериканского регистра беременности антиконвульсантов [60]. В то же время риск врожденных аномалий при использовании ламотриджина в комбинации с другими противосудорожными препаратами составил 2,9 %. Предполагают, что вальпроат снижает ассоциированную с беременностью индукцию метаболизма ламотриджина и таким образом способствует повышению его концентраций в крови.
С целью профилактики врожденных аномалий при применении антиконвульсантов во время беременности рекомендуется назначать фолиевую кислоту в суточной дозе 3–5 мг. В мета-анализе 5 рандомизированных и квазирандомизированных исследований с участием 6105 женщин было показано, что фолиевая кислота в виде монотерапии или в комбинации с другими витаминами и минералами предотвращает дефекты нервной трубки, но не оказывает протективного действия в отношении других врожденных аномалий [61]. Помимо врожденных дефектов вальпроат и карбамазепин могут вызывать замедление внутриутробного роста и уменьшение окружности головы у новорожденного. У детей, матери которых получали вальпроат незадолго до родов, описаны замедление частоты сердечных сокращений, транзиторные симптомы гепатотоксичности и гипогликемии, снижение уровня фибриногена и кровотечения у новорожденных. Возможно развитие синдрома отмены у новорожденных, клинически проявляющегося раздражительностью, беспокойством, нарушением питания и изменением мышечного тонуса [62].
Карбамазепин может вызывать дефицит витамина К у плода, приводя к развитию кровотечений у новорожденного и нарушению морфологии лица [51].
Внутриутробное воздействие вальпроата ассоциируется с повышенным риском когнитивных и поведенческих проблем у детей [63–65]. Особенно высокий риск нейроповеденческих нарушений наблюдается при применении вальпроата в комбинации с другими психотропными средствами [47]. В проспективном исследовании NEAD (Neurodevelopmental Effects of Antiepileptic Drugs; 28 центров
Соединенного королевства и США, 322 пары мать/ребенок) серьезные нежелательные исходы (врожденные аномалии, отставание в развитии или смерть) наблюдались при применении вальпроата в 25 % случаев. В 3-летнем возрасте у детей, подвергшихся внутриутробному воздействию вальпроата, отмечено отставание по уровню IQ – в среднем на 9, 7 и 6 баллов ниже, чем у их сверстников, матери которых получали во время беременности ламотриджин, фенитоин и карбамазепин соответственно [66]. При применении карбамазепина серьезные нежелательные исходы наблюдались в данном исследовании у 14 % детей. Это исследование также выявило негативное дозозависимое влияние карбамазепина на вербальные функции детей 2–3 лет, подвергшихся его воздействию в пренатальном периоде. Данные других исследований в отношении нейроповеденческой токсичности карбамазепина противоречивы, однако считают, что серьезных нарушений когнитивных функций этот препарат не вызывает [3, 6]. В целом риск неблагоприятных исходов беременности, включая отставание детей в развитии, при применении карбамазепина беременными значительно ниже, чем при применении вальпроата.
Применение вальпроата женщинами детородного возраста в связи с высоким тератогенным потенциалом возможно только в отсутствие эффективных альтернатив. Женщине, планирующей беременность, вальпроат и карбамазепин следует по возможности отменять. Их также рекомендуется отменять при наступлении незапланированной беременности. Отмену нормотимиков следует проводить постепенно (не менее 2 недель).
Безопасность анксиолитиков и снотворных средств
Анксиолитическая эффективность антигистаминных препаратов невысока, поэтому, несмотря на достаточно высокую безопасность препаратов I поколения, их назначают беременным преимущественно в качестве противорвотных средств.
Бензодиазепины быстро устраняют симптомы острой тревоги, однако их применение ограничено рядом нежелательных эффектов, поэтому назначения бензодиазепинов во время беременности рекомендуется по возможности избегать, а в случае необходимости – применять в минимальной эффективной дозе на протяжении минимально возможного времени [46].
Данные о безопасности применения бензодиазепинов в I триместре беременности противоречивы. Результаты ранних исследований, преимущественно диазепама, позволили предположить, что их применение сопряжено с пороками развития, прежде всего ротолицевыми расщелинами. В ряде исследований не было выявлено повышенной частоты пороков развития в целом и каких-либо специфических аномалий при использовании во время гестации бензодиазепинов. В мета-анализе Altshuler и соавт. отмечено небольшое (<1%посравнениюс0,06%унаселения в целом), но достоверное повышение риска возникновения расщелин губы и неба под влиянием внутриутробного воздействия бензодиазепинов [3]. По данным исследований типа случай–контроль, частота расщелин губы или неба при внутриутробном воздействии бензодиазепинов составляет 11 : 10 тыс. рождений по сравнению с 6 : 10 тыс. у населения в целом, т. е. относительный риск повышается на 80 %, однако абсолютный риск остается низким [67]. Причинно-следственная связь между приемом бензодиазепинов и развитием врожденных дефектов установлена далеко не во всех случаях, поэтому вопрос о наличии тератогенного потенциала у препаратов этой группы остается нерешенным [46].
Наибольшее беспокойство вызывает применение бензодиазепинов в поздние сроки беременности [46]. Их прием незадолго до родов может приводить к развитию токсических эффектов у новорожденных – нарушению терморегуляции, апноэ, снижению количества баллов по шкале Апгар, мышечной гипотонии, седации и нарушению питания, а также врожденной амиотонии, известной под названием синдрома Оппенгейма, или “синдрома вялого младенца”. Кроме того, у новорожденных могут наблюдаться симптомы отмены, связанные с развитием внутриутробной зависимости. Риск развития синдрома отмены при применении бензодиазепинов значительно превышает таковой при применении СИОЗС [46]. Клинически симптомы отмены проявляются гипертензией, гиперрефлексией, беспокойством, повышенной возбудимостью, судорогами, нарушением сна, постоянным криком, тремором или подергиванием конечностей, брадикардией, цианозом, жевательными движениями, нарушением сосательного рефлекса, апноэ, вздутием живота, диареей, рвотой и замедлением роста. Они могут возникать вскоре после родов или в течение первых 3 недель жизни ребенка и продолжаться до нескольких месяцев в зависимости от тяжести абстиненции и фармакокинетики конкретного препарата. Персистирование симптомов отмены в течение нескольких месяцев описано у детей, матери которых принимали в период гестации хлордиазепоксид, диазепам или алпразолам [2]. В случае применения во время беременности препаратов с короткой продолжительностью действия (лоразепам и алпразолам) синдром отмены протекает более тяжело, но менее длительно, чем при использовании препаратов с большей продолжительностью действия (клоназепам и диазепам).
Риск возникновения синдрома отмены особенно высок при длительном применении бензодиазепинов во время беременности (даже в дозах ниже среднетерапевтических), а также при их внутримышечном и внутривенном введении во время беременности и родов [46, 62]. Симптомы отмены у новорожденных описаны при однократном парентеральном введении диазепама женщинам с преэклампсией или с целью седации в родах. Однократное введение диазепама во время родов также приводило к развитию синдрома вялого младенца. Внутривенное применение лоразепама беременными с тяжелой гипертензией ассоциировалось с развитием синдрома отмены у новорожденных, низкой оценкой по шкале Апгар, гипотермией, нарушением сосания и выраженным угнетением дыхания, которое требовало искусственной вентиляции легких. У недоношенных детей частота этих осложнений была повышена вне зависимости от того, каким путем вводился лоразепам: парентерально или перорально [46]. Применение инъекционного лоразепама не рекомендуется ни на какой стадии беременности, включая естественные и оперативные роды.
С целью профилактики развития неблагоприятных последствий для новорожденного по возможности следует избегать применения бензодиазепинов в поздние сроки беременности и постепенно снижать их дозы перед родами.
В двух исследованиях применение бензодиазепинов во время беременности ассоциировалось с достоверным повышением риска преждевременных родов. В одном из них скорректированное отношение шансов преждевременных родов при применении бензодиазепинов составило 6,79 (95% ДИ – 4,01–11,5; p < 0,001], при монотерапии препаратами этой группы – 5,56 (95% ДИ – 2,71–11,4), при комбинированной терапии – 8,48 [68].
Сведения о нейроповеденческой токсичности бензодиазепинов скудны и противоречивы. В двух небольших исследованиях описано нарушение моторного развития детей 6–18 месяцев, внутриутробно подвергшихся воздействию бензодиазепинов [69], в других исследованиях ассоциации между применением препаратов этой группы в период беременности и отставанием в развитии не выявлено [62].
Данные о безопасности для беременных небензодиазепиновых анксиолитиков/снотворных средств (залеплон, золпидем, зопиклон) гораздо более ограниченны, поэтому не позволяют оценить их соотношение польза/риск для данной категории пациентов. Использование небензодиазепиновых препаратов на ранних сроках гестации не ассоциировалось с повышенным риском развития врожденных аномалий в целом, но было обнаружено повышение риска пилоростеноза и деформаций тонкого кишечника [70–72]. Причинно-следственная связь препаратов с врожденными дефектами желудочно-кишечного тракта не доказана, но требует наблюдения. При применении небензодиазепиновых анксиолитиков/снотворных во время беременности также наблюдались преждевременные роды и низкий вес детей при рождении [70], однако эти осложнения могли быть связаны с заболеванием, для лечения которого их назначали, т. к. на практике их часто используют по незарегистрированным показаниям [71].
Таким образом, вопрос о применении ПТП во время беременности должен решаться индивидуально в каждом конкретном случае. Крайне важной задачей для женщин с ПЗ является планирование беременности, обсуждение с ней возможных рисков и терапевтических возможностей. В ряде случаев возможна отмена ПТП на весь период беременности или в некоторые критические периоды. При необходимости проведения психофармакотерапии нужен тщательный подбор препарата с учетом течения заболевания и его негативного влияния на плод и здоровье беременной женщины. По возможности предпочтение следует отдавать монотерапии. Во всех случаях важен тщательный мониторинг состояния женщины и плода на протяжении всего периода беременности.


