Введение
Несмотря на очевидный прогресс, достигнутый в терапии бронхиальной астмы (БА) за последние годы, она по-прежнему остается причиной инвалидизации больных и смертельных исходов [1]. Кроме того, более половины больных БА, получающих лечение, не имеют контроля заболевания, что сопряжено с высоким риском развития обострений [2]. Современный менеджмент БА требует глубокого анализа факторов, ответственных за прогрессирование заболевания и развитие обострений, а также разработки целевой терапии БА с учетом клинических и биологических фенотипов болезни.
Фенотип – видимые характеристики организма, обусловленные взаимодействием его генетической составляющей и факторов внешней среды. Термин “фенотип”, равно как и такие термины, как “ген”, “генотип”, были предложены одним из основателей современной генетики, датским биологом Вильгельмом Иогансеном в 1909 г. Понятие “фенотип” распространяется на любые признаки организма: начиная от первичных продуктов действия генов – молекул РНК и полипептидов и кончая особенностями внешнего строения, физиологических и патологических процессов (в т. ч. заболеваний), поведения и т. д. По сути, каждый пациент может иметь собственный специфический фенотип БА, но выделение “фенотипа БА” подразумевает группу или подгруппу больных, объединенных общими клиническими и/или биологическими признаками заболевания.
Гетерогенность астмы в классификациях
На протяжении многих десятилетий БА рассматривается как гетерогенное заболевание, что не могло не найти отражения в ее классификациях. В начале ХХ в. Rackemann предложил выделять экзогенную и эндогенную БА [3], основываясь на этиологической концепции, которая и сегодня используется для идентификации клинических фенотипов аллергической и неаллергической астмы. В нашей стране довольно долго популярной была классификация, предложенная А.Д. Адо и П.К. Булатовым [4], также основанная на этиологической концепции, выделяющая инфекционно-аллергическую и неинфекционно-аллергическую (атопическую) БА. В конце 1970-х гг. Turner-Warwick выделил субгруппы пациентов с БА, основываясь на концепции функциональных нарушений: “хрупкая астма” (“brittle asthma”); “необратимая астма” (“irreversible asthma”) и “астма с выраженным утренним снижением легочной функции” (“the morning dipper”) [5].
Однако наиболее близко к современному пониманию фенотипов БА приблизился Г.Б. Федосеев, который еще в 1982 г. представил следующие клинико-патогенетические варианты БА [6]:
• атопический;
• инфекционно-зависимый;
• аутоиммунный;
• дисгормональный;
• дизовариальный;
• выраженный адренергический дисбаланс;
• холинергический;
• нервно-психический;
• аспириновый;
• астма физического усилия.
Классификции БА, предлагаемые профессиональными сообществами и включенные в международные руководства, основываются на выраженности клинических симптомов с выделением интермиттирующей (эпизодической) и персистирующей астмы, которая может быть легкой, средней и тяжелой (GINA, 1995) [1]. Критерии этих клинических фенотипов БА довольно четко определены в руководствах GINA. В последних международных документах (GINA, 2006–2011) [1] развивается концепция о нецелесообразности выделения степеней тяжести БА для обычной клинической практики и целесообразности перехода на деление астмы по уровню контроля. Классификация БА по степени тяжести рекомендуется только для научных целей и клинических исследований. Однако в нашей стране классификация БА по степени тяжести сохранена из-за важности первоначальной оценки тяжести заболевания, а также вследствие социальных и экспертных причин. Итак, классификация БА по уровню контроля с выделением контролируемой, частично-контролируемой и неконтролируемой БА, впервые предложенная в GINA (2006), является, пожалуй, первой классификацией, которая не основывается на этиологических, клинических или биологических характеристиках заболевания. Этот подход описывает состояние БА относительно проводимых лечебных мероприятий и предусматривает прежде всего оценку адекватности используемой терапии. Вместе с тем нельзя не отметить важность определения степени тяжести БА, особенно выделение клинического фенотипа тяжелой астмы. Тяжесть БА традиционно определялась как внутренний индивидуальный уровень активности болезни, правильная оценка которого может быть сделана только перед началом терапии или какого-либо вмешательства (элиминационные мероприятия), ибо под влиянием лечения степень тяжести БА может меняться.
Последние 10–15 лет активно обсуждаются альтернативные классификации БА, основанные на идентификации клинических и биологических фенотипов заболевания. Важность выделения фенотипов БА обусловлена различием этиологических факторов и факторов риска; различным течением заболевания; различными подходами к терапии и ответом на лечение, наконец различным прогнозом заболевания.
Способы идентификации фенотипов астмы
Существует два подхода к идентификации фенотипов БА: классификация на основании клинико-биологических параметров заболевания и кластерный анализ. Ограничения первого наиболее распространенного подхода заключается в его существенной описательности, пристрастности и фокусировании только на одном аспекте болезни. Это может быть этиологический триггер или тип функциональных нарушений, или тип воспаления, но это лишь одно из проявлений БА, выбранное автором классификации. Кластерный анализ представляет собой многомерную статистическую процедуру, предназначенную для разбиения совокупности объектов на однородные группы (кластеры) с целью их классификации. Кластерный анализ учитывает множество переменных, по которым оцениваются объекты в достаточно большой выборке, и с этой точки зрения данный подход имеет безусловные преимущества, являясь менее тенденциозным, хотя признать его полностью беспристрастным тоже невозможно, т. к. выбор переменных остается за авторами анализа.
Примером идентификации фенотипов БА на основании клинико-биологических параметров является классификация, предложенная Wenzel (табл. 1) [7].
Согласно этой классификации, выделяются:
1. Клинические/физиологические фенотипы, определяемые:
• тяжестью заболевания;
• частотой обострений;
• наличием хронического ограничения дыхательных путей;
• возрастом начала БА;
• ответом на терапию.
2. Фенотипы, определяемые триггерами:
• аспирин и нестероидные противовоспалительные средства (НПВС);
• аллергены;
• профессиональные аллергены и ирританты;
• менструации;
• физические нагрузки.
3. Фенотипы, определяемые типом воспаления:
• эозинофильное;
• нейтрофильное;
• малогранулоцитарное.
Многие из этих фенотипов БА давно и успешно идентифицируются врачами. Так, например, выделение фенотипов интермиттирующей, легкой, среднетяжелой и тяжелой персистирующей БА проводится на основании выраженности и частоты симптомов, нарушений функции легких, объема требуемой терапии и ограничения активности пациента. Это рутинная практика врача по определению степени тяжести БА для назначения адекватной терапии. Не менее важным и самое главное – доступным является выявление этиологических фенотипов БА (рис. 1). В соответствии с номенклатурой аллергических болезней, предложенной EAACI [8], БА, опосредованную иммунологическими механизмами, следует называть аллергической астмой. Если доказано участие IgE -антител в формировании БА, следует обозначать ее IgE-опосредованной аллергической астмой или, с определенным допущением, атопической (атопия – более строгое понятие, подразумевающее прежде всего генетическую предрасположенность к синтезу IgE-антител). БА, основу патогенеза которой не составляют IgE-антитела, является не IgE-обусловленной или неатопической. Объективным различием этих фенотипов (атопической и неатопической БА) являются положительные кожные пробы с аллергенами и связь клинических симптомов атопической БА с контактом с этими аллергенами. Примером неаллергической БА служит аспириновая БА, основу патогенеза которой составляет неаллергическая неиммунная непереносимость ацетилсалициловой кислоты (аспирин) и НПВС. Еще один этиологический фенотип – профессиональная БА, которая в большинстве случаев относится к IgE-опосредованной аллергической БА, ибо большинство профессиональных сенсибилизаторов является аллергенами, способными вызывать специфический IgE-ответ. Профессиональные агенты, простые химические вещества с низким молекулярным весом, являются ирритантами (соли никеля, платины, изоцианаты, формальдегид и др.) и могут вызывать развитие бронхиальной гиперреактивности с формированием БА. И все же повышенный риск развития профессиональной БА имеют лица с атопией.
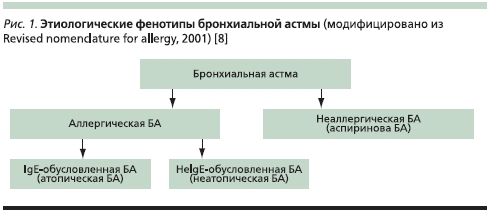
Таким образом, маркерами этиологических фенотипов БА являются этиологические триггеры, которые достаточно легко определить в случае атопической и аспириновой БА. Причины неатопической БА в настоящее время не ясны: возможно, это неизвестные аллергены; не исключена этиологическая роль вирусов и атипичных бактериальных инфекций, таких как Chlamydophilapneumoniaeи Mycoplasmapneumoniae. Клинический фенотип неатопической БА выявляется путем исключения других этиологических фенотипов. В табл. 1 представлена сравнительная характеристика этиологических фенотипов атопической, неатопической и аспириновой БА.
Одной из самых известных является исследовательская работа с применением кластерного анализа Haldar и соавт. (2008) [9]. Были проанализированы 3 группы больных: 184 пациента с БА, наблюдающихся у врачей общей практики и имеющих преимущественно легкую или среднетяжелую форму заболевания; 187 больных, наблюдающихся у врачей-специалистов, заболевание которых отвечало критериям рефрактерной, трудноподдающейся лечению астмы; 68 пациентов, из которых 59 отвечали критериям рефрактерной БА, из проспективного исследования тяжелых обострений БА.
С помощью кластерного анализа было определено 5 клинических фенотипов БА в этой популяции больных (рис. 2). Три кластера были характерны для пациентов, наблюдающихся у врачей общей практики. Первый – включал больных ранней атопической БА, имеющих симптомы, нарушение функции легких и эозинофильный тип воспаления дыхательных путей. Клинически эта подгруппа характеризовалась более частыми, чем пациенты двух других кластеров, госпитализациями и обострениями БА, требующими назначения системных глюкокортикостероидов (ГКС). Второй кластер включал больных преимущественно женского пола, страдающих ожирением и имеющих неэозинофильное воспаление дыхательных путей. Наконец третий кластер включал пациентов с благоприятно протекающей астмой, у подавляющего большинства которых функция легких и маркеры воспаления были в пределах нормальных значений. Эти больные характеризовались очень низкой частотой госпитализаций и обострений БА за предыдущий год.
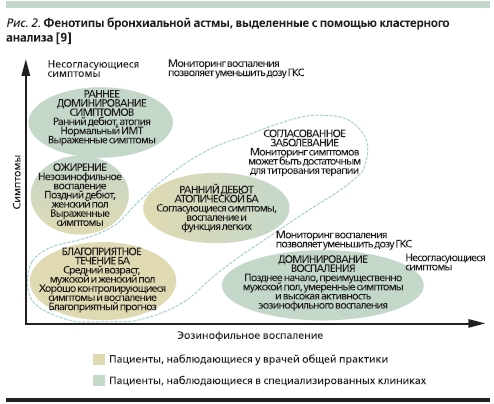
Среди больных, наблюдающихся у врачей-специалистов и отвечающих критериям рефрактерной БА, было идентифицировано 4 кластера. Первый и второй кластеры соответствовали таковым в популяции, наблюдающейся у врачей общей практики. Таким образом, было сделано заключение, что фенотип атопической БА с ранним дебютом и фенотип неэозинофильной БА, ассоциированный с ожирением, являются общими фенотипами для всей популяции больных астмой независимо от ее тяжести. Принципиальным различием между кластерами в каждой из популяций была разница в абсолютных значениях объективных критериев тяжести заболевания. Так, во второй группе больные фенотипом ранней атопической БА, отвечающие критериям рефрактерной астмы, имели более выраженные симптомы, нарушенную функцию легких и более значимое эозинофильное воспаление на фоне применения более высоких доз ингаляционных ГКС, чем пациенты того же фенотипа, наблюдающиеся у врачей общей практики. Третий и четвертый кластеры рефрактерной БА проявляли существенную диссоциацию между выраженностью эозинофильного воспаления и симптомами. Третий кластер включал больных с ранней астмой, проявляющейся выраженными симптомами с минимальным эозинофильным воспалением. В четвертый кластер вошли преимущественно мужчины с поздним дебютом БА, проявляющейся умеренными симптомами с выраженным эозинофильным воспалением. Кластеры были построены в соответствии с выраженностью симптомов БА и воспаления, потому что именно эти параметры являются клинически значимыми и изменяемыми признаками заболевания. График показывает, что несоответствие выраженности симптомов и интенсивности подлежащего воспаления более характерно для больных, наблюдающихся в специализированных клиниках (все эти пациенты отвечали критериям рефрактерной БА), и хотя причины этой диссоциации не ясны, мониторинг воспаления дыхательных путей у этих больных клинически информативен и терапевтически значим. Этим пациентам для подбора и коррекции терапии недостаточно оценки выраженности симптомов БА и необходимо проводить оценку выраженности воспаления, на основании которой следует титровать дозу ингаляционных ГКС.
Другой кластерный анализ был проведен в ходе Американской программы по исследованию тяжелой БА (Severe Asthma Research Program, SARP) [10]. И хотя в этих двух анализах использовались различные переменные, их результаты имели больше сходства, чем различий (табл. 2). Так, в обоих исследованиях было выделено 3 кластера атопической БА с дебютом в детском возрасте (кластеры 1, 2, 4), фенотип БА, сочетающийся с ожирением, представленный преимущественно женщинами с поздним дебютом БА (кластер 3), и фенотип тяжелой БА с поздним дебютом и выраженным нарушением функции легких (кластер 5).
Биофенотипы БА
Биофенотипы БА, или воспалительные фенотипы БА, отражают тип воспаления дыхательных путей, точнее – преимущественный тип клеток, вовлеченный в это воспаление. Исследования индуцированной мокроты, проведенные среди взрослых больных БА, наиболее постоянно выявляют два типа воспаления: эозинофильное и неэозинофильное. Некоторыми исследователями предлагается выделять 4 типа воспаления при БА: эозинофильное (эозинофилы > 3 % в индуцированной мокроте), нейтрофильное (нейтрофилы > 61 %), смешанное гранулоцитарное (эозинофилы > 3 % + нейтрофилы > 61 %) и малогранулоцитарное (эозинофилы и нейтрофилы в пределах нормы) [11]. Эозинофильная БА – наиболее известный фенотип. Существует множество исследований, выявивших преимущественно эозинофильный тип воспаления дыхательных путей по крайней мере у половины больных БА. Вместе с тем ингаляционные ГКС эффективно подавляют эозинофилию мокроты, что может существенно искажать результаты исследований. Эозинофильное воспаление определяется у больных атопической, неатопической, аспириновой [12] и профессиональной [13] астмой, т. е. этиологический триггер, вероятно по крайней мере у взрослых, не определяет тип воспаления при БА.
Персистирующее эозинофильное воспаление находят у больных тяжелой БА, и его наличие тесно связано с риском тяжелых обострений астмы [14, 15]. Еще более значимо определение типа воспаления в качестве ориентира для выбора терапии.
Другой биологический фенотип БА характеризуется преимущественно нейтрофильным воспалением. Этот тип воспаления нередко находят при аутопсии пациентов, умерших в результате тяжелого обострения БА [7]. Механизм нейтрофильного воспаления до конца не ясен, предполагают, что оно может развиваться в слизистой оболочке дыхательных путей в ответ на сигаретный дым, аэрополлютанты, профессиональные сенсибилизаторы (особенно мелкие корпускулярные частицы или изоцианаты), вирусы и бактерии (рис. 3). Нейтрофильный тип воспаления дыхательных путей при БА ассоциирован с повышением уровней интерлейкина-8, нейтрофильной эластазы и высокомолекулярной формы матриксной металлопротеиназы-9; последнее свидетельствует о снижении активности тканевых ингибиторов матриксных металлопротеиназ [16, 17]. Активация этих энзимов может модифицировать структуру дыхательных путей и обусловливать прогрессивное снижение функции легких. В любом случае нейтрофильное воспаление при БА связано со значительным ослаблением ответа на терапию ингаляционными и пероральными ГКС [18, 19]. Кроме того, сама терапия высокими дозами ГКС (прежде всего системная) может приводить к девиации воспаления в сторону преобладания нейтрофильного типа, т. к. ГКС способны тормозить апоптоз нейтрофилов, что было показано в исследовании in vitro [20, 21]. В настоящее время не определен маркер нейтрофильного воспаления при БА, который мог бы служить критерием эффективности терапии.
Малогранулоцитарный биофенотип БА наименее изучен. Он характеризуется отсутствием значимого числа воспалительных клеток, таких как эозинофилы, нейтрофилы и лимфоциты, в дыхательных путях больных БА. Высказывается несколько предположений относительно этого биофенотипа. Возможно, это просто результат отсутствия воспалительных клеток в биопсийном материале, в таком случае можно говорить о “псевдомалогранулацитарном биофенотипе”, а быть может, это нетрадиционное воспаление, которое формируется активацией резидентных клеток – тучных, эпителиальных и гладкомышечных [7]. Не исключено, что малогранулоцитарный тип воспаления может быть транзиторным [22]. Не существует биомаркера этого фенотипа, выявляется он методом исключения эозинофильного и нейтрофильного типов воспаления БА.
Фенотипы и терапия БА
Целевая фенотип-специфическая терапия БА является активно изучаемой проблемой в многочисленных клинических исследованиях эффективности биологических молекул при БА. Определение самых простых этиологических фенотипов БА является абсолютно необходимым требованием при проведении одного из видов фенотип-специфического лечения астмы. Лечение, модифицирующее болезнь, включающее элиминационные мероприятия и аллерген-специфическую иммунотерапию (АСИТ), является абсолютной прерогативой атопического фенотипа БА. АСИТ может быть альтернативой длительной поддерживающей терапии ингаляционными ГКС пациентов с легкой персистирующей атопической БА, особенно при сочетании с аллергическим ринитом. Мета-анализ 75 клинических исследований эффективности подкожной АСИТ при БА (общее число пациентов – 3506, с БА – 3188) продемонстрировал при ее применении ослабление симптомов астмы, сокращение потребности в бронхолитической терапии, значительное снижение специфической и неспецифической бронхиальной гиперреактивности по сравнению с плацебо [23]. Мета-анализ 25 клинических исследований сублингвальной АСИТ при БА (1706 пациентов) также продемонстрировал клиническую эффективность данного метода при атопической астме [24].
Анти-IgE-терапия с помощью селективного иммунодепрессанта омализумаба (КсоларR) – еще один пример фенотип-специфического лечения. Больные, относящиеся к фенотипу тяжелой атопической БА, составляют от 40 до 50 % всех пациентов с тяжелой астмой [25], и, по данным анализа Moore [10], этот фенотип развивается из легкой и среднетяжелой атопической БА. Пациенты, относящиеся к этому фенотипу тяжелой БА, имеют широкий спектр сенсибилизации к аллергенам, высокий уровень IgE в крови и отягощенный семейный анамнез по астме. Именно эта БА является в настоящее время целевым фенотипом для анти-IgE-терапии [26]. Недавний обзор 8 плацебо-контролируемых исследований применения омализумаба больными среднетяжелой и тяжелой атопической БА показал достоверное снижение частоты обострений и достижение лучшего контроля БА при применении этого препарата [27]. Терапия омализумабом (КсоларR) способствует снижению дозы ГКС. Этот препарат, являющийся моноклональным антителом к IgE, следует рассматривать в качестве дополнительного средства лечения больных атопической БА, не достигших адекватного контроля, несмотря на прием высоких доз ингаляционных ГКС и длительно действующих β-адреноагонистов.
Таким образом, БА – это гетерогенное по своей природе и вариабельное по своему течению заболевание. Выделение клинических и биологических фенотипов БА определяет индивидуальный подход к ведению каждого пациента с целью достижения максимально возможного уровня контроля заболевания.



