Обоснование
Коронавирусная инфекция – заболевание, вызванное новым β-коронавирусом, который был впервые обнаружен в декабре 2019 г. Коронавирусное заболевание 2019 г. (COVID-19) быстро распространилось во всем мире. Основным осложнением COVID-19 являются пневмония и острый респираторный синдром (SARS), приводящие к летальному исходу. Распространение инфекции среди населения происходит стремительно быстро вследствие передачи вируса воздушно-капельным путем [1].
Течение и степень тяжести COVID-19 зависят от коморбидного фона больных. При наличии двух и более коморбидных заболеваний увеличивается риск тяжелого течения коронавирусной инфекции и ее летального исхода [2, 3]. Прогноз инфекции COVID-19 может ухудшать сопутствующая патология (артериальная гипертензия, хроническая обструктивная болезнь легких, сахарный диабет, сердечно-сосудистые заболевания и ожирение) [4, 5].
По данным обзора, бронхиальная астма (БА) может быть фактором, определяющим тяжесть COVID-19 [6]. Распространенность астмы в Испании составляет 6,3% населения, среди госпитализированных лиц с инфекцией COVID-19 – 8,4% [7]. Распространенность БА среди пациентов с COVID-19 в США колеблется от 7,4 до 17% [8–10], в Китае – 2,4% [11], в Италии менее 3,0% [12].
БА – распространенное респираторное заболевание, характеризующееся хроническим воспалением дыхательных путей, гиперпродукцией слизи, гиперреактивностью и ремоделированием бронхов.
Предполагалось, что пациенты наиболее уязвимы в отношении COVID-19 вследствие снижения противовирусной защиты и имеющихся изменений врожденного иммунитета. Доказанная роль респираторных вирусных инфекций как триггеров, так и индукторов заболевания вызывала тревогу в отношении повышенной восприимчивости пациентов с БА к коронавирусной инфекции и ее течения. Однако проведенные исследования не показали высокой распространенности БА среди пациентов с COVID-19 [13, 14].
В основе патогенеза БА лежит Th-20-тип иммунного ответа, в котором принимают участие цитокины (интерлейкин-4 – ИЛ-4, -13 и -9), обладающие противовоспалительным действием [15]. Например, ИЛ-4 может не только подавлять развитие Th1-клеток из стадии активации Th0 лимфоцитов, но и ингибировать продукцию множества провоспалительных цитокинов, включая ИЛ-1β, фактор некроза опухоли-α (ФНО-α), ИЛ-6 и -12 [16, 17]. Описано, что ИЛ-13 обладает иммунорегуляторным действием за счет ингибирования секреции провоспалительных цитокинов (ИЛ-1α, -1β, -6 и ФНО-α) и хемокинов (ИЛ-8, MIP-1α и-1β и хемотаксический белок моноцитов-3) [18]. Кроме того, ИЛ-9 снижает секрецию ФНО-α и ИЛ-10, но увеличивает секрецию трансформирующего фактора роста-β (TGF-β) на LPS-активированных моноцитах [19]. Возможно предположить, что преобладание цитокинов Th-2-типа может в некоторой степени противодействовать накоплению провоспалительных цитокинов, препятствуя развитию цитокинового шторма при заболевании COVID-19.
Таким образом, вопрос о влияние БА на течение инфекции COVID-19 остается малоизученным.
Цель исследования: ретроспективный анализ течения инфекции COVID-19 у больных БА.
Методы
Проанализировано 1167 историй болезни больных, перенесших COVID-19 в ГБУЗ «Клиническая больница № 4» Пензы.
Диагноз COVID-19 выставлялся на основании верификации РНК SARS-CoV-2 с применением метода амплификации нуклеиновых кислот (МАНК) в мазках носоглотки и ротоглотки, согласно временным методическим рекомендациям [20]. Всем больным была выполнена спиральная компьютерная томография (КТ) при поступлении в стационар. У всех больных выявлена двусторонняя интерстициальная пневмония с различным объемом поражения легочной ткани от 25% и более.
Результаты
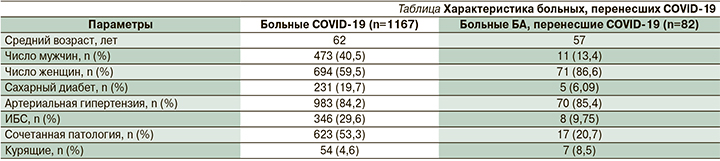
При изучении документации 1167 пациентов с COVID-19, из них 82 страдали БА, что составило 7,02%. Средний возраст больных COVID-19 составил 62 года, больных БА – 57 лет. Среди всех больных COVID-19 мужчины составили 473 (40,5%) человека, женщины – 694 (59,5%). Среди больных БА мужчин было 11 (13,4%) , женщин – 71 (86,6%). Средняя длительность течения БА составила 12,3 года. Больные COVID-19 имели сопутствовавшую патологию: сахарный диабет (СД) выявлен у 231 (19,7%) человека, артериальная гипертензия (АГ) – у 983 (84,2%), ишемическая болезнь сердца (ИБС) – у 346 (29,6%). Среди больных БА СД встречался у 5 (6,09%) человек, АГ – у 70 (85,4%), ИБС – у 8 (9,75%). Сочетанная патология установлена у 623 (53,3%) больных COVID-19 и у 17 (20,7%) больных БА. Курящих выявлено 54 человека среди больных COVID-19 и среди больных БА – 7 человек (см. таблицу).
Летальный исход отмечен у 21 больного COVID-19, среди которых СД был у 4 человек, ИБС – у 12, АГ – у 5. Смерть среди больных БА наступила у 5 человек, из них 1 пациент с СД и 4 с ИБС.
Проведен анализ течения БА. Среднетяжелое течение БА наблюдалось у 17 (20,7%) больных, тяжелое – у 65 (79,3%). Все больные БА до инфекции получали базисную терапию в соответствии с Международным рекомендательным документом «GINA-2020» в эквипотентных дозах ингаляционными глюкокортикостероидами (ИГКС). Выбор доз ИГКС соответствовал степени тяжести заболевания. Средние дозы ИГКС получали 14 (17%), высокие дозы – 68 (83%) человек. У всех больных лечение включало комбинированную терапию: ИГКС в комбинации с длительно действующими β2-агонистами (ДДБА – длительнодействующие β2-агонисты).
Контролируемое течение БА наблюдалось у 12 (14%) больных БА, частично контролируемое – у 24 (30%), неконтролируемое – у 46 (56%). У 2/3 пациентов имелась потребность в препаратах скорой медицинской помощи (β2-агонисты короткого действия), применяли более 2 раз в неделю. Частота обострения заболевания 2 раза в год отмечена у 11 (13,4%) больных. Необходимость приема системных ГКС в течение года возникала у 14 (17%) больных в связи с обострением заболевания. Тяжелые обострения БА за последний год наблюдались у 9 (11%) больных. Неконтролируемое течение БА способствует тяжелому течению COVID-19 и риску летального исхода.
Среднетяжелое течение COVID-19 проявлялось повышением температуры тела выше 38°C, дыхательной недостаточностью (одышка, SpO2<95%), объемом поражения легочной ткани –
КТ 1–2, повышенным уровнем С-реактивного белка сыворотки крови и наблюдалось у 45 (54,8%) больных. Тяжелое течение COVID-19 (выраженная дыхательной недостаточностью, КТ 3–4) выявлено у 21 (25,6%) пациента. В отделение реанимации находились 16 (19,6%) больных БА, из них 14 находились на неинвазивной вентиляции легких и двое на искусственной вентиляции легких. Все 16 больных находившихся в ОРИТ, имели тяжелое течение БА в анамнезе, из них у 4 человек было 2 обострения за последний год. Очевидно, что у пациентов преобладала БА персистирующего неконтролируемого течения. Контроль БА определяет тяжесть клинического течения COVID-19 и неблагоприятный исход.
Все больные получали противовирусную терапию фавипировиром по схеме, антикоагулянтную терапию и системные ГКС. В соответствии с клиническими рекомендациями по диагностике и лечению COVID-19 (версия 9 от 26.10.2020) таргетная терапия проведена 37 больным, из них 9 больным введен олокизумаб в количестве 0,4 мл подкожно и 28 – тоцилизумаб 400 мг внутривенно капельно [20]. Базисная терапия больных БА была продолжена во время заболевания COVID-19.
Проанализированы лабораторные показатели крови: число лейкоцитов, лимфоцитов и эозинофилов у больных, перенесших COVID-19. Отмечены лабораторные изменения крови, характерные для коронавирусной инфекции. Выявлено, что у пациентов с лейкоцитозом и повышенным абсолютным числом нейтрофилов, лимфопенией, а также эозинопенией (абсолютное число эозинофилов менее 0,02×109 кл/л) отмечалось более тяжелое течение инфекции. Эозинопения вплоть до полного отсутствия клеток в анализе крови наблюдалась у трети пациентов. Возможно, снижение числа эозинофилов является прогностически неблагоприятным предиктором тяжелого течения COVID-19. Эозинофилы, являясь важными иммунокомпетентными клетками в защите организма от патогенов, способствуют переключению иммунного ответа в сторону Тh2-фенотипа и препятствуют массивному выбросу провоспалительных цитокинов, определяющих тяжесть течения коронавирусной инфекции.
Обсуждение
В результате проведенного исследования выявлен более высокий процент женщин среди инфицированных пациентов с БА по сравнению с мужчинами. Из проанализированных сопутствовавших заболеваний АГ наиболее часто встречалась в обеих группах больных, СД и ИБС были аналогичными по соотношению. Курящих пациентов отмечалось больше в группе больных БА.
В литературе нет единого мнения, согласно котоому БА является коморбидным состоянием, способствующим более тяжелому течению инфекции COVID-19 [6]. Данные исследования показывают, что среди больных БА ниже смертность при COVID-19. Можно предположить, что одним из целевых механизмов проникновения вируса в клетку-хозяина является рецептор ангиотензинпревращающего фермента 2 (АПФ2), процесс, зависящий от протеазы TMPRSS2, что обеспечивает адгезию белка шипа и выполнение слияния вируса и мембранных клеток [21]. Авторы предполагают, что базисная терапия ИГКС при БА может иметь защитный механизм за счет снижения экспрессии рецептора АПФ2 и белка TMPRSS2, хотя для подтверждения необходимы дополнительные исследования [22]. На сегодняшний день больным БА рекомендуют продолжать лечение, стараясь достичь наилучшего терапевтического эффекта. Авторы предполагают, что БА не может быть предрасполагающим или усугубляющим фактором для течения COVID-19[13, 14, 23].
Вирусные инфекции, в т.ч. COVID-19, являются триггером для обострения БА [24–26]. Дыхательная недостаточность, вероятно, будет обусловлена не только объемом поражения легких, но и степенью тяжести бронхообструкции как клинического проявления астмы.
Известно, что эозинофилы играют центральную роль при аллергических заболеваниях, включая астму. Исследования показали потенциальную роль эозинофилов в обеспечении нейтрализации вируса и противовирусной защиты хозяина [27]. Отмечена роль эозинофилов в защите организма от вирусной инфекции [28]. Возможно, Тh2-фенотип иммунного ответа и способность к гиперпродукции эозинофилов у больных БА объясняют низкую распространенность БА среди пациентов с COVID-19. Интересные данные по эозинофилам в крови получены в исследовании Zhang et al., где более половины пациентов, поступивших с COVID-19 (53%), имели эозинопению в день госпитализации [14]. Аналогичным образом в ретроспективном исследовании летальных случаев COVID-19 авторы отметили, что 81% пациентов имели абсолютное число эозинофилов ниже нормального диапазона на момент госпитализации [29].
Таким образом, на сегодняшний день нет однозначного мнения о роли эозинофилов на течение инфекций COVID-19 у больных БА. Патофизиология эозинопении при COVID-19 остается неясной, но, вероятно, является многофакторной, включая ингибирование выхода эозинофилов из костного мозга, блокаду эозинофилопоэза, снижение экспрессии хемокиновых рецепторов/факторов адгезии [30] и/или прямой апоптоз эозинофилов, индуцированный интерферонами типа 1, высвобождаемыми во время острой инфекции [31].
Заключение
Проведенный анализ показывает, что распространенность БА составляла 7,02% от общего числа инфекций COVID-19. АГ была наиболее ассоциированным сопутствовавшим заболеванием, проанализированным в обеих группах. Выявлена разница в смертности, которая была ниже у больных БА. Течение COVID-19 зависит от степени тяжести и контроля БА. Эозинопения может носить компенсаторных характер и быть маркером тяжелого течения коронавирусной инфекции, что в большей степени отмечено среди больных COVID-19 без сопутствовавшей БА.
Наше исследование носит ретроспективный характер, что ограничивает его возможности. Подводя итог выше сказанному, распространенность больных БА среди пациентов с COVID-19 незначительна. Лечение, направленное на повышение контроля БА, должно стать целеполагающим для обеспечения безопасности больных БА в отношении заражения коронавирусной инфекцией и ее тяжелого течения.



