Введение
Достижения последнего десятилетия в области молекулярной и клеточной биологии открывают широкие перспективы для создания принципиально новых и эффективных биомедицинских технологий, позволяющих решать проблемы диагностики и лечения заболеваний внутренних органов, прежде всего коморбидных состояний, с учетом новых доказательных данных. За последние годы частой клинической ситуацией стало сочетание бронхиальной астмы (БА) и гастроэзофагеальной рефлюксной болезни (ГЭРБ) [1, 2], что определяет высокую распространенность симптомов ГЭРБ среди больных БА, взаимное влияние этих патологических состояний друг на друга [1] и рост числа их тяжелых форм. Известно, что ГЭРБ может не только проявляться симптомами поражения пищевода, но и служить причиной различных внепищеводных проявлений [2]. Бронхиальная астма и ГЭРБ имеют разную этиологию, однако формирование воспаления в бронхо-легочной системе при данных состояниях [3, 4] обусловлено общим патогенетическим компонентом – нарушением иммунного ответа в форме дисбаланса между клеточным Th1- и гуморальным Th2-звеньями иммунитета [5]. Поэтому углубленное изучение клеточных патогенетических механизмов развития данных заболеваний имеет высокую научную и практическую значимость.
Важную роль в патогенезе заболеваний с воспалительным компонентом в бронхо-легочной системе играют альвеолярные макрофаги (АМ) М1- и М2-фенотипов, а одним из ключевых регуляторов функций АМ является сурфактантный белок D (SP-D) [6, 7]. Макрофаги М1- и М2-фенотипов в зависимости от факторов микроокружения способны изменять свой фенотип [8], т.е. обладают фенотипической пластичностью. Мультифункциональная структура белка позволяет SP-D выступать в качестве бивалентного фактора контроля фенотипа макрофагов и определять двойственность иммунного ответа, обеспечивая возможность активации иммунного ответа провоспалительной или противовоспалительной направленности. Уровень SP-D и его олигомерный состав изменяются при различных заболеваниях легких, в связи с чем белок может быть использован не только как маркер повреждения легких, но и как агент воздействия на патогенетические звенья воспалительной реакции.
Несмотря на существующие методы терапии заболеваний бронхо-легочной системы, не всегда достигается необходимый эффект от проводимой терапии и улучшение прогноза пациентов, страдающих заболеваниями с воспалительным компонентом, хотя методы терапии и основываются на общепринятых принципах комплексности и преемственности лечения больных. Поэтому чрезвычайно актуальным и приоритетным направлением представляется проблема персонализации к подходов терапии с учетом клеточно-молекулярных механизмов формирования воспалительной реакции, а именно фенотипической пластичности макрофагов, позволяющих достигать определенного баланса М1-/М2-фенотипов макрофагов через факторы микроокружения, прежде всего SP-D.
Цель работы состояла в изучении и оценке клеточных и молекулярных механизмов формирования воспалительного компонента в бронхо-легочной системе при ГЭРБ, БА и их сочетании по анализу функционального фенотипа АМ и роли SP-D соответственно.
Материал и методы
Характеристика групп обследуемых
В исследовании использован биологический материал 56 человек, из которых у 46 по результатам проведения фибробронхоскопии (ФБС) выявлен воспалительный компонент в бронхо-легочной системе при БА, ГЭРБ и их сочетании, и 10 практически здоровых обследуемых – контрольная группа.
В группы исследования вошли больные БА персистирующего течения (n=15, 48,2±3,3 года), ГЭРБ (n=15, 46,4±4,2 года), их сочетанием (n=16, 49,3±3,6 года).
В исследование включены лица мужского и женского пола в возрасте 18–70 лет, некурящие, с установленными диагнозами: персистирующей БА (в соответствии с рекомендациями Глобальной стратегии лечения и профилактики бронхиальной астмы, GINA, 2011) [9], ГЭРБ (диагностические критерии в соответствии с клиническими рекомендациями Российской гастроэнтерологической ассоциации – РГА) [10], сочетанной патологией ГЭРБ и БА, все пациенты в стадии неполного медикаментозного контроля (сохранение респираторных симптомов на фоне терапии) на момент включения в исследование; с подтвержденными при ФБС воспалительными изменениями бронхо-легочной системы. У пациентов группы сочетанной патологии БА и ГЭРБ в 80% случаев первично была диагностирована БА, а при проведении дополнительных методов обследования выявлена ГЭРБ. Диагнозы были установлены на основании клинических, инструментальных и лабораторных методов исследования в соответствии с принятыми диагностическими критериями. Все обследуемые перед проведением инвазивных процедур ФБС и эзофагогастродуоденоскопии подписывали форму информированного согласия. Протокол исследования одобрен этическим комитетом ГБОУ ВПО МГМСУ им. А.И. Евдокимова Минздрава России.

Группу контроля составили клинически здоровые добровольцы в возрасте 18–62 лет, мужского и женского пола без патологии органов дыхания, желудочно-кишечного тракта и наличия других критериев исключения; не применявшие гормональные препараты в течение 6 месяцев до включения в исследование.
В исследование не включались пациенты с наличием в анамнезе острых сердечно-сосудистых событий, недостаточности кровообращения IIБ–III стадий, жизнеугрожающих нарушений ритма сердца, неконтролируемой артериальной гипертензии, дыхательной недостаточности III ст., онкологических заболеваний, туберкулеза, острых инфекционных заболеваний, заболеваний соединительной ткани с изменениями функции дыхательной системы, заболеваний крови, сахарного диабета, беременные или кормящие грудью.
Терапия пациентов группы исследования соответствовала клиническому статусу и симптоматике. В группе БА объем терапии пациентов основывался на клиническом течении заболевания и существующих стандартах терапии в зависимости от тяжести течения БА. Пациенты с БА персистирующего течения получали ингаляционные глюкокортикостероиды (ИГКС) в средних дозах 800–1500 мкг в пересчете на беклометазона дипропионат и β2-агонисты пролонгированного действия.
Больным ГЭРБ проведена терапия антисекреторными средствами – блокаторами протонной помпы (омепразол, 20–40 мг/сут). При сочетанной патологии БА и ГЭРБ больные получали ИГКС в средних дозах 800–1500 мкг в пересчете на беклометазона дипропионат, β2-агонисты пролонгированного действия (базисная терапия БА), блокаторы протонной помпы (20–40 мг омепразола в сутки) для поддерживающей терапии ГЭРБ.
Методики, использованные при проведении экспериментов in vitro
Выделение АМ. Альвеолярные макрофаги были выделены из бронхо-альвеолярной лаважной жидкости (БАЛЖ) мышей, больных и клинически здоровых лиц. Для получения БАЛЖ у мышей в легкие через внутритрахеальный катетер 4 раза вводилось по 1 мл стерильного фосфатного буфера с температурой +37°С [11]. Альвеолярные макрофаги больных и клинически здоровых лиц были выделены из БАЛЖ, полученной в результате проведенной фибробронхоскопии [12]. Полученная БАЛЖ центрифугировалась (Heraeus-biofuge primo R, Германия) 4 минуты при 1000 об/мин. Клеточный осадок ресуспендировали в 1 мл среды RPMI 1640 с доведением концентрации клеток в питательной среде RPMI 1640 до 1∙106/мл [13]. Одновременно с подсчетом количества клеток в камере Горяева производилось определение жизнеспособности АМ методом исключения красителя трипанового синего.
Культивирование АМ. Альвеолярные макрофаги в стерильных условиях помещались в лунки стерильных культуральных планшетов из расчета 0,5 млн макрофагов на 1 лунку 48-луночного планшета. Планшеты с АМ для культивирования помещались в СО2 инкубатор (Sanyo, Япония) при 37°С и 5% СО2. Через час культивирования во всех лунках с АМ производилась замена среды на следующую комбинацию: 0,5 мл RPMI 1640+сыворотка (FBS, 10%)+антибиотик (пенициллин/стрептомицин, 100 ЕД/мл/100 мкг/мл).
Планшеты вновь помещались в инкубатор при +37°С и 5% СО2 на 24 часа. Оценка клеточного компонента формирования воспалительной реакции в бронхо-легочной системе проводилась с учетом фенотипа макрофагов, определенного по рецепторной и секреторной характеристикам.
Определение поверхностных макрофагальных маркеров проводилось на проточном цитофлуориметре (Beckman Coulter FC500, США) после исходного выделения АМ, а также после процедуры репрограммирования клеток. Использованы моноклональные антитела к CD80, CD25, CD163, CD206 (Beckman Coulter; BD Pharmingen для CD163) [8]. Подготовка проб макрофагов для анализа проводилась по инструкциям производителя. Оценивали процентное содержание маркеров М1- и М2-фенотипов среди всех выделенных макрофагов у конкретного пациента.
Анализ секреторной характеристики фенотипа макрофагов проводился по продукции макрофагальных цитокинов. Уровень цитокинов в БАЛЖ и в культуральной среде после репрограммирования АМ экспериментальных животных, больных и клинически здоровых лиц оценивался методом проточной цитофлуорометрии (Вeckman Coulter FC500, США), набором для мультиплексного определения 10 цитокинов (BMS820FF) мыши и набором для мультиплексного определения 11 цитокинов (BMS810FF) человека в соответствии с инструкциями производителя. Анализ полученных данных проведен лицензированной программой разработчика FlowCytomix Pro ver. 3.0. Анализ молекулярного компонента формирования воспалительной реакции в бронхо-легочной системе проведен по определению качественного и количественного состава SP-D в БАЛЖ.
Уровень SP-D в БАЛЖ определен методом иммуноферментного анализа ELISA (BioVendor, кат. № 194-0591).
Результаты представлены с учетом уровня содержания общего белка в БАЛЖ пациентов, определенного методом Брэдфорда [14]. Качественный олигомерный состав SP-D в БАЛЖ оценен методом Вестерн-блот анализа на трис-ацетатных гелях (Invitrogen NuPAGE, cat# EA03752BOX) с помощью антител против SP-D, предоставленных Пенсильванским университетом (США).
Статистический анализ проведен программой Statistica 8.0 (Statsoft). Данные представлены в виде средних значений полученных показателей (М) и их ошибок (±m). Статистически значимыми считали различия при р<0,05.
Результаты
Изучение клеточных механизмов формирования воспалительной реакции в бронхо-легочной системе у пациентов с ГЭРБ, БА и при коморбидном состоянии проведено на основании анализа фенотипа АМ, выделенных из БАЛЖ пациентов. Оценка фенотипа АМ in vitro выполнена по следующим стандартным критериям фенотипа макрофагов: рецепторный – содержание на поверхности клеток макрофагальных СD маркеров М1- и М2-фенотипа, секреторный – продукция цитокинов макрофагами.
По результатам исследования у пациентов ГЭРБ было выявлено смещение баланса М1-/М2-фенотипов АМ в сторону М1-фенотипа. По сравнению с клинически здоровыми лицами на АМ при ГЭРБ достоверно возрастало содержание маркеров М1-фенотипа: СD80 – в 3,25 раза, и снижалось содержание М2-маркера: CD206 – в 1,21 раза (табл. 1).
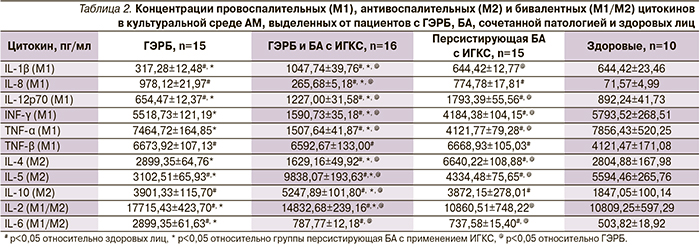
При анализе продукции цитокинов в культуре АМ больных ГЭРБ по сравнению со здоровыми выявлено наиболее значимое увеличение уровня таких М1-цитокинов, как IL-8 (в 13,8 раза), TNF-β (в 1,6 раза) и бивалентных М1-/М2-цитокинов – IL-6 (в 5,7 раза) и IL-2 (в 1,6 раза) (табл. 2).
При БА анализ указанных критериев фенотипа и сравнение с клинически здоровыми лицами выявили смещение М1-/М2-фенотипов АМ в сторону М2. Наличие дисбаланса М1-/М2-фенотипов и его выраженность подтверждены увеличением содержания М2 поверхностных маркеров по сравнению с клинически здоровыми лицами: CD163 – в 2,00 и CD206 – в 1,32 раза, а также снижением содержания М1-маркеров: CD25 в 1,19 и CD80 в 1,13 раза (табл. 1). Изменения М1 и М2 цитокинового профиля по сравнению с клинически здоровыми лицами в БАЛЖ при БА носили разнонаправленный характер. Наиболее значимо по сравнению с клинически здоровыми лицами был повышен уровень М1 цитокина IL-8 (в 11 раз), но при этом суммарно уровень продукции антивоспалительных М2-цитокинов был достоверно выше, чем в группе здоровых: IL-4 – в 2,4, IL-10 – в 2,2 раза, а также отмечена тенденция к увеличению продукции бивалетных М1-/М2-цитокинов IL-2 и IL-6, более выраженная для IL-6 (табл. 2).
Дисбаланс М1-/М2-фенотипов АМ выявлен также при сочетании ГЭРБ и БА: по сравнению с клинически здоровыми лицами содержание АМ, имеющих маркеры М1-фенотипа, возросло на 16%, маркеры М2-фенотипа – на 79% (табл. 1). При сочетании ГЭРБ и БА по сравнению с клинически здоровыми отмечено преимущественное повышение уровня продукции М1-цитокинов (IL-1β, IL-8, IL-12p70, TNF-β) макрофагами, при этом наиболее значимое повышение продукции было характерно для IL-8 (в 3,7 раза), а также увеличение продукции бивалентных цитокинов М1/М2 с более выраженными изменениями продукции IL-2 по сравнению как со здоровыми лицами, так и с пациентами БА (в 1,4 раза соответственно). Кроме того, продукция таких М2-цитокинов, как IL-5 и IL-10, в группе сочетанной патологии наряду с пациентами с изолированной БА была повышена относительно здоровых лиц (табл. 2).
Сопоставление полученных результатов при оценке основных критериев фенотипа АМ при сочетанной патологии с больными ГЭРБ и больными БА свидетельствует о том, что присоединение ГЭРБ достоверно смещает фенотип макрофагов у пациентов с БА в сторону М1, что отражается увеличением CD25 и CD80 на АМ в 1,08 и 1,93 раза, а также изменением продукции цитокинов макрофагами в сторону увеличения уровня М1-цитокинов соответственно. Эти данные позволяют предположить, что более тяжелое течение БА при ее сочетании с ГЭРБ может быть обусловлено именно сдвигом фенотипа макрофагов в сторону провоспалительного М1-фенотипа и, соответственно, усилением выраженности воспаления в бронхо-легочной системе.
Анализ молекулярных механизмов трансформации фенотипа макрофагов при БА, ГЭРБ и их сочетании основывался на количественной и качественной оценке содержания сурфактантного белка D в БАЛЖ пациентов и был сопоставлен с результатами клинически здоровых лиц.

По сравнению со здоровыми лицами наибольшее снижение уровня SP-D в БАЛЖ определялось при ГЭРБ (в 3,4 раза), при сочетанной патологии уровень SP-D в БАЛЖ был ниже в 1,3 раза, а при БА уровень SP-D в БАЛЖ значимо превышал показатели клинически здоровых лиц (табл. 3). Кроме того, уровень SP-D в БАЛЖ при сочетанной патологии был в 2,7 раза выше, чем при ГЭРБ, но в 1,8 раза ниже, чем при БА. Полученные данные позволяют предположить, что присоединение ГЭРБ к БА приводит к снижению уровня SP-D в БАЛЖ.
При ГЭРБ и сочетанной патологии выявлены существенные нарушения олигомерного состава SP-D в БАЛЖ по сравнению со здоровыми лицами – в БАЛЖ при данных нозологиях отсутствовали тримерные и додекамерные формы белка (табл. 3). Анализ распределения олигомерных форм SP-D в БАЛЖ показал, что присоединение ГЭРБ к БА приводит к исчезновению в БАЛЖ тримерных и додекамерных форм SP-D по сравнению с БА (табл. 3).
Выраженное изменение олигомерного состава SP-D и его уровня при ГЭРБ и сочетанной патологии предопределяют изменения взаимодействия белка с АМ на рецепторном уровне и провоспалительную направленность его действия, что было подтверждено в ходе исследования при исходном определении фенотипов АМ и формировании дисбаланса М1-/М2-фенотипов при ГЭРБ и сочетанной патологии.
Обсуждение
Сохраняющийся рост заболеваемости населения болезнями органов дыхания, увеличение инвалидизации и преждевременной смертности среди данной категории больных [15] по-прежнему определяют важность проблем патогенеза заболеваний бронхо-легочной системы и разработки новых подходов к их лечении. Нередко течение заболеваний легких осложняется присоединением таковых других систем и органов. Особенно высока распространенность симптомов ГЭРБ среди больных БА, патологические состояния при этих заболеваниях имеют взаимное влияние друг на друга [1] и приводят к росту числа наиболее тяжелых форм. Данные заболевания имеют различную этиологию, однако в их развитии присутствует схожий патогенетический компонент: воспаление в бронхо-легочной системе [3, 4] и с учетом результатов исследований последних лет нарушение иммунного ответа в форме дисбаланса между клеточным Th1- и гуморальным Th2-звеньями иммунного ответа [5, 16].
Полученные данные в проведенном исследовании по изучению функциональных фенотипов АМ при ГЭРБ, БА и коморбидном состоянии – сочетании ГЭРБ и БА, а также проведенный анализ молекулярного механизма трансформации фенотипа макрофагов при указанных состояниях представляются чрезвычайно актуальными и могут быть основой для разработки приоритетных направлений в терапии заболеваний с учетом патогенетических механизмов, непосредственно направленных на коррекцию дисбаланса Th1-/Th2-звеньев иммунного ответа, через воздействие на начальные звенья формирования воспалительной реакции, что позволило бы достичь определенного баланса М1-/М2-фенотипов макрофагов через факторы микроокружения.
Установлено, что у больных ГЭРБ по сравнению с клинически здоровыми лицами дисбаланс М1- и М2-фенотипов АМ наиболее выражен в изменении содержания маркеров М1-фенотипа, а также изменении секреторной активности АМ, о чем свидетельствует изменение уровня продукции М1-/М2-цитокинов. При БА установлено увеличение содержания маркеров М2-фенотипа при незначительных изменениях содержания CD25 и CD80, а также увеличение продукции макрофагами М2-цитокинов, что согласуется с данными других исследователей о развитии иммунного ответа по Th2-типу при БА [17]. Полученные данные в проведенном исследовании указывают на причину развития иммунного ответа при БА по Th2-типу. Очевидно, это связано с тем, что при БА макрофаги имеют преимущественно М2-фенотип, запускающий Th2-адаптивный иммунный ответ [17]. Мы также можем предположить, что более тяжелый характер течения БА при ее сочетании с ГЭРБ обусловлен сдвигом фенотипа макрофагов в сторону провоспалительного М1-фенотипа и, соответственно, усилением воспаления. Усиление воспалительного процесса в легких действительно характерно для обострения БА [18]. Сочетанная патология ГЭРБ и БА характеризуется дисбалансом М1-/М2-фенотипов АМ, что проявляется в снижении содержания поверхностных М1-маркеров на 16% и повышении М2-маркеров на 79% по сравнению с клинически здоровыми лицами. При сочетании ГЭРБ и БА с применением базисной терапии ИГКС по сравнению с клинически здоровыми лицами изменяется и секреторная активность альвеолярных макрофагов, что выражается в измененном цитокиновом профиле с увеличением уровня продукции М1-цитокинов при сохраняющихся повышенных уровнях ряда М2-цитокинов.
При проведении фенотипирования макрофагов возникает один значимый вопрос: почему популяция макрофагов, полученная от одного больного, из одной порции БАЛЖ гетерогенна, т.е. содержит как М1-, так и М2-фенотипы, а не является монофенотипической? Отвечая на этот вопрос, можно предположить следующие причины. Во-первых, микроокружение АМ, которое определяет фенотип этих клеток, в разных участках бронхо-альвеолярного дерева различается, и этому действительно есть подтверждение [19]. Во-вторых, в процессе выполнения своих функций макрофаг постоянно меняет свой фенотип (фенотипический континуум) [20].
С учетом этого становится понятно, что в БАЛЖ содержатся макрофаги на разных стадиях фенотипической дифференцировки. И наконец, в третьих, в условиях культуры клеток макрофаги, находящиеся в кластерах, имеют округлую форму (морфологический критерий фенотипа макрофагов), т.е. имеют М1-фенотип, тогда как изолированно сидящие на пластике макрофаги обладают расплющенной формой (морфологический критерий фенотипа макрофагов), т.е. имеют М2-фенотип. Не исключено, что межклеточные контакты также могут играть роль в приобретении макрофагом того или иного фенотипа. Можно предположить, что в легких макрофаги также имеют различный характер расселения: одиночный или групповой, и тогда гетерогенность фенотипа макрофагов может быть обусловлена и этим фактором.
Не исключено, что различный характер морфологических изменений легких при развитии ГЭРБ, БА и сочетанной патологии может определять специфические особенности расселения макрофагов, что также способно вносить вклад в вариантность трансформации фенотипа макрофагов при этих заболеваниях. Действительно, анализ работ P.B. Bitterman et al., D.A. Campbell et al., F. Krombach et al., A. Pforte et al. [21, 22, 23] показывает, что при различных видах патологии легких происходит существенное изменение расселения АМ.
В настоящей работе проанализирована роль не только клеточных, но и молекулярных механизмов формирования воспалительной реакции в бронхо-легочной системе. Установлено, что компоненты микроокружения в достаточной мере способны влиять на фенотип иммунных клеток. В качестве компонента микроокружения АМ рассматривался сурфактантный белок D (SP-D). Известно, что, находясь в мономерной форме, SP-D может способствовать программированию макрофагов на М1-фенотип, а в мультимерной – на М2 [6].
Показаны изменение и различия олигомерного состава SP-D в группах больных ГЭРБ, БА и их сочетанием относительно здоровых лиц. При изученных заболеваниях с воспалительным компонентом в бронхо-легочной системе количественное содержание SP-D в БАЛЖ изменяется различным образом. Прежде всего это может быть объяснено различным морфологическим субстратом формирования поражения легких при указанных нозологических формах. Выявленные изменения олигомерного состава SP-D как одного из ведущих молекулярных факторов, влияющих на процесс фенотипирования макрофагов, позволяют конкретизировать важные клеточные и молекулярные звенья в концепции воспалительного ответа в бронхо-легочной системе и иммунного ответа в целом при данной патологии.
Локальные изменения качественного и количественного состава SP-D при заболеваниях с воспалительным поражением бронхо-легочной системы могут быть использованы в качестве дополнительных критериев диагностики заболеваний и при оценке тяжести клинического течения заболеваний у больных с поражением бронхо-легочной системы.
Заключение
Таким образом, ключевые особенности клеточно-молекулярного механизма формирования воспаления при ГЭРБ, БА и их сочетании обусловлены:
Смещением баланса фенотипов АМ при ГЭРБ в сторону М1-, при БА – в сторону М2-фенотипов по сравнению со здоровыми лицами. Сочетание ГЭРБ и БА характеризуется увеличением количества клеток с маркерами М1-фенотипа на 16%, а с маркерами М2-фенотипа – на 79% по сравнению с клинически здоровыми лицами.
Нарушением молекулярных механизмов фенотипирования АМ и последующим формированием «порочного круга» воспалительных изменений бронхо-легочного дерева, о чем свидетельствует изменение количественного и прежде всего олигомерного состояния SP-D при присоединении ГЭРБ к БА.
Полученные данные раскрывают новые аспекты клеточно-молекулярных механизмов формирования воспаления и новые мишени в персонифицированной терапии при ГЭРБ, БА и их сочетании.



