Введение
Важным аспектом педиатрии является усовершенствование иммунопрофилактики инфекционных болезней в соответствии с современными технологическими возможностями. В настоящее время респираторно-синтициальный вирус (РСВ) считается наиболее частой причиной тяжелого течения инфекционно-воспалительных заболеваний нижних дыхательных путей у детей раннего возраста. В этой возрастной группе РСВ является ведущей причиной госпитализации во время эпидемического сезона респираторных инфекций. Данные Всемирной организации здравоохранения свидетельствуют о том, что РСВ-инфекция является причиной по меньшей мере 4 млн смертей в год среди детей до 5 лет во всем мире [1]. Кроме того, РСВ не вызывает формирования стойкого иммунного ответа, что приводит к частому реинфицированию [2]. Особенно тяжело РСВ-обусловленные респираторные заболевания протекают у недоношенных детей на фоне несовершенного иммунного ответа и функциональных особенностей респираторного тракта. Было показано, что наиболее уязвимы в этом отношении дети первого полугодия жизни, рожденные до 35-й недели гестации [3]. Кроме того, к группе риска тяжелого течения РСВ-инфекции относятся дети с бронхолегочной дисплазией (БЛД) и гемодинамически значимыми врожденными пороками сердца (ВПС) первых двух лет жизни. Известно, что риск госпитализации по поводу тяжелого течения РСВ-инфекции в первые 6 месяцев жизни возрастает для недоношенных детей в 2 раза. Дети с ВПС на фоне РСВ-инфекции госпитализируются в 3, а дети с БЛД – в 13 раз чаще, чем доношенные дети, не имеющие хронической кардио-респираторной патологии [4, 5].
На первом месте в группе риска по тяжелому течению РСВ-инфекции стоят дети с БЛД, для которых высокая частота госпитализаций по поводу обострений заболевания, протекающих в виде РСВ-обусловленных бронхиолитов, нередко связана с необходимостью реанимационных мероприятий и возможностью летальных исходов. По данным канадских авторов, наблюдавших 260 больных БЛД, на фоне тяжелого течения РСВ-инфекции 80 % детей возвращаются к дополнительной оксигенации; треть детей нуждаются в реанимационных мероприятиях; 3,5 % – умирают [6]. На основании клинико-функционального мониторинга мы показали, что наибольшая тяжесть состояния детей с обострением БЛД отмечается в первом полугодии жизни, однако высокая вероятность госпитализации сохраняется до двух лет жизни [7]. Доказано, что к группе риска тяжелого течения РСВ-инфекции могут относиться дети с муковисцидозом и первичными иммунодефицитными состояниями [8, 9]. Считается, что практически каждый ребенок до двух лет жизни оказывается инфицированным РСВ [10].
В отношении РСВ-инфекции эпидемическая ситуация в регионах Российской Федерации (РФ), характеризующихся умеренным климатом, где проживает большинство населения страны, сопоставима с общеевропейскими данными. Так, в проспективном многоцентровом исследовании, проведенном в РФ в эпидемический сезон 2008/2009 гг., на основании тестирования экспресс-методом (иммунохроматографией) носоглоточных смывов на РСВ среди 519 детей до 2-летнего возраста, госпитализированных по поводу инфекций нижних дыхательных путей, положительные результаты были получены от 197 (38 %) [11].
При анализе течения РСВ-инфекции у этих больных были выявлены следующие факторы риска госпитализации, согласующиеся с данными мировой литературы [12, 13]:
• мужской пол;
• низкая масса тела при рождении (меньше 10 перцентиля);
• прекращение грудного вскармливания после 2 месяцев;
• календарный возраст менее 6 месяцев на момент развития РСВ-инфекции;
• контакт в семье с детьми школьного возраста;
• посещение детского сада;
• “пассивное курение”;
• высокая скученность населения в доме.
Кроме того, вероятность госпитализации детей, родившихся незадолго до начала или во время эпидемического сезона РСВ-инфекции, значимо выше, чем у детей, родившихся в другое время года [12, 14]. Проведенное исследование показало, что РСВ являлся основным этиологическим фактором, приводившим к госпитализации по поводу инфекций нижних дыхательных путей в РФ с октября 2008 по апрель 2009 г. [11].
Эпидситуация, сложившаяся в отношении РСВ, требовала разработки действенных профилактических мер. Созданные ранее вакцины против РСВ-инфекции оказались недостаточно эффективными [15]. Эффективной альтернативой стала пассивная иммунизация путем применения паливизумаба, представляющего принципиально новый класс препаратов, – гуманизированных моноклональных антител (иммуноглобулинов G), специфичных к белку слияния (белок F) РС-вируса с выраженным нейтрализующим и ингибирующим действиями на штаммы РСВ подтипов А и В. Молекула паливизумаба состоит из человеческих (95 %) и мышиных (5 %) последовательностей, принадлежащих к фармакологическому классу иммуноглобулинов.
На сегодняшний день это единственный препарат для специфической иммунопрофилактики РСВ-инфекции у детей высокого риска ее тяжелого течения:
• в возрасте до 6 месяцев, рожденных на 35-й неделе беременности и ранее;
• в возрасте до 2 лет, нуждавшихся в лечении по поводу БЛД в течение последних 6 месяцев;
• в возрасте до 2 лет с гемодинамически значимыми ВПС.
Следует отметить, что пассивная иммунизация принципиально отличается от активной (вакцинации), которая представляет собой введение антигена для стимуляции выработки в организме собственных антител и приводит к формированию стойкого иммунитета. Пассивная иммунизация в отличие от активной осуществляется при помощи введения готовых антител и имеет целью быструю компенсацию иммунологической незащищенности организма.
Паливизумаб с успехом применяется в 50 странах мира более 10 лет. За это время профилактические инъекции получили более 400 тыс. детей. Препарат зарегистрирован в РФ 16.02.2010 под названием “Синагис®” (регистрационный номер: ЛСР-001053/10) [16] и представляет собой лиофилизат для приготовления раствора для внутримышечного введения в флаконах по 50 и 100 мг; назначается паливизумаб из расчета 15 мг/кг массы тела ребенка для введения 1 раз в месяц в течение эпидемического сезона РСВ-инфекции. При условии продолжительности сезона с ноября по март показана эффективность 5 инъекций препарата.
Эффективность и безопасность паливизумаба первоначально были доказаны в двух крупных международных многоцентровых рандомизированных двойных слепых плацебо-контролируемых исследованиях: IMpact-RSV (n = 1502) и CHD (n = 1287). Ежемесячные внутримышечные инъекции паливизумаба в дозе 15 мг/кг ассоциировались со снижением частоты госпитализации на 55 % среди недоношенных детей и детей с БЛД и на 45 % среди детей с ВПС по сравнению с группой плацебо. Кроме того, среди пациентов группы паливизумаба зарегистрировано достоверное уменьшение числа дней РСВ-госпитализации, в т. ч. с необходимостью дополнительного кислорода, общего числа дней РСВ-госпитализации в отделении интенсивной терапии (ОИТ) и частоты помещения в ОИТ. Частота побочных эффектов в группе паливизумаба не отличалась от таковых в группе плацебо, что свидетельствует о безопасности и хорошей переносимости препарата недоношенными детьми, детьми с ВПС и БЛД [17, 18].
Результаты проведенного в 2011 г. мета-анализа 10 клинических исследований паливизумаба, включающих в общей сложности около 15 тыс. младенцев из групп риска тяжелого течения РСВ-инфекции, говорят о снижении у детей, которым проводилась пассивная иммунизация, показателей смертности и частоты госпитализации с РСВ. У недоношенных детей с гестационным возрастом менее 32 недель отмечено снижение общей смертности более чем в 4 раза (рис. 1). Частота госпитализации с РСВ-инфекцией у иммунизированных недоношенных детей, рожденных до 32-й недели гестации, была ниже в 3 раза, чем у детей контрольной группы (рис. 2) [21].
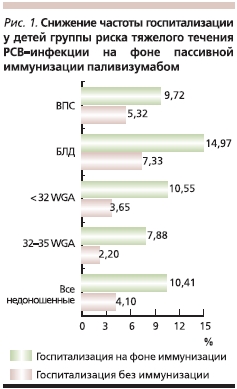
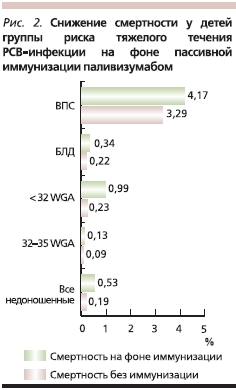
Результаты других проведенных исследований свидетельствуют о том, что тяжелый РСВ-бронхиолит, перенесенный на первом году жизни, значительно повышает риск развития бронхиальной астмы в более позднем детском возрасте [10]. Предотвращение РСВ-инфекций с помощью паливизумаба позволяет влиять на этот значимый фактор риска развития бронхиальной астмы в долгосрочном периоде.
На данный момент накоплен убедительный клинический опыт применения паливизумаба в России. Многоцентровое исследование безопасности и эффективности применения паливизумаба для профилактики РСВ-инфекции у 100 детей с высоким риском тяжелого течения заболевания, проведенное в 3 регионах РФ в течение 1 эпидемического сезона (с ноября 2009 по апрель 2010 г.), позволило прийти к выводу об эффективности использования препарата такими пациентами. Недоношенность (до 35-й недели гестации включительно) как единственный фактор риска отмечен у 24 детей и в сочетании с гемодинамически значимым ВПС у 1 ребенка в изучаемой группе. В исследовании преобладали дети с БЛД (46), причем 8 из них были недоношенными (до 35-й недели гестации включительно). Результаты исследования показали высокую эффективность применения паливизумаба для всех детей, получивших 3–5-кратное введение препарата в эпидемический сезон (94 ребенка). Тестирование на РСВ 6 больных, госпитализированных по поводу заболеваний органов дыхания в течение указанных 6 месяцев наблюдения, было отрицательным. Таким образом, в тот период не было зарегистрировано ни одной госпитализации по причине РСВ-инфекции. За тот же период было отмечено только три нежелательных явления, вероятно связанных с исследуемым препаратом: ринит и острый интермиттирующий ринит у одного пациента, а также атопический дерматит у другого пациента [21].
Собственные клинико-функциональные данные по трем предшествующим и текущему эпидсезону 2012/2013 гг. соответствуют мировому опыту применения паливизумаба и доказывают безопасность и эффективность его использования детьми группы риска тяжелого течения РВС-инфекции. В течение 4 сезонов в НЦЗД РАМН были иммунизированы и продолжают получать пассивную иммунизацию против РСВ-инфекции 122 ребенка в возрасте от 22 дней до 2 лет жизни, среди которых преобладают дети с БЛД (92), большинство из которых являются недоношенными, 4 из них имеют гемодинамически значимый порок сердца. Вторую по численности группу составляют недоношенные дети, рожденные до 35-й недели гестации включительно и не сформировавшие БЛД (27); кроме того, впервые в РФ иммунизированы паливизумабом 3 ребенка с муковисцидозом. Оценка функциональных данных 22 больных БЛД проводилась методом флоуметрии спокойного дыхания в состоянии естественного сна с использованием педиатрического модуля BabyBodyS в составе программно-аппаратного комплекса MasterScreen (VIASYS Healthcare, США) и регистрацией параметров дыхательного паттерна [22]. Было показано существенное улучшение бронхиальной проходимости на уровне периферических бронхов у пациентов, получивших иммунопрофилактику паливизумабом и не имевших обострения бронхолегочного процесса в течение эпидсезона.
Заключение
Эффективность и безопасность пассивной иммунизации против РСВ-инфекции доказаны многочисленными клиническими исследованиями за рубежом и подтверждены в условиях РФ. Включение иммунопрофилактики РСВ в комплексную терапию детей с последствиями перинатальной патологии способствует повышению эффективности восстановительного лечения данной категории больных, поскольку отсутствие тяжелых вариантов течения респираторных заболеваний позволяет этим детям увеличивать темпы психомоторного и физического развития.
Анализ мирового опыта применения паливизумаба, результатов многоцентровых исследований, проведенных в РФ в 2008–2010 гг., и собственные клинические данные позволяют нам прийти к заключению о необходимости применения препарата в группе высокого риска тяжелого течения РСВ-инфекции. Дети с БЛД и дети с гемодинамически значимыми ВПС, а также недоношенные дети, рожденные до 35-й недели гестации включительно, должны быть защищены от респираторно-синтициальной инфекции в возрастных периодах, наиболее опасных в плане возникновения тяжелого течения заболеваний нижних дыхательных путей, развития серьезных осложнений и риска летального исхода. Для недоношенных детей таким периодом является первое полугодие жизни, для детей с БЛД и ВПС – первые 2 года жизни. Особенно актуальна иммунопрофилактика РСВ-инфекции у детей с БЛД, поскольку заболевание имеет регрессивное течение и в отсутствие обострений бронхолегочного процесса повышается вероятность исхода в клиническое выздоровление, что подтверждается собственными клинико-функциональными исследованиями.
Таким образом, пассивная иммунизация паливизумабом детей первых двух лет жизни, относящихся к группе высокого риска тяжелого течения РСВ-инфекции, является безопасным и эффективным методом иммунопрофилактики, основанном на применении новых медицинских технологий в медицинской практике и приводящим к оптимизации качества жизни больных, уменьшению частоты хронизации бронхолегочных заболеваний и инвалидизации пациентов.



