В квантовой физике существует понятие “принцип неопределенности”, которое означает,
что невозможно одновременно и точно определять все свойства элементарной частицы. Нечто подобное в виде комплекса неопределенности существует и в гастроэнтерологии в отношении
хронического гастрита (ХГ).
За 30 лет, прошедших с момента появления первых работ Р. Уоррена и Б. Маршала в 1983 г., открытие роли бактерии Helicobacter pylori (НР) как основного этиологического фактора в развитии ХГ привело к формированию модернизированного представления об этиологии, этапах патогенеза, клинико-морфологических особенностях и вариантах прогноза этого заболевания. Твердо установлена патогенетическая взаимосвязь ХГ с язвенной болезнью двенадцатиперстной кишки, MALT-лимфомой желудка и раком желудка (РЖ), разработаны многочисленные схемы терапии.
В развитых странах Запада отношение медицинского сообщества к проблеме ХГ уже давно сформировалось, а на государственном уровне проводятся мероприятия по выявлению НР и проведению эрадикационной терапии. Это позволило во многих странах существенно снизить уровень заболеваемости язвенной болезнью и РЖ. В Австралии, например, диагноз язвы двенадцатиперстной кишки является казуистикой и встречается лишь в среде эмигрантов, приехавших из развивающихся стран [1].
Удивительно, что в России в преддверии 30-летия появления на свет доказательств инфекционной природы ХГ до сих пор продолжаются дискуссии на тему “Является ли НР патогеном или сапрофитом, или чем отличается ХГ от функциональной диспепсии?”[2]. Даже среди гастроэнтерологов есть врачи, которые “верят” или “не верят” в НР! Такой комплекс неопределенности в отношении ХГ ведет к тому, что распространенность заболевания продолжает оставаться высокой, а лечение не всегда бывает эффективным и своевременным. Развеять иллюзию о “банальности” ХГ помогают знания об особенностях течения воспалительного процесса в слизистой оболочке желудка (СОЖ), накопленные в огромном количестве научных публикаций по данному вопросу.
ХГ – воспаление желудка, а вернее СОЖ. Несмотря на многолетнее изучение проблемы, новейшие возможности диагностики и лечения, ХГ встречается среди 80 % взрослого населения. Широкая распространенность заболевания нередко вызывает сомнение у врачей и пациентов в целесообразно-
сти и перспективности его лечения.
Действительно, причин, приводящих к воспалению СОЖ, множество: факторы питания и окружающей
среды, лекарственные и лучевые воздействия, изменения СОЖ при таких заболеваниях, как глютеновая энтеропатия, саркоидоз, болезнь Крона и туберкулез, аутоиммунные заболевания. Однако самой частой причиной ХГ является НР. Хеликобактерные гастриты составляют 80–85 % от числа всех ХГ. Аутоиммунные и химические формы гастритов встречаются в 15–20 %. При этом в половине случаев они могут сочетаться с наличием НР.
Одной из первых особенностей ХГ является неспецифичность клинических проявлений и/или их отсутствие. Легкий дискомфорт в эпигастральной области, тяжесть после приема пищи, отрыжка не всегда служат поводом для обращения к врачу. В случае первичного посещения врача эти клинические симптомы не дают основания врачу выставлять диагноз гастрита, а диагноз функциональной диспепсии в данном случае может создавать комплекс неопределенности. На первом
этапе диагностического поиска заключение “синдром диспепсии, требующий уточнения”, более приемлемо и диктует необходимость комплексного обследования.
Основные его направления:
• проведение эндоскопического исследования;
• проведение гистологического исследования;
• установление статуса по НР-инфекции;
• определение в крови уровней пепсиногенов I и II типов, а также уровня гастрина-17.
Врач-эндоскопист должен описать увиденное, а затем попытаться изложить это в терминах клинического диагноза. Интерпретация данных с позиций клинического диагноза выражается в резюме (заключении) эндоскопического протокола. Следует заметить, что эндоскопическая терминология несколько отличается от терминологии гастроэнтерологической. В то время как описательная часть, как правило, приводится с высокой степенью объективности, резюме (заключение) часто включает субъективные взгляды исследователя.
Для характеристики изменений СОЖ следует использовать описательные термины (красная, застойная,
узловатая и др.). Для общей характеристики диффузных изменений СОЖ, хорошо различаемых при эндоскопии, используется термин “гастропатия”.
Искусством эндоскописта является умение правильно взять биопсию. Материал для гистологического исследования следует брать из различных топографических зон СОЖ: по 2 фрагмента из антрального отдела и тела желудка и один фрагмент из области малой кривизны. Только такой алгоритм получения биопсийного материала позволит правильно верифицировать гистологические изменения при ХГ.
Врач-патолог является тем звеном диагностического процесса, на котором, собственно, и происходит установление диагноза ХГ, т. к. он имеет возможность удостоверить факт наличия воспалительной инфильтрации СОЖ. Однако задачей патолога является не просто констатация факта, а проведение количественного учета обнаруженных изменений, оценка распространенности воспаления и состояния железистого аппарата СОЖ. Диагноз ХГ является, по существу, гистологическим заключением.
Ключевые диагностические критерии ХГ:
• активность воспаления;
• хронический характер воспаления;
• присутствие НР в СОЖ;
• атрофия желез;
• кишечная метаплазия.
Активность воспаления – это наличие и выраженность нейтрофильной инфильтрации. Хронический характер воспаления – наличие и выраженность лимфоплазмоцитарной инфильтрации.
Выявление НР при гистологическом исследовании считают “золотым” стандартом диагностики.
Преимущество гистологического метода состоит в том, что он позволяет не только обнаружить бактерии на поверхности СОЖ, но и определить количественно степень обсемененности [3].
Атрофия желез – потеря функционально активной ткани, является следствием длительно протекающего хронического воспалительного процесса. Возникновение атрофии – это первый морфологически верифицируемый этап канцерогенеза в желудке, впервые описанный П. Корреа [4].
Особенностью атрофии СОЖ является ее мультифокальный характер. По определению ВОЗ, атрофический гастрит признан предраковым состоянием: риск возникновения РЖ при его наличии возрастает в 5–6 раз. Риск РЖ тем выше, чем более выражена степень атрофии и чем больше объем
поражения.
Оценка выраженности этих изменений является важнейшей задачей патолога. Сиднейская классификация, сыгравшая позитивную роль в развитии учения о ХГ, уже не дает возможости точно охарактеризовать состояние СОЖ, оценить статус предраковых изменений и определить прогноз
заболевания, а следовательно, она не отвечает современным требованиям. В 2005 г. была разработана новая унифицированная классификация ХГ, получившая название OLGA (Operative Link for Gastritis Assessment) [5], основанная на интегративном принципе с выделением степени и стадии процесса с учетом топографии.
Степень ХГ отражает выраженность воспалительной инфильтрации СОЖ нейтрофилами, лимфоцитами, плазмоцитами. Она определяется по результатам полуколичественной оценки воспалительной инфильтрации фрагментов из антрального отдела и тела желудка (рис. 1).
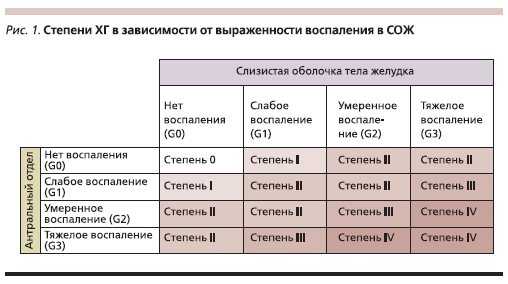
Стадия ХГ отражает выраженность атрофии, основываясь на результатах полуколичественного анализа нарушения структуры СОЖ, таких как уменьшение количества и снижение высоты пилорических и главных желез, наличие кишечной и пилорической метаплазии (рис. 2).
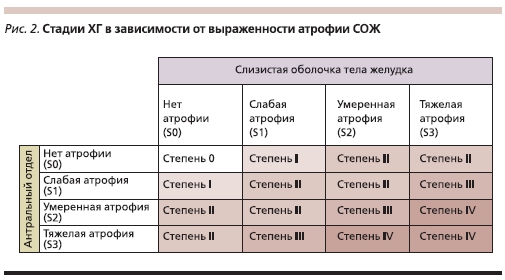
Прикладное значение классификаии OLGA очень велико, т. к. она дает в руки врача инструмент для оценки эффективности лечения. Сравнение степени ХГ до и после лечения позволяет лечащему врачу определить, удалось или нет снизить выраженность воспалительной реакции СОЖ.
Классификация OLGA позволяет стандартизировать прогноз ХГ и оценить риск развития РЖ в зависимости от стадии заболевания:
• стадия 0 – отсутствие риска;
• стадия I – минимальный риск;
• стадия II – умеренный риск;
• стадии III и IV – высокий риск.
Впервые введен дополнительный критерий – время, в течение которого происходит изменение стадии ХГ при длительном наблюдении за больными после лечения (успешной эрадикации HР).
За один и тот же промежуток времени возможны следующие варианты:
• стадия ХГ нарастает;
• стадия ХГ остается неизменной;
• стадия ХГ снижается [6].
Кишечная метаплазия – замещение желудочных желез железами кишечного типа с характерными для кишечного эпителия бокаловидными клетками. Выделяют два типа кишечной метаплазии – полную (тонкокишечную) и неполную (толстокишечную). По последним данным, клональный состав клеток из зон кишечной метаплазии идентичен тавовым дисплазированных желудочных желез, что подтверждает возможность развития дисплазии и РЖ при тяжелых формах атрофического гастрита. При кишечной метаплазии обнаружено изменение гистохимического профиля секретируемой слизи (MUC5/MUC6 – MUC2) [7]. Нормальная СОЖ обладает мощныммеханизмом защиты, которая оберега-
ет ее от действия канцерогенов и соляной кислоты. Первым препятствием на пути канцерогенов является желудочная слизь. Снижение ее продукции и изменение физико-химических свойств снижают защитные свойства слизистого барьера. Изменение гистохимических свойств слизи напрямую связано с инфекцией НР.
До недавнего времени большинством патологов отрицалась клиническая значимость определения типа кишечной метаплазии, а ее наличие в СОЖ трактовалось как простой маркер атрофии желудочных желез. За короткий период времени произошло переосмысление значимости кишечной метаплазии в канцерогенезе. Теперь благодаря использованию молекулярно-генетических методов
исследования установлено, что неполная кишечная метаплазия является одним из этапов желудочного канцерогенеза [8]. Она четко ассоциирована с III и IV стадиями ХГ и существенно повышает риск развития РЖ.
До конца 1990-х гг. считалось, что процессы атрофии желудочных желез и развития кишечной метаплазии имеют прогрессирующее течение без возможности самопроизвольного разрешения. Однако за последние годы были получены убедительные доказательства возможности обратного развития атрофии СОЖ после устранения причины ее хронического воспаления, т. е. эрадикации НР [9, 10]. Как показал мета-анализ 12 исследований, включивших 2658 пациентов, эрадикация НР приводит к существенному уменьшению атрофии в теле желудка, но не в антруме и не оказывает влияния на кишечную метаплазию [11, 12]. В других публикациях убедительно демонстрируется уменьшение распространенности и выраженности кишечной метаплазии в СОЖ после проведения курса антихеликобактерной терапии [13, 14]. Эти данные послужили стимулом для более углубленного изучения атрофического гастрита. Выявленные особенности его лекарственного патоморфоза открывают широкие возможности для профилактики РЖ кишечного типа при своевременном лечении.
В материалах Маастрихтского консенсуса IV, опубликованных в апреле 2012 г., подтверждено замедление прогрессирования атрофии при эрадикации НР, а в некоторых случаях показана ее обратимость [15]. Группа экспертов, обсуждавшая возможность профилактики РЖ, сделала вывод о том, что риск развития рака после эрадикации НР снижается (положение 9), причем он может быть снижен более эффективно при проведении эрадикационной терапии до развития пренеопластических изменений (положение 10). В настоящее время точкой невозврата в процессе желудочного канцерогенеза является наличие дисплазии желудочных желез. Для больных с дисплазией даже в случае достижения эрадикации после курса лечения не снижается риск развития РЖ и не наблюдается обратного развития явлений дисплазии [16].
Клинические исходы ХГ определяются его топографией. Известно, что НР, как правило, заселяет антральный отдел желудка и вызывает в нем воспаление. Хеликобактерный антральный гастрит
протекает с гиперсекрецией соляной кислоты, т. к. НР нарушает регуляцию кислотообразования через механизм обратной связи. При этом происходит гиперацидификация двенадцатиперстной кишки с возникновением участков желудочной (пилорической) метаплазии, на которых адгезируется НР.
Развивается бульбит и многократно повышается риск развития дуоденальной язвы. При фундальном гастрите развивается атрофия главных желез с утратой париетальных клеток и снижением продукции соляной кислоты. Повышается риск возникновения язвы желудка и дистального РЖ [17]. Последующее направление таких больных на эндоскопическое исследование и морфологическое подтверждение у
них наличия предраковых процессов в СОЖ (атрофический гастрит с кишечной метаплазией и дисплазией) позволяют мониторировать их состояние и существенно улучшать раннее выявление РЖ.
К сожалению, в практике отечественных врачей, включая специалистовгастроэнтерологов, не всегда имеется возможность проведения эндоскопии с морфологическим исследованием. Между эндоскопистами и лечащими врачами часто нет согласия в вопросе о необходимости взятия биопсии при эндоскопической картине поверхностного гастрита. В таких ситуациях важную роль могут сыграть скрининговые серологические методы выявления атрофического гастрита. Доказано, что повышение уровня гастрина-17, снижение уровня пепсиногена I и, соответственно, изменение соотношения
пепсиногенов I и II объективно отражают выраженность атрофии СОЖ, ассоциированной с возможным развитием РЖ. Методы серологического скрининга позволяют выявлять индивидуумов с высоким риском развития РЖ даже в популяциях, в которых это заболевание встречается редко.
По данным ВОЗ за 2008 г., заболеваемость и смертность от злокачественных заболеваний пищеварительной системы занимают первое место. По числу умерших здесь на первое место выходят страдающие РЖ [18]. Европейским обществом по гастроинтестинальной эндоскопии (ESCE), Европейской группой по изучению НР (EHSG), Европейским обществом патологов (ESP) и Португальским обществом эндоскопистов (SPED) разработаны рекомендации по ведению больных с
предраковыми изменениями в желудке. Отмечено, что выделение групп риска и динамическое наблюдение за больными с предраковыми процессами приводят к выявлению РЖ на ранних стадиях. Рекомендации были утверждены в июне 2011 г. в г. Порто (Португалия) [19]. Предложен алгоритм ведения таких больных (рис. 3). Из него следует, что эрадикация НР показана больным с атрофией в любом отделе желудка, при любой степени ее выраженности, с кишечной метаплазией и без нее.
Рисунок 3. Алгоритм ведения больных с предраковыми изменениями в желудке.
В данном руководстве определенароль эрадикации НР в лечении предраковых состояний и профилактике их развития:
1. Эрадикация НР приводит к излечению неатрофического гастрита и может привести к частичному
регрессу атрофического гастрита.
2. Эрадикация НР не влияет на обратное развитие кишечной метаплазии, но может замедлить прогрессирование ее в рак.
3. Эрадикация НР строго рекомендована пациентам с ранее выявленной неоплазией после эндоскопического и хирургического лечения.
Таким образом, эрадикация НР является ключевым звеном в лечении ХГ. Подходы к антихеликобактерной терапии сохраняют принципы, сформулированные в рекомендациях 1990-х гг., –
это трех- или четырехкомпонентные схемы с использованием не менее двух антибиотиков. Однако они претерпели ряд модификаций в связи с накоплением знаний по данной проблеме и ростом резистентности к традиционно используемым антибиотикам. Одним из главных факторов, оказывающих негативное влияние на эрадикацию, является рост резистентности к кларитромицину – основному компоненту схем лечения. Это нашло отражение в рекомендациях Маастрихтского
консенсуса IV, который поделил мир на регионы с низкой и высокой резистентностью НР к кларитромицину в популяции.
Резистентность НР к кларитромицину по данным последнего крупного европейского исследования, проведенного в 2008–2009 гг., была выявлена в 17,5 % случаев, тогда как в 1998 г. этот показатель находился на уровне лишь 9,9 % [20]. В России также существует ряд исследований, в которых получены данные о росте резистентности к кларитромицину.
Определение резистентности к кларитромицину возможно классическим бактериологическим, а также
молекулярно-генетическим методами. Проведение полимеразной цепной реакции (ПЦР) приобретает большое значение, позволяя выявлять точечные мутации в генах, ответственных за развитие резистентности. Ранее стоимость этого исследования была достаточно высокой, но в последние годы
она значительно снизилась. Это сделало ПЦР более доступной и позволяет рекомендовать ее к использованию в широких масштабах.
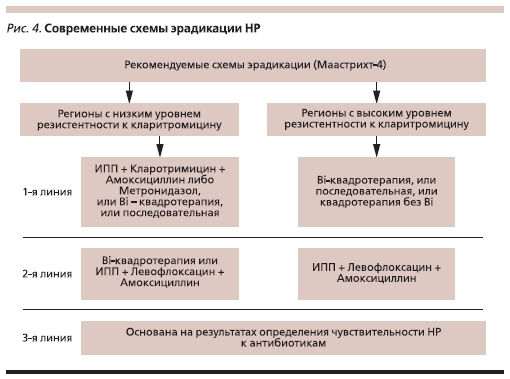
Схемы тройной терапии с ингибитором протонной помпы (ИПП) и двумя антибиотиками могут быть использованы только в регионах с низкой резистентностью (не более 15–20 %). В качестве альтернативы, даже при низкой резистентности к кларитромицину, целесообразно начинать лечение с добавлением к тройной терапии препаратов висмута (Bi). В регионах с высокой резистентностью Bi-содержащая квадротерапия признана основной. В случае неудачной первой попытки эрадикации может быть назначена тройная терапия с левофлоксацином, а в регионах с низкой резистентностью
к кларитромицину возможно повторение квадротерапии (рис. 4).
Антибактериальные свойства висмута известны давно. Это деградация НР вследствие образования белкового комплекса на бактериальной стенке, уменьшение подвижности НР, препятствие адгезии НР к клеткам эпителия СОЖ, ингибирование высвобождения бактериальных ферментов. По данным работ последних лет, добавление висмута к тройной терапии позволяет частично преодолевать резистентность к кларитромицину и улучшает результаты лечения [21].
Единственным препаратом висмута с высокой растворимостью в желудочном соке и слизи является трикалия дицитрат висмута (ВТД). Благодаря этим свойствам ВТД способен добираться до бактерий, расположенных в слое слизи и уничтожать их.
В ходе рандомизированного исследования, проведенного в ЦННИГ в 2008–2009 гг., осуществлена сравнительная оценка эффективности трех вариантов терапии хронического хеликобактерного гастрита. Первая группа больных получала стандартную тройную терапию (ИПП, кларитромицин,
амоксициллин); 30 пациентов второй группы наряду с указанными препаратами получали ВТД; 30 больным третьей группы была назначена монотерапия ВТД. Эффективность эрадикации в первой группе составила 73,3 %. Во второй группе добавление к тройной терапии ВТД обеспечило эффективность терапии на 93,3 %. Таким образом, добавление препарата висмута к тройной терапии увеличило эффективность эрадикации на 20 %. Монотерапия ВТД в течение 28 дней привела к эрадикации НР у трети (33,3 %) больных [22, 23]. У пациентов второй группы, принимавших ВТД, отмечалась более выраженная положительная динамика воспалительных изменений в СОЖ, а в третьей группе уменьшение степени воспалительной инфильтрации было отмечено у всех больных.
Комплекс неопределенности может поддерживаться данными о широком распространении НР в общей популяции (более 60 %), что усиливает сомнение в необходимости проведения массовой эрадикации. Среди пациентов и врачей бытует мнение о неизбежности повторного инфицирования после
излечения от НР-инфекции. Многих смущает длительность антихеликобактерных курсов (10–14 дней) и использование в схемах двух антибиотиков. Поэтому перед началом лечения следует предупреждать больных о том, что успешно проведенная эрадикация НР не ведет к моментальному полному
излечению от ХГ. Активность воспаления, проявлением которого является нейтрофильная инфильтрация, разрешается в течение месяца, а для разрешения лимфоцитарной инфильтрации требуется от нескольких месяцев до 2 лет. Результаты эрадикации НР можно достоверно оценивать не ранее чем через 4 недели после окончания приема препаратов.
В немалой степени преодолению комплекса неопределенности может способствовать назначение после успешной эрадикации НР гастропротективных препаратов. В раннем послеэрадикационном периоде это помогает разрешению активности воспаления, что позволяет достигать ремиссии ХГ, а
в позднем периоде способствует обратному развитию атрофических изменений (в случае их наличия).
Таблица. Сравнительная таблица препаратов для лечения хронического гастрита.
При этом фармакологические цитопротекторы должны обладать способностью стимулировать синтез простагландинов в желудке, увеличивать секрецию слизи и бикарбонатов, обладать антиоксидативным эффектом, улучшать кровоток в СОЖ, подавлять продукцию цитокинов клетками воспалительного инфильтрата, сохранять эпидермальный фактор роста. Этим требованиям отвечают препараты висмута (см. таблицу). В таблице приведены лекарственные препараты, влияющие на звенья патогенеза хронического гастрита. Сочетание антибактериальных и цитопротективных свойств позволяет эффективно использовать эти препараты как в схемах эрадикации, так и после нее. Именно наличие этих свойств делает ВТД препаратом выбора при лечении хронического атрофического гастрита.



