Введение
Своевременная диагностика и эрадикация Helicobacter pylori в настоящее время рассматриваются как приоритетная стратегия профилактики развития некардиального рака желудка, снижения риска рецидива язвенной болезни и излечивания от инфекционного хеликобактерного гастрита [1]. Сложности диагностики микроорганизма в России связаны с малой доступностью в большинстве регионов страны неинвазивных валидизированных высокочувствительных и специфичных методик верификации H. pylori – 13С-уреазного дыхательного теста и определения антигена хеликобактера в стуле с помощью моноклональных антител [2]. В силу особенностей культивирования H. pylori и сложности определения резистентности к антимикробным препаратам в большинстве случаев врачи не обладают информацией о чувствительности микроорганизма к антибиотикам. Перечисленные особенности зачастую приводят к гипердиагностике хеликобактерной инфекции, «слепой» (без тестирования на присутствие микроорганизма) эрадикации, затрудняют назначение адекватной эффективной терапии.
H. pylori имеет широкий спектр чувствительности к антимикробным препаратам in vitro [3, 4]. Однако в схемы эрадикации входит ограниченный набор препаратов (кларитромицин, амоксициллин, метронидазол, тетрациклин, левофлоксацин и препараты висмута) [2, 5]. Резистентность H. pylori к антимикробным препаратам является определяющим фактором эффективности существующих режимов эрадикации микроорганизма [5, 6].
Целью данной работы было получение данных о частоте инфицированности пациентов с гастроэнтерологическими жалобами и определении первичной резистентности штаммов H. pylori в Санкт-Петербурге.
Материал и методы
Проведено проспективное наблюдательное исследование, включившее пациентов, обратившихся к гастроэнтерологу или терапевту с жалобами на диспепсию. Всем больным выполнен 13С-уреазный дыхательный тест с меченой мочевиной – 13С-карбамидом. Принцип метода основан на высокой уреазно-ферментативной активности H. pylori, посредством которой происходит ферментативный гидролиз принятой внутрь меченой мочевины до углекислого газа и аммиака (рис. 1).
Процедура тестирования включала забор проб выдыхаемого воздуха до приема меченого субстрата и через 10, 20 и 30 минут после приема 13С-карбамида с усилителем уреазной активности хеликобактера лимонной кислотой.
В природе углерод встречается в виде двух стабильных нерадиоактивных изотопов: «легкого» с массовым числом 12 (12С) и «тяжелого» – с массовым числом 13 (13С). Распространенность 12С составляет 98,89%, 13С – 1,11%. Природное соотношение углеродов составляет 0,01122. Изотопной меткой препарата был стабильный нерадиоактивный 13-й изотоп углерод. Доказана прямая корреляция между уреазной активностью хеликобактера и приращением 13С-углерода в выдыхаемом воздухе после приема субстрата [7].
Содержание в выдыхаемом воздухе СО2 и соотношения 13С/12С стабилизированных изотопов определяли с помощью инфракрасного спектрометра IRIS (Kibion/Wagner, Швеция/Германия).
Кроме того, некоторым пациентам, согласившимся на эзофагогастродуоденоскопию (ЭГДС) и участие в протоколе «WPN-RUS-002 O», было выполнено бактериологическое исследование гастробиоптатов на H. pylori. Для участия в данном протоколе пациенты давали письменное информированное согласие, одобренное центральным и локальным научными этическими комитетами в соответствии с принципами Хельсинкской декларации.
В исследование резистентности были включены пациенты в возрасте от 18 до 65 лет с подтвержденной инфекцией H. pylori при проведении ЭГДС, подписавшие информированное согласие на участие в исследовании.
Критериям исключения соответствовали пациенты, ранее получавшие антимикробную терапию для эрадикации H. pylori или антибиотики группы макролидов или получавшие ингибиторы протонной помпы и препараты висмута в течение двух недель, предшествовавших исследованию.
В рамках протокола во время ЭГДС всем больным осуществлен забор гастробиоптатов для микробиологического исследования. Посевы сделаны в соответствии с отработанной методикой культивирования [8].
В качестве основы питательной среды для выделения и культивирования H. pylori использован Колумбийский агар. Инкубация посевов осуществлена в микроаэрофильных условиях при содержании кислорода около 5% в анаэростате системы GasPac100 c газогенерирующими пакетами типа GasPak. Идентификация выделенной культуры проведена на основании характерной морфологии культуры в мазке, окрашенном по Граму, и способности культуры к продукции уреазы.
Антибиотикорезистентность выделенных штаммов H. pylori изучали, используя метод серийных разведений на питательном агаре, содержащем определенные концентрации антибиотика. Определена чувствительность штаммов H. pylori к кларитромицину, амоксициллину, левофлоксацину, метронидазолу и тетрациклину [9]. Критерии распределения штаммов по степени чувствительности приведены в таблице.
Статистический анализ выполнен с помощью программного пакета IBM® SPSS Statistics, версия 21.0. Для дихотомических показателей резистентности были представлены 95% доверительные интервалы (ДИ) для долей резистентности к тому или иному антибиотику.
Результаты исследования
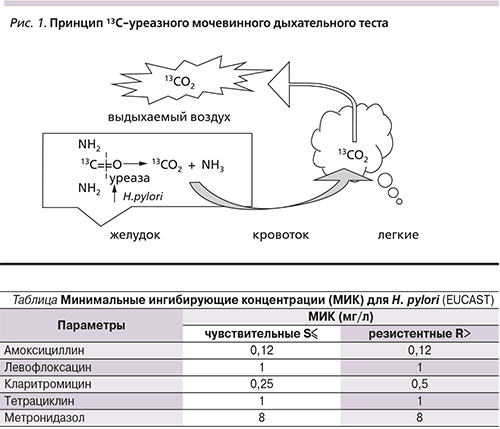
За 8 месяцев были обследованы 1929 пациентов, обратившихся к гастроэнтерологу или терапевту с диспепсическим синдромом. Всем пациентам выполнен четырехточечный 13С-уреазный дыхательный тест. Среди тестируемых пациентов 530 прошли курс эрадикации в течение 1–3 лет до исследования. Никому ранее уреазный дыхательный тест для контроля уничтожения микроорганизма не выполнялся. Эффективность эрадикационной терапии среди пролеченных лиц составила всего 75%. Частота встречаемости хеликобактера среди 1399 обследованных пациентов, не лечившихся от хеликобактерной инфекции и предъявлявших жалобы на диспепсию, составила 52% (положительный тест выявлен у 730 больных). Высокая степень инфицированности выявлена в 80% случаев (рис. 2).
В исследование резистентности были включены 109 инфицированных пациентов от 18 до 64 лет. Бактериологическим методом микроорганизм выделен лишь у 56 (51,4%) пациентов (95% ДИ – 42,0–60,8%). Такой низкий процент культивирования микроорганизма отражает технические трудности, связанные с транспортировкой и культивированием микроаэрофильного микроорганизма.
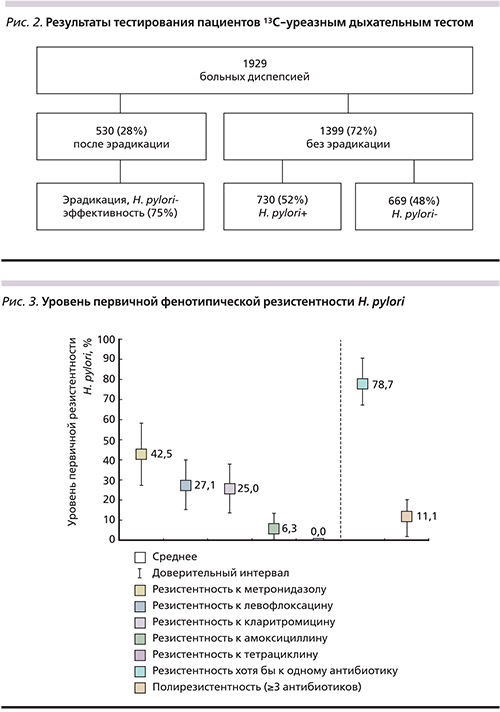
Чувствительность H. pylori к антимикробным препаратам удалось определить у 48 выделенных штаммов. Из-за скудного роста культуры в 8 случаях оценить антибиотикограмму было невозможно. Среди анализируемых изолятов H. pylori штаммов 17 (42,5%) были резистентны к метронидазолу, 13 (27,1%) – к левофлоксацину, 12 (25%) – к кларитромицину. Кроме того, было выявлено 3 (6,3%) штамма, устойчивых к амоксициллину. Все тестируемые штаммы были чувствительны к тетрациклину. В случае выявления резистентности к трем и более группам антимикробных препаратов штамм хеликобактера относили к полирезистентным. В ходе исследования 5 (11,1%) микроорганизмов были полирезистентными (рис. 3).
Двойная резистентность к кларитромицину и метронидазолу обнаружена у 2 (4,4%) изолятов, метронидазолу и левофлоксацину – у 4 (8,3%) микроорганизмов. Все штаммы, резистентные к амоксициллину, были устойчивы к кларитромицину.
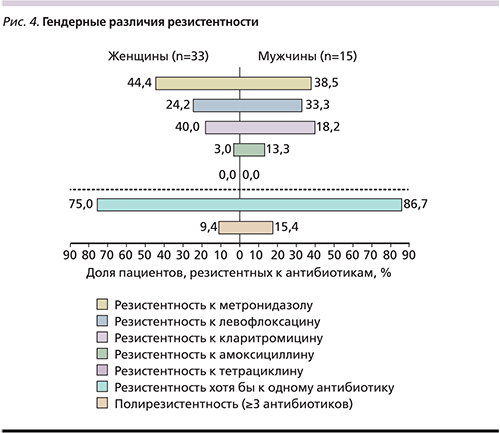
Частота встречаемости резистентных штаммов различалась у мужчин и женщин, однако данный факт сложно интерпретировать из-за малой выборки (рис. 4).
Обсуждение
Существует много методов диагностики хеликобактерной инфекции. Однако эксперты в качестве приемлемых информативных неинвазивных методик рассматривают 13С-уреазный дыхательный тест с мочевиной и определение антигена H. pylori в стуле с помощью моноклональных антител, что отражено в Маастрихтских рекомендациях IV пересмотра [10]. В нашем исследовании применялся 13С-уреазный мочевинный дыхательный тест, позволивший не только оценить факт наличия инфекции, но и судить о степени инфицированности пациентов на основании динамики приращения меченого 13С в выдыхаемом воздухе [7]. Среди обследованных пациентов с жалобами на функциональную диспепсию 52% были инфицированы. До начала исследования мы предполагали выявить более высокую частоту встречаемости хеликобактерной инфекции среди пациентов с диспепсическими жалобами. В данное исследование не включено тестирование здоровых лиц, и, следовательно, мы не можем оценить популяционную инфицированность. Но, вероятно, при таком уровне инфицированности пациентов с гастроэнтерологическими жалобами частота встречаемости инфекции в популяции будет ниже. Настораживает факт высокой степени инфицированности пациентов – в 80% случаев. При этом инокулюм-эффект (при высокой концентрации бактерий возбудителя возрастает минимальная ингибирующая концентрация и снижается бактерицидная активность антибиотиков) играет негативную роль, снижая вероятность успешного лечения от инфекции [11]. Кроме того, предпосылкой к снижению эффективности схем эрадикации на основе кларитромицина является выявленный нами высокий уровень резистентности, превышающий 20%-ный порог.
В опубликованных отечественных работах в большинстве случаев выводы о кларитромицин-резистентности H. pylori сделаны на основании метода полимеразной цепной реакции, тогда как доказана низкая корреляция между фенотипическим и генотипическим методами определения чувствительности H. pylori [12–15]. В нашем исследовании использован наиболее информативный метод диагностики резистентности H. pylori-инфекции – бактериологический метод серийных разведений. При применении аналогичной методики тестирования на основании изучения 133 штаммов, выделенных от пациентов в Смоленске, получены данные о низкой резистентности хеликобактера к кларитромицину [16]. В Санкт-Петербурге резистентность к кларитромицину составила 25%, что иллюстрирует межрегиональные различия в частоте назначения антибиотиков и как следствие – различия в чувствительности микроорганизмов.
Фенотипический метод определения чувствительности к антибиотикам рекомендован Институтом по клиническим и лабораторным стандартам (CLSI), EUCAST, а также Маастрихтским соглашением IV пересмотра в качестве основного метода определения чувствительности H. pylori к кларитромицину [9, 10]. Культуральный метод является высокоспецифичным тестом, однако характеризуется низкой чувствительностью [17, 18]. Даже при четком соблюдении всех правил транспортировки материала и культивирования чувствительность в нашем исследовании составила 51,4%. Объективные сложности работы с культурой микроаэрофильного микроорганизма объясняют отсутствие широко представленных данных об истинном состоянии антибиотикорезистентности в различных регионах нашей страны.
Выводы
- Среди пациентов с функциональной диспепсией инфицированность H. pylori составляет 52%.
- Преобладает высокая степень инфицированности H. рylori.
- Выявлен высокий уровень первичной резистентности к кларитромицину – 25%, и левофлоксацину – 27,1%.
- Резистентность к метронидазолу составляет 42,5%.



