Рост распространенности остеопороза является серьезной проблемой здравоохранения во всем мире. Для остеопороза характерно уменьшение массы и изменение микроархитектоники костной ткани, что приводит к снижению прочности кости. Со временем многим пациентам с остеопорозом приходится испытывать осложнения этого недуга – остеопоротические переломы. Первичный остеопороз – самостоятельное заболевание, которое развивается в любом возрасте, однако наиболее часто он встречается у женщин старше 50 лет в постменопаузальном периоде [1, 2]. Вторичный остеопороз в большинстве случаев является симптомом других заболеваний или следствием проводимого лечения. Известно, что на вторичный остеопороз приходится более 2/3 случаев у мужчин, более половины у женщин в пре- или перименопаузе и приблизительно у 1/5 части женщин в постменопаузе. Причины вторичного остеопороза многочисленны, а потенциальный риск переломов сопоставим с риском при первичном остеопорозе. В общей структуре остеопороза на вторичные формы приходится от 15 до 20 %, причем наибольшую часть составляет остеопороз при эндокринной патологии [3].
Костная ткань представляет собой активную динамическую систему, в которой постоянно происходят процессы резорбции старой кости и образования новой. Эти процессы составляют цикл костного ремоделирования, который начинается еще в утробе матери и продолжается в течение всей жизни человека [1, 5, 6]. Важная роль в поддержании функционирования костной ткани и минерального обмена принадлежит эндокринной системе. Многочисленные исследования позволили установить основные закономерности регуляции минерального обмена и использовать их в фармакологических целях.
Согласно имеющимся данным, 90 % костной массы формируются до 18 лет. На протяжении жизни человека скорость и направленность костного ремоделирования меняются. До 35–40 лет поддерживается нулевой баланс; потери костной массы начинаются с конца третьего десятилетия жизни, их скорость зависит от пола и возраста. У мужчин они составляют 0,3–0,5 % в год [1]. У женщин до начала периода климактерия костная масса ежегодно снижается на 0,7–1,3 %, а после наступления менопаузы ее потери достигают 2–3 % в год. При этом наибольшие потери происходят в течение первых 5–10 лет после наступления менопаузы и могут составлять 3–5 % ежегодно [4, 7]. Более половины объема кости составляют минералы, поэтому для поддержания оптимальной костной массы необходимо регулярное поступление кальция, достаточное для возмещения его ежедневных потерь. В зависимости от возраста содержание кальция в организме колеблется в пределах от 0,8 до 1,7 %, что в абсолютных цифрах составляет около 25–30 г у новорожденных и 850–1400 г у взрослых. Установлено, что 99 % кальция находится в костях скелета в виде кристаллов гидроксиаппатита – Са10(РО4)6(ОН)2 – основного депо кальция в организме, и только 1 % – во внеклеточной жидкости и мягких тканях [6, 8, 9]. Существует тесная взаимосвязь между уровнем ионизированного кальция крови и концентрацией основных кальцийрегулирующих гормонов.
Наибольший вклад в регуляцию процессов костного ремоделирования вносит паратиреоидный гормон (ПТГ); кости, кишечный тракт и почки являются его органами-мишенями. Основной эффект ПТГ – это поддержание гомеостаза кальция: снижение концентрации Са2+ на 1–2 % вызывает незамедлительное повышение уровня ПТГ на 40–50 % (механизм обратной связи), что сопровождается быстрой активацией костной резорбции, увеличением как абсорбции кальция в кишечнике (на фоне стимуляции почечного синтеза кальцитриола), так и реабсорбции кальция в почках [10, 11]. В физиологических условиях дей- ствие ПТГ чаще имеет другую направленность: пептид стимулирует синтез коллагеновых белков кости и усиливает процесс ее формирования.
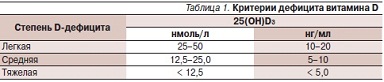
Кальцитонин во многом является функциональным антагонистом ПТГ, оказывая противоположное воздействие на уровень кальция крови. Он секретируется С-клетками щитовидной железы в ответ на повышение в крови концентрации Са2+. Действие кальцитонина на основной орган мишень – кости – осуществляется путем взаимодействия с рецепторами остеокластов. Пептид тормозит костную резорбцию (угнетается остеокластическая активность, уменьшается количество остеокластов), способствует усилению реабсорбции кальция в дистальных почечных канальцах. Кроме того, он влияет на органический состав костной ткани, подавляя распад коллагена. В отличие от других кальциийрегулирующих гормонов кальцитонин обладает анальгетическим действием. Все это послужило обоснованием к использованию кальцитонина при лечении заболеваний, витамина D – 1,25(ОН)2D3 (кальцитриол), который действует на те же органы-мишени, что и ПТГ. Примерно 80 % витамина D образуется эндогенно и только 20 % поступает из экзогенных источников (например, яйца, кисломолочные продукты, сливочное масло, печень рыб). Для реализации своего биологического действия витамин D, поступающий с пищей (эргокальциферол) и под воздействием ультрафиолетового света образующийся в коже из 7-дигидрохолестерола (холекальциферол), после 25-гидроксилирования в печени превращается в 25(ОН)D3 (кальцидиол) – транспортную форму витамина D [1, 9]. После последующего 1α-гидроксилирования в почках при участии фермента 1α-гидроксилазы из 25(ОН)D3 образуется 1,25(ОН)2D3. Регуляция синтеза 1,25(ОН)2D3 в почках является непосредственной функцией ПТГ; на его концентрацию по механизму обратной связи влияет содержание активного метаболита витамина D и Са2+ [11]. Снижение уров-я сывороточного 25(ОН)D3 является наиболее информативным показателем дефицита витамина D (табл. 1) [12, 13]. Недостаток витамина D может приводить к вторичному гиперпаратиреозу, что в свою очередь вызывает снижение минеральной плотности кости, повышение риска переломов.
Основной механизм, обеспечивающий всасывание 90 % кальция, представляет собой витамин-D-зависимый, активный транспорт кальция через энтероциты, который активизируется при дефиците витамина [1, 9]. Витамин D играет важную роль во всех основных процессах, протекающих в костной ткани: минерализации, дифференцировке, активности клеток кости; также он стимулирует синтез остеокальцина в остеобластах. Кроме того, эффекты его распространяются на реабсорбцию кальция в почках. Активные метаболиты витамина D способствуют дифференциации энтероцитов и эпителия почечных канальцев, ответственных за обеспечение организма кальцием [12, 13]. Дефицит витамина D сопровождает не только различные формы остеопороза, но и многочисленные хронические заболевания (почечная недостаточность, артериальная гипертензия, атеросклероз). Ухудшение функций почек отрицательно сказывается на метаболизме D-гормона, снижение скорости клубочковой фильтрации (СКФ) ниже 65 мл/мин часто сопровождается его дефицитом [11, 13].
Наряду с основными кальцийрегулирующими гормонами активное влияние на костное ремоделирование оказывают половые стероиды, гормон роста, инсулин, кортизол, тиреоидные гормоны и различные локальные факторы роста. Поэтому неудивительно, что остеопения и остеопороз тесно связаны с рядом эндокринных заболеваний, среди которых некоторые встречаются часто (сахарный диабет [CД], тиреотоксикоз), другие – достаточно редко (эндогенный гиперкортицизм). Например, остеопения/остеопороз наблюдаются у 18–54 % пациентов с СД, у 50–95 % с эндогенным гиперкортицизмом, у 30 % с гипертиреозом и у многих больных гиперпаратиреозом [3, 4]. Следует отдельно остановиться на эндокринных заболеваниях, при которых увеличен риск остеопороза и связанных с ним переломов.
СД и остеопороз
В последние годы, обратив особое внимание на распространенность остеопороза среди больных СД, врачи назвали остеопороз “недооцененным осложнением диабета”. Суммарная доля остеопороза при СД среди всех вторичных форм заболевания составляет от 6 до 10 % [14].
Метаболические нарушения, сосудистые и неврологические осложнения СД приводят к развитию изменений практически всех органов и тканей, в т. ч. костной системы. Патологические изменения костной ткани при СД, по данным различных авторов, встречаются в среднем у половины больных, что предопределяет их уязвимость для остеопоротических переломов. Многочисленные исследования доказали, что потеря костной массы более выражена и наблюдается чаще при СД 1 типа, чем при СД 2 типа [14, 15]. Регрессионный анализ факторов риска диабетической остеопатии позволяет утверждать, что при СД 1 типа в ее основе лежат возраст пациента, возраст манифестации заболевания, масса тела, наличие полинейропатии, кальциевый баланс, уровень физической активности и наличие вредных привычек (в частности, курение). При СД 2 типа помимо вышеуказанных факторов риска немаловажную роль играют также пол, длительность заболевания, наличие диабетической ретинопатии, продолжительность менопаузы.
Многочисленные метаболические нарушения, свойственные СД, приводят к изменению процессов костного ремоделирования. Как известно, инсулин принимает непосредственное участие в процессах костеобразования: стимулирует биосинтез белка, оказывает анаболический эффект на метаболизм костной ткани и прямое стимулирующее влияние на синтез коллагена и гиалуроната [14–16]. Усиливая всасывание аминокислот и кальция в кишечнике, инсулин способствует увеличению захвата, транспорта аминокислот, их включению в костную ткань и синтезу костного матрикса. Обладая стимулирующим влиянием на остеобластогенез (активирует пролиферацию и репликацию остеобластов), инсулин повышает количество остеобластов; он также необходим для поддержания и обеспечения процессов дифференцировки остеобластов, их способности отвечать на другие гормональные воздействия [17].
В условиях недостатка инсулина снижается активность остеобластов, напротив, активность остеокластов увеличивается и в ответ усиливается костная резорбция [15, 16]. Эти изменения сопровождаются отрицательным азотистым балансом, увеличением секреции глюкокортикоидов, которое приводит к уменьшению белковой костной матрицы. Важную роль играет и прямое влияние повышенного содержания глюкозы – глюкозотоксичность: за счет высокой концентрации конечных продуктов гликозилирования в костном коллагене может усиливаться остеокластическая резорбция кости [14]. Метаболический ацидоз ассоциируется и с отрицательным кальциевым балансом.
Среди предполагаемых механизмов ускоренного развития остеопороза при СД большое значение придают диабетическим микроангиопатиям, ухудшающим кровоснабжение костей [18]. Наряду с этим повышенное выделение кальция, ассоциирующееся с глюкозурией, также является значимым фактором риска развития остеопороза. Гиперкальциурия особенно часто наблюдается среди больных СД при неудовлетворительном контроле гликемии, т. е. неадекватной фармакокотерапии; ее повышение прямо коррелирует со степенью глюкозурии. Кроме того, лечение некоторыми сахароснижающими препаратами (тиазолидиндионами) ассоциируется с повышенным риском переломов, особенно у пожилых женщин [19].
В условиях недостаточности инсулина страдает функция остеобластов, которые имеют инсулиновые рецепторы: снижается выработка коллагена, щелочной фосфатазы, необходимых для образования костного матрикса и его минерализации. Кроме того, снижение концентрации инсулиноподобного фактора роста-1, часто обнаруживаемое при СД, ведет к снижению числа остеобластов и их активности [18, 19].
Обсуждается и такой важный механизм, как недостаток активных метаболитов витамина D: дефицит инсулина приводит к нарушению метаболизма, биологической активности и рецепции витамина D [19]. Это сопровождается снижением всасывания кальция в кишечнике, усилением секреции и активности ПТГ, что в конечном итоге создает отрицательный баланс кальция в организме, усиливая резорбцию костной ткани.
Известно, что у женщин старше 50 лет с СД 1 типа относительный риск частоты переломов шейки бедра в 7 раз и более превышает таковой у женщин без диабета [15]. У женщин с СД 2 типа в период менопаузы риск переломов шейки бедра почти вдвое выше, чем у женщин, которые им не страдают. Следует отметить, что учащение переломов костей различной локализации при сочетании СД и остеопороза связано и с увеличением числа случаев падения этих больных. Факторы риска падения, на которые следует обращать особое внимание, при СД весьма специфичны. К ним относятся гипогликемические состояния, нарушение равновесия в связи с автономной и периферической невропатией, поли- и никтурия, нарушение зрения вследствие ретинопатии и/или других офтальмологических осложнений, изменение структуры стопы (язвы, деформации, остеоартропатия Шарко), полипрагмазия, а также снижение артериального давления при сердечно-сосудистой форме диабетической автономной невропатии [14, 18].
Стероидный остеопороз
К наиболее тяжелым формам вторичного остеопороза относится стероидный остеопороз. При этой форме остеопороза прочность костной ткани начинает снижаться уже на ранних этапах. Эндогенный гиперкортицизм является достаточно редким заболеванием. Серьезную проблему представляет остеопороз, наблюдающийся у 40–50 % пациентов, получающих системные глюкокортикоиды [1, 3, 20]. Стероидный остеопороз возникает в результате воздействия на кость избыточного количества глюкокортикоидов, которые усиливают апоптоз остеобластов, подавляют их активность; замедляется созревание клеток предшественников остеобластов, угнетается остеобластогенез, возрастает ингибирующее действие ПТГ на зрелые остеобласты, что приводит к подавлению костеобразования. Наряду с перечисленным подавляется синтез остеобластами коллагена I типа, уменьшается количество костного матрикса [6, 22].
Значительный прогресс в понимании механизмов развития стероидного остеопороза был достигнут благодаря открытию системы регуляторных белков (остеопротегерин – RANK–RANKL), которая играет ключевую роль в формировании, дифференцировке и активности остеокластов. Стало известно, что глюкокортикоиды подавляют продукцию остеопротегерина, противодействующего процессу дифференциации и активизации остеокластов, способствующего формированию кости, и усиливают выработку RANKL, что приводит к стимуляции созревания и повышения резорбтивной активности остеокластов [20, 22]. Кроме того, угнетая абсорбцию кальция в кишечнике и увеличивая его почечную экскрецию, избыток глюкокортикоидов приводит к отрицательному кальциевому балансу, в ответ на снижение внеклеточной концентрации кальция наблюдается быстрое выделение ПТГ [6, 23]. Его влияние на почечную регуляцию баланса кальция сказывается практически немедленно. Повышение уровня ПТГ увеличивает костную резорбцию, активируя остеокласты. Следовательно, на фоне гиперкортицизма потеря костной массы является результатом как подавления костеобразования, так и увеличения костной резорбции. Следует отметить, что глюкокортикоиды вызывают катаболические изменения в мышечной ткани, снижение мышечной массы; миопатия преимущественно поражает проксимальные мышцы нижних конечностей и плечевого пояса, повышает риск падений и переломов [23].
При эндогенном гиперкортицизме остеопороз встречается у 50–80 % пациентов. Избыток глюкокортикоидов оказывает преимущественное воздействие на трабекулярные кости, поэтому чаще наблюдаются переломы ребер, тел позвонков, костей таза. У многих пациентов, особенно при большой длительности заболевания, уменьшается рост из-за компрес-ии позвонков на фоне остеопороза. Установлено, что переломы возникают при значениях минеральной плотности костной ткани (МПК), более высоких, чем переломы у пациентов с постме- нопаузальным или сенильным остеопорозом [22, 23]. Наиболее страшным осложнением эндогенного гиперкортицизма остается асептический остеонекроз, в первую очередь поражается головка бедренной кости, реже – плечевой. Это приводит к возникновению болевого синдрома и переломов, часто требуется протезирование.
Остеопороз при нарушениях функции щитовидной железы
Нормальный уровень тиреоидных гормонов является необходимым условием для нормального роста и развития организма; они стимулируют остеобластическую и остеокластическую активность костной ткани, не оказывая при этом заметного влияния на синтез матриксных белков и репликацию клеток кости. Гиперметаболизм, характеризующий манифестный тиреотоксикоз, часто сопровождается снижением МПК разной степени выраженности [2, 3, 24]. Гиперпродукция тиреодных гормонов нередко сопровождается повышением костного обмена за счет увеличения количества остеокластов, усилением костной резорбции, гиперкальциемией, снижением всасывания кальция в кишечном тракте. Активизация костеобразования, наблюдающаяся при тиреотоксикозе, как правило, не способна полностью компенсировать потери костной массы на фоне усиленной резорбции. Чаще страдают кости кортикального строения, нежели трабекулярного. Увеличение костного обмена, как правило, сопровождается повышением концентрации остеокальцина крови. Помимо этого у больных тиреотоксикозом снижена абсорбция кальция в кишечнике и повышено разрушение костного коллагена [6, 25, 26]. Как результат – уменьшается костная масса; даже наличие тиреотоксикоза в анамнезе в 2,2 раза повышает риск возникновения переломов в постменопаузе по сравнению с женщинами без данного заболевания [26]. Недавние исследования показали, что и субклинический тиреотоксикоз у женщин в постменопаузе можно отнести к факторам риска развития остеопороза [24]. Не следует забывать, что риск снижения костной массы увеличивается при супрессивной терапии тиреоидными гормонами, назначаемой после тиреоидэктомии по поводу рака щитовид-ой железы [27].
Одним из характерных проявлений первичного гиперпаратиреоза является остеопороз, проявляющийся снижением костной массы до 60 %, и патологические малотравматичные переломы, которые встречаются у 2,8–21,8 % пациентов [3, 28, 29]. В клинической картине часто присутствуют боли в костях (90 % случаев). Гиперсекреция паратгормона приводит к резкой активизации костного метаболизма со значительным преобладанием костной резорбции. Наиболее типично снижение МПК лучевой кости, реже – в области проксимального отдела бедра и поясничного отдела позвоночника. В отличие от других форм вторичного остеопороза при гиперпаратиреозе происходит накопление фиброретикулярной ткани в зонах костной перестройки [2, 28]. Неспецифичность жалоб пациентов, медленное развитие клинических симптомов приводят к поздней диагностике недуга, когда, как правило, наблюдается генерализованный остеопороз.
Снижение костной массы вследствие недостатка эстрогенов обычно связано с менопаузой [1, 4, 8]. Однако гипогонадизм любой этиологии значимо повышает риск развития остеопороза; существуют данные о взаимосв зи между продолжительностью гипогонадизма и величиной потери костной массы. Так, масса кости может быть снижена у женщин с аменореей и предшествующей недостаточностью яичников, гиперпролактинемией. Эстрогены играют важную роль в формировании скелета и предотвращении потерь костной массы. На всех основных костных клетках обнаружены высокоспецифичные рецепторы к эстроге-ам, поддерживающим баланс между остеобластами и остеокластами в процессах костного ремоделирования [4, 8]. Прямое воздействие эстрогенов на остеокласты выражается в подавлении синтеза лизосомальных ферментов, необходимых для резорбции костной ткани. Кроме того, эти гормоны оказывают защитное действие на кости за счет уменьшения числа костных рецепторов к ПТГ и снижения чувствительности к нему. Влияние эстрогенов на остеобласты заключается в стимуляции их дифференцировки и синтеза проколлагена I типа. Помимо прямого влияния на кости эстрогены проявляют и опосредованное действие путем изменения концентрации как кальцийрегулирующих гормонов, так и местных ростовых факторов. Хорошо известно, что именно дефицит эстрогенов является пусковым фактором развития постменопаузального остеопороза [4].
Лечение остеопороза
Известно, что поздняя диагностика и несвоевременное начало терапии остеопороза характерны для 75 % женщин и 90 % мужчин [30]. Известно, что клинически остеопороз протекает, как правило, бессимптомно, его первым проявлением могут быть остеопоротические переломы. Приоритетной задачей практической медицины является не только своевременная диагностика, но и адекватное лечение остеопороза и его осложнений, порой имеющих фатальный характер, – остеопоротических переломов. Разрешению этой задачи несомненно способствует более широкое информирование о проблеме остеопороза как врачей различных специальностей, так и населения.
К счастью, остеопороз – это одно из немногих заболеваний, когда возможна эффективная профилактика; не вызывает сомнений тот факт, что сохранение костной массы – задача, более легкая, чем прекращение потери или ее восстановление [1, 4, 5]. В настоящее время определены факторы риска остеопороза, часть из которых модифицируема. Поэтому важно активное выявление пациентов с заболеваниями, приводящими к снижению МПК, – иначе говоря, формировать группы риска [2]. Снижение костной массы – частое проявление эндокринных заболеваний. Потери костной ткани различной выраженности присутствуют у таких больных зачастую в совокупности с другими проявлениями эндокринной патологии. Поэтому в решении первостепенной задачи – активного выявления больных, нуждающихся в профилактике или подлежащих лечению остеопороза, важная роль отводится эндокринологам. Основной первичной профилактикой является достижение максимального пика костной массы в пределах индивидуальных генетических возможностей организма и уменьшение потерь костной массы в будущем. Для этого необходимо оптимальное потребление кальция во все возрастные периоды, начиная с детства, регулярные занятия физкультурой, достаточное пребывание на солнце пожилых людей, отказ от вредных привычек, несбалансированных диет [3, 14]. Показанием к вторичной профилактике следует считать наличие достоверных факторов риска остеопороза, в т. ч. эндокринных заболеваний, повышающих риск вторичного остеопороза. С целью медика-ентозной профилактики заболевания патогенетически обосновано назначение кальция и нативных препаратов витамина D (холекальциферол) [3–8].
Одним из эффективных комбинированных препаратов, содержащих кальций и витамин D, является Кальций-Д3 икомед. Удобство использования препарата обеспечивается также наличием двух его форм (500 мг карбоната кальция + 200/400 МЕ витамина D3). Препарат, содержащий 200 МЕ витамина D3, рекомендуется в основном для профилактики и включения в схемы лечения остеопороза у лиц более молодого возраста, в т. ч. у пациентов с СД. Другая форма препарата – Кальций-Д3 Никомед Форте (500 мг карбоната кальция + 400 МЕ витамина D3) – рекомендуется для лечения и профилактики заболевания у лиц старше 50 лет. При необходимости в случае потребности в большей дозе витамина D (например, больные ожирением, пациенты с немощностью, выраженным дефицитом витамина D) можно добавить 2 капли Вигантола (ок. 1200 ME витамина D3); пациентам с нарушением функции почек, наклонностью к гипокальциемии дополнительно назначаются профилактические дозы альфакальцидола (0,25–0,5 мкг/сут) [12]. В настоящее время накоплены данные о результатах многочисленных контролируемых исследований, подтверждающих эффективность, безопасность долгосрочной терапии комбинированными препаратами, содержащими кальций и витамин D [3, 8–10]. Так, в 3-летнем исследовании, включившем 269 женщин в возрасте 45 лет и старше с остеопенией и 81 – с нормальными показателями МПК (группа контроля), уже через год наблюдения были отмечены статистически достоверные положительные результаты в отношении МПК позвоночника (L1–L4) в группе, получавшей 1000 мг кальция и 400 ME витамина D3 (Кальций Д3 Никомед Форте, 2 таблетки в день), которые сохранялись через 2 и 3 года наблюдения (+1,42, +2,32 и +3,27 % соответственно) [31]. Особого внимания заслуживает снижение риска падений на фоне приема препаратов кальция и витамина D, что крайне важно для пациентов с возрастным снижением мышечной силы [31].
Кроме того, предпринятый фармакоэкономический анализ показал, что Кальций Д3 Никомед Форте является одним из наименее затратных комбинированных препаратов для предупреждения остеопороза и переломов проксимального отдела бедра [32]. Основным критерием для назначения терапии остеопороза является уровень МПК. Характеристика инструментальных методов определения МПК с помощью остеоденситометрии детально изложена в специальной литературе [1, 2]. Пациенты с заболеваниями и состояниями, приводящими к снижению костной массы, представляют группу риска развития остеопороза. При оценке результатов денситометрии лечение рекомендуется назначать всем пациентам с диагностированным остеопорозом, а также лицам с промежуточными значениями Т-критерия (от -1,5 до -2,5) при наличии дополнительных факторов риска.
Таблица 2. Терапия остеопороза
Большое значение в лечении остеопороза имеют рекомендации по образу жизни: пациентам советуют бросить курить, сократить потребление алкоголя, расширить физическую активность с учетом их состояния. Фармакотерапия остеопороза основывается на трех принципах: этиологическом, патогенетическом и симптоматическом [4, 5, 8]. При вторичном остеопорозе важное место отводится этиотропной терапии, поскольку прогноз потерь костной массы зависит от успеха лечения основного заболевания [18, 33]. К тому же наблюдения показывают, что при излечении некоторых эндокринных заболеваний возможно восстановление костной массы, что указывает на обратимость нарушений костной структуры при этой патологии [2]. Например, в случае первичного гиперпаратиреоза – это хирургическое удаление аденомы паращитовидной железы, после чего повышение МПК (на 20 %) происходит как в трабекулярных, так и в кортикальных костях [29]. Напротив, длительная неполная ремиссия, частые рецидивы тиреотоксикоза приводят к дальнейшему снижению костной массы и, как правило, к переломам [2, 26]. Пока остается неясным: насколько вероятно восстановление МПК до исходного уровня, через какие временные сроки оно возможно при достижении ремиссии основного заболевания? Необходимо иметь в виду, что при вторичном остеопорозе на снижение МПК могут оказывать влияние не только основное заболевание, но и факторы риска развития первичного остеопороза (например, возраст, масса тела, пол) [3, 6, 8]. Все они способны приводить к более выраженной потери МПК у пациентов. Следовательно, для эффективного восстановления МПК и снижения риска остепоротических переломов необходима и патогенетическая терапия.
Среди средств фармакотерапии остеопороза в зависимости от преобладающего механизма действия выделяют три основные группы (табл. 2) [1, 4, 8]. Изучение механизмов развития вторичного остеопороза остается в центре внимания исследований, причем в настоящее время наиболее изучено лечение стероидного остеопороза [2, 20]. При выраженном болевом синдроме препаратом выбора является кальцитонин лосося. Следует учитывать, что дефицит витамина D, особенно у пациентов пожилого возраста, является важным звеном в патогенезе большинства форм вторичного остеопороза [12, 31]. В случае дефицита витамина D целесообразность назначения его совместно с кальцием не вызывает сомнений. Однако при снижении СКФ менее 65 мл/мин более заметное терапевтическое воздействие окажут активные метаболиты витамина D (альфакальцидол, Этальфа) в дозе 0,5–1 мкг, назначаемые на длительное время [10, 37, 38]. Этальфа стимулирует образование кости, нормализует абсорбцию кальция и минеральный гомеостаз, подавляет повышенный уровень паратгормона. У лиц пожилого возраста выявлена положительная корреляция между мышечной силой и концентрацией D-гормона в сыворотке крови. Усиливая нервно-мышечную проводимость, препарат уменьшает проявления миопатии и снижает риск падений [10]. Сообщается, что как альфакальцидол, так и кальцитонин, а также бисфосфонаты предотвращают или уменьшают потери костной массы [30, 34–36].
Витамин D с кальцием или его активные метаболиты эффективно используются в комплексной терапии совместно с кальцитонином и бисфосфонатами [9, 31, 34–36]. Для предотвращения гиперкальциемии лечение желательно проводить в индивидуально подобранных дозах с контролем уровня кальция в крови 1 раз в 2–3 месяца. В заключение следует отметить, что эндокринная патология относится к той группе заболеваний, течение которых часто осложняется снижением костной массы и развитием остеопороза. Своевременная диагностика и адекватное лечение эндокринных заболеваний, сопровождающихся снижением МПК, способствуют замедлению или прекращению потерь костной массы, нормализации процессов костного ремоделирования, позволяют снизить частоту переломов костей и улучшить качество жизни пациента. Разработка современных подходов к профилактике и лечению вторичного остеопороза обусловливает необходимость дальнейших исследований в этом направлении.


