Боли в спине занимают лидирующее положение не только по степени распространенности, но и по числу дней нетрудоспособности среди работающего населения. Показано, что до 80 % людей в течение жизни испытывают боли в пояснично-крестцовой области. В 13,8 % случаев длительность таких болей составляет не менее двух недель в течение предшествующих опросу 6 месяцев, 17 % пациентов страдают хроническими болями, а 11 % испытывают социальную дезадаптацию из-за болевого синдрома [1–3].
Известно, что выраженность дегенеративных изменений позвоночника не коррелирует с клинической картиной, поэтому их наличие не должно определять ни лечебной, ни экспертной тактики. Более того, в подавляющем большинстве случаев отмечается рецидивирующее течение болей в пояснице при постоянной сохранности патологических изменений анатомических структур позвоночника, а отсутствие корреляции болевого синдрома с размером и локализацией межпозвоночной грыжи стало вполне нормальной ситуацией врачебной практики.
Так, у асимптомных обследованных в возрасте от 25 до 39 лет более чем в 35 % случаев, а в группе старше 60 лет в 100 % случаев по данным магнитно-резонансной томографии (МРТ) выявлялись протрузии дисков, по крайней мере на одном уровне. Асимптомные грыжи дисков по данным компьютерной томографии, МРТ, миелографии встречаются в 30–40 % случаев [4–6].
Серьезным препятствием на подступах к проблеме патофизиологии болей пояснично-крестцовой локализации является невозможность в большинстве случаев точно установить источник болевой импульсации. Отчасти это обусловлено сложностью строения и функционирования структур пояснично-крестцовой области, включающих кости, суставы, связки, жировую ткань, несколько слоев мышц, периферические нервы, нервные корешки, чувствительные и вегетативные ганглии, а также спинной мозг. Каждая из этих структур отвечает на повреждение единственным в своем роде способом реагирования на травму – выбросом биохимически и иммунологически активных медиаторов, стимулирующих чувствительные к боли рецепторы. Это в свою очередь запускает очень сложные и еще не до конца изученные нейрофизиологические механизмы формирования ощущения боли.
Наиболее распространенной причиной формирования болевого синдрома в нижней части спины является остеоартроз (ОА) фасеточных суставов позвоночника с последующим рефлекторным вовлечением мышц. ОА рассматривают как группу заболеваний, имеющих различную этиологию, но приводящих к однотипному биологическому, морфологическому и клиническому исходу. ОА – самое распространенное дегенеративное заболевание суставов, в основе которого лежит поражение гиалинового хряща и субхондральных отделов костей, хотя гипертрофии подвергаются и все остальные ткани внутри и вокруг пораженных суставов. Обычно первые, клинически асимптомные изменения появляются на втором или третьем десятилетии жизни, а к 70-летнему возрасту они отмечаются практически у всех. В возрасте 40 лет те или иные патологические изменения в опорных суставах имеются почти у всех людей, хотя клинические симптомы отмечаются лишь у немногих. Заболеванию одинаково подвержены и мужчины и женщины, но у мужчин оно начинается раньше. Несмотря на то что ОА собирательное понятие, общие патофизиологические, морфологические и клинические проявления ОА, его гетерогенность позволяют различать первичный (идиопатический) ОА, развивающийся в результате естественного биологического старения, и вторичный (когда известен причинный фактор).
ОА начинается незаметно, постепенно и клинически проявляется как невоспалительное заболевание, обычно поражающее только один или небольшое число суставов. Весьма характерно увеличение пораженного сустава в объеме, что обусловлено пролиферативными реакциями со стороны хряща, кости, сухожилий, связок и капсулы, а также синовиальной оболочки, где со временем возникает нестабильность сустава и усиливается локальная боль, обусловленная раздражением рецепторов растянутой суставной капсулой, формируется состояние гипералгезии.
Гипералгезия является усиленным ответом на нормальный болевой стимул. Различают первичную и вторичную гипералгезию. Первичная связана с местом повреждения тканей и возникает первично (в основном) от сенситизированных ноцицепторов, которые становятся чувствительными за счет веществ, высвобождающихся в месте повреждения. Эти вещества, включающие моноамины (серотонин и гистамин), нейроактивные пептиды (вещество Р и кальцитонин-генродственный пептид), кинины и брадикинины, продукты метаболизма арахидоновой кислоты (простагландины и лейкотриены), цитокины и др. Имеется также категория ноцицепторов, называемых “спящими”, или “молчащими”, которые в норме неактивны, но становятся активными вслед за тканевым повреждением (под влиянием эндогенных воспалительных субстанций, связанных с повреждением). Вследствие тканевого повреждения афферентный вход в спинной мозг значимо возрастает, что ведет к развитию вторичной гипералгезии.
В центральной нервной системе (ЦНС) увеличившийся афферентный вход от сенситизированных ноцицепторов и вновь активированных “молчащих” афферентов стимулирует высвобождение нейроактивных активирующих аминокислот и пептидов в задних рогах спинного мозга. В результате этого процесса возбудимость центральных нейронов второго порядка увеличивается. В итоге происходит расширение зоны периферической ткани, в которой может продуцироваться боль (вторичная гипералгезия). В дополнение физиологически нормальная или подпороговая афферентация от кожной поверхности, соответствующей проекции повреждения, является теперь болевой из-за увеличения возбудимости центральных нейронов (аллодиния). Это изменение центральной возбудимости относится к понятию “центральная сенситизация” и рассматривается принципиально ответственной за развитие вторичной гипералгезии.
Ноцицептивная афферентация при болях, обусловленных поражением суставов позвоночника, осуществляется в результате выброса альгогенных соединений (ионов водорода и калия, серотонина, гистамина, простагландинов, брадикинина, субстанции Р) в межклеточную жидкость, окружающую ноцицепторы. Эти вещества играют ключевую роль в формировании боли, обусловленной повреждением, ишемией и воспалением.
Кроме прямого возбуждающего действия на мембраны ноцицепторов имеется непрямой механизм, связанный с нарушением локальной микроциркуляции. Повышенная проницаемость капилляров способствует экстравазации таких активных веществ, как кинины плазмы и серотонин. Это в свою очередь нарушает физиологическую и химическую среду вокруг ноцицепторов и усиливает их возбуждение. Продолжающийся выброс медиаторов воспаления может вызывать длительную импульсацию с развитием сенситизации ноцицептивных нейронов и формированием “вторичной гипералгезии” поврежденной ткани, способствующей хронизации патологического процесса [7].
Повышение чувствительности первичного ноцицептора в пораженной периферической ткани приводит к повышению активности нейронов, посылающих импульсацию в спинной мозг и ЦНС, однако необходимо подчеркнуть, что в очаге воспаления может генерироваться спонтанная электрическая активность, обусловливающая стойкий болевой синдром. Таким мощным индуктором болевой чувствительности являются провоспалительные компоненты: брадикины, гистамин, нейрокинины, оксид азота, которые обычно обнаруживаются в очаге воспаления. Простагландины сами по себе не являются модераторами боли, они лишь повышают чувствительность ноцицепторов к различным стимулам, а их накопление коррелирует с развитием интенсивности воспаления и гипералгезией. Простагландины как бы опосредуют вовлечение “спящих” ноцицепторов в процесс формирования вторичной воспалительной гипералгезии и периферической сенситизации.
С тех пор как было установлено значение циклооксигеназы-2 (ЦОГ-2) в каскаде превращения арахидоновой кислоты в провоспалительные простагландины, интерес к ее роли в развитии болевого стимула и снижении боли при подавлении ЦОГ-2 существенно возрос. Исследования показали, что активность ЦОГ-2 в развитии гипералгезий действительно играет большую роль. Показано, что ЦОГ-2 может индуцироваться и в спинном мозге после развития периферического воспаления, а селективные ингибиторы ЦОГ-2 непосредственно воздействующие на поясничный отдел спинного мозга, прекращают воспалительную гипералгезию [8]. При воспалительной реакции на периферии в спинномозговой жидкости повышается уровень простагландинов, которые проявляют чрезвычайную чувствительность к ингибиции ЦОГ-2 [7].
Совокупность этих процессов с клинической точки зрения можно представить как синдромы компрессионного поражения пояснично-крестцовых корешков и рефлекторные: миофасциальные, мышечно-тонические, поражение связочного и суставного аппарата позвоночника [9–11]. Наиболее часто в клинической практике встречаются рефлекторные болевые синдромы [12]. Особенностью болевых синдромов при изменениях поясничного отдела позвоночника является сочетание рефлекторных мышечно-тонических и миофасциальных синдромов с изменениями в эмоциональной сфере, способствующих хронизации состояния. С этой точки зрения типология болей в спине с подразделением их на специфические (когда боли в спине являются следствием серьезной патологии), неспецифические (суставно-мышечные) и радикулопатию крайне целесообразна, поскольку позволяет определять диагностическую концепцию болевого синдрома даже врачу общей практики [13].
Подходы к лечению неспецифических болей в спине включают перечень препаратов от простых или комбинированных анальгетиков до оперативного вмешательства. Препаратами первого ряда в этом перечне являются нестероидные противовоспалительные средства (НПВС). [14], представляющие собой гетерогенную группу, в которую входит не менее ста веществ, относящихся к нескольким основным химическим группам (производные салициловой, индоловой, пропионовой, гетероарилуксусной, энолиоковой кислот). К сожалению, “химическая” классификация мало полезна для прогнозирования как клинической эффективности, так и выраженности различных побочных эффектов препаратов.
Непрекращающиеся исследования в области синтеза новых НПВС связаны именно с неудовлетворенностью критерием отношения риск/польза при их использовании. В целом число пациентов, у которых отмечаются побочные эффекты, достигает 25 %, в то время как у 5 % пациентов могут развиваться опасные для жизни осложнения [15]. Закономерность их появления обусловлена механизмом действия НПВС. Механизм действия НПВС состоит в ингибировании ЦОГ – ключевого фермента в каскаде метаболизма арахидоновой кислоты, которая является предшественником простагландинов, простациклинов и тромбоксанов [16]. В настоящее время выделено два изофермента ЦОГ. ЦОГ-1 является структурным ферментом, постоянно присутствующим в большинстве тканей, участвуя в регуляции множества физиологических процессов. ЦОГ-2 в норме в большинстве тканей не присутствует, ее экспрессия увеличивается на фоне воспаления, приводя к повышению уровня провоспалительных субстанций (простагландины групп F и I). Именно ингибирование ЦОГ-2 рассматривается как один из важнейших механизмов противовоспалительной, анальгетической активности, а ингибирование ЦОГ-1 – как механизм развития большинства побочных эффектов [15]. Кроме того, имеются экспериментальные исследования, показавшие, что ЦОГ-2-ингибиторы обладают центральным действием, проявляющимся подавлением развития центральной сенситизации [17].
На сегодняшний день наиболее известным селективным ЦОГ-2-ингибитором в инъекционной форме является мелоксикам (Мовалис). Результаты клинического применения этого препарата свидетельствуют о достаточно низкой частоте развития побочных гастроэнтерологических осложнений [18] и достаточной эффективности в лечении люмбоишиалгического синдрома [19–21].
Исходя из известных данных, нами было проведено двухэтапное исследование эффективности Мовалиса при хронических рецидивирующих болях в спине. Первый этап включал анализ результатов ступенчатого курсового лечения (инъекции и последующий пероральный прием 15 мг мелоксикама), второй – анализ интенсивности, частоты и длительности болевого синдрома в течение последующих двух лет.
Материал и методы
Исследование проводилось в пяти российских регионах. Обследованы 767 пациентов в возрасте 49,0 ± 13,5 лет, среди которых было 57,4 % женщин и 42,6 % мужчин. В исследование не включались пациенты, имеющие повышенную чувствительность к препаратам группы НПВС, язвенную болезнь в стадии обострения, почечную или печеночную недостаточность, нарушения гемостаза или применяющие антикоагулянты, беременные или кормящие грудью.
В результате обследования у 571 (74,4 %) пациента выявлена клиническая картина люмбоишиалгического синдрома (доминирование мышечно-суставного синдрома) у 193 (25,2 %) пациентов – признаки радикулопатии (чувствительные расстройства корешкового типа, мышечная слабость, изменение рефлексов), с другой патологией, в картине которой наблюдался люмбоишиалгический синдром – 3 (0,4 %) пациента. Средняя длительность заболевания – 45,2 ± 75,3 месяца, средняя длительность обострения – 1,0 ± 1,5 месяца.
Структура исследования включала оценку исходного состояния пациентов по показателям: спонтанная боль, боль при движении, степень ограничения двигательной функции (каждый показатель по 10-балльной шкале). В соответствии с протоколом исследования оценка тех же показателей производилась через час после 1-й внутримышечной инъекции 15 мг мелоксикама (1-й визит) и 3-й инъекции препарата (2-й визит), которые делались в течение 3 дней. Те же показатели оценивались в конце второй или третьей-четвертой недели перорального применения препарата в дозе 15 мг (3-й визит). Конкретный срок лечения при пероральном применении препарата определялся на основании клинических критериев, исходя из желания достичь максимального эффекта у каждого конкретного пациента. Полученные изменения показателей регистрировались в протоколе, в котором отражались также анамнестические данные, характеристики физикального обследования и затем обрабатывались статистически. Больным проводили и постизометрическую релаксацию, вакуумный и ручной массаж, лечебную физкультуру, блокаду местными анестетиками триггерных зон, вовлеченных в болевой процесс мышц.
Целесообразность формирования контрольной группы нивелировалась предшествующим опытом применения НПВС. Из 767 обследованных 361 (47 %) пациент принимал ранее какой-либо из НПВС, применение которых было прекращено по одной из следующих причин: 8,3 % отмечали наличие побочных эффектов, 35,5 % – отсутствие ожидаемого эффекта, 5,7 % указывали другие причины, в т. ч. финансовые.
Результаты исследования и обсуждение
Результаты исследования представлены в таблице.
* – р < 0,001.
На фоне курсового лечения хотя бы одно из побочных явлений отмечено у 36 (4,7 %) пациентов, однако их появление в ряде случаев носило характер субъективных ощущений и прямым образом связать его с проводимой терапией не представлялось возможным.
Результаты эффективности лечения подвергались оценке со стороны как исследователей, так и пациентов. Исследовательской группой эффективность лечения Мовалисом оценена следующим образом: очень хорошая – 41 %; хорошая – 50,6 %; удовлетворительная – 6,7 %; плохая – 1,7 %. В оценке эффективности лечения пациентом рубрика “очень хорошая” не использовалась. Как хороший эффект лечения отметили 78,0 % пациентов; удовлетворительный – 20,5 %; неудовлетворительный – 1,5 %.
Во втором этапе исследования приняли участие 362 пациента, ранее наблюдавшихся по описанному выше протоколу, средний возраст которых был 51,5 ± 14,3 года, сопоставимые по половому составу. С диагнозом люмбоишиалгии – 88,4 %, радикулопатии – 11,6 %.
Результаты опроса пациентов показали, что частота, длительность и интенсивность болевого синдрома в последующие два года после курса лечения Мовалисом (повторный курс провели 31 пациенту) снизились в среднем на 50 % независимо от клинического доминирования люмбоишиалгического синдрома или радикулопатии (см. рисунок).
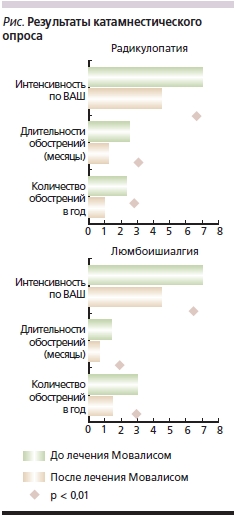
Подобный отдаленный результат можно было бы объяснить возможностью проникновения ЦОГ-2-ингибиторов через гематоэнцефалический барьер и воздействием на центральные системы обеспечения болевого синдрома, способностью снижать уровень депрессии либо влиять на центральные системы “болевой” памяти, что подтверждено пока только в экспериментальных работах [22, 23] . Реализация такого воздействия представляется связанной с системой т. н. нейроматрикса, т. е. с церебральной пространственной нейрональной организацией, содержащей сенсорный образ тела. Клиническими моделями такой системы являются фантомные боли в ампутированной конечности и боли в ногах у пациентов с параплегией при полном травматическом разрыве спинного мозга [24, 25].
Таким образом, представленные результаты исследования показали достаточную эффективность инъекционной формы ЦОГ-2 ингибитора – Мовалиса, закрепленную последующим пероральным применением препарата, который оказался эффективным и безопасным в комплексной терапии болей в спине, обусловленных мышечно-тоническим, миофасциальным синдромом или компрессионной радикулопатией. Причем эффективность курсового лечения пролонгировалась в последующие годы, что подчеркивает вероятное воздействие Мовалиса на центральные механизмы болевого синдрома, определяющее устойчивость положительного результата лечения.



