Остеоартроз (или остеоартрит, как называется данное страдание в англоязычной литературе) длительное время считался «Золушкой в ревматологии». Остеоартрозу (ОА) не уделялось должного внимания как в частных исследованиях этиопатогенетических механизмов развития данного страдания, так и в общемедицинских воззрениях на данную болезнь. Недопонимание многих существенных моментов ОА сказывалось, в частности, на том, что в настоящее время в России одна и та же болезнь называется то остеоартрозом, то остеоартритом.
Но высокая частота заболевания и плохие результаты прогнозов в плане качества жизни и трудовой профпригодности больного ОА заставили обратить внимание врачей в целом и ревматологов в частности на данное заболевание. «Никакая другая болезнь так не затрудняет ходьбу, подъем по лестнице и другие движения, выполняемые нижними конечностями, как ОА. Пациенты с ОА тратят больше времени и сил на выполнение своих ежедневных обязанностей, у них меньше времени остается на отдых. Они очень зависимы от своих родственников и близких, и им требуется больше денег на медицинскую помощь и поддержание здоровья, чем людям того же пола и возраста из общей популяции», – писали E. Yelin и L.F. Callahan в 1995 г.
Еще в 1911 г. T. Muller предложил выделить группу заболеваний суставов дегенеративно-дистрофической природы как «arthrosis deformans», где ОА отводилось ведущее место. На сегодняшний день ОА является одним из самых частых суставных заболеваний и приводит к значительным материальным затратам на лечебно-реабилитационные мероприятия, в конечном итоге во многом определяющим качество жизни прежде всего пожилых людей, среди которых ОА встречается наиболее часто. ОА сыграл немалую роль в том, что Всемирная организация здравоохранения (ВОЗ) посвятила первую декаду нового тысячелетия (2000–2010) изучению заболеваний костно-суставной системы.
 На протяжении всей истории медицины в названия болезней закладывались топическая принадлежность, особенности патогенеза заболевания (воспалительный, сосудисто-трофический характер и т. п.), например пиелонефрит, инфаркт миокарда, цирроз печени и т. д. «Правильность» названия болезни помогала врачу разрабатывать верный путь лечения пациента с данной нозологией: посоветовать нужный режим, рекомендации по питанию; выбрать тактику медикаментозной терапии (противовоспалительной, сосудистой, метаболической) и т. д. Само название болезни часто «узаконивало» для врача (и для пациента) правильность или неверность выбранной тактики лечения, повышала приверженность к сотрудничеству в лечении между врачом и пациентом.
На протяжении всей истории медицины в названия болезней закладывались топическая принадлежность, особенности патогенеза заболевания (воспалительный, сосудисто-трофический характер и т. п.), например пиелонефрит, инфаркт миокарда, цирроз печени и т. д. «Правильность» названия болезни помогала врачу разрабатывать верный путь лечения пациента с данной нозологией: посоветовать нужный режим, рекомендации по питанию; выбрать тактику медикаментозной терапии (противовоспалительной, сосудистой, метаболической) и т. д. Само название болезни часто «узаконивало» для врача (и для пациента) правильность или неверность выбранной тактики лечения, повышала приверженность к сотрудничеству в лечении между врачом и пациентом.
По мере развития научных знаний о сущности патогенетических процессов рождаются новые, не известные ранее нозологические формы и новые названия старых болезней. Данный процесс никогда не будет завершен, и по мере развития медицинских представлений о сути болезни будут пересматриваться их названия.
ОА традиционно определялся как «хроническое прогрессирующее невоспалительное заболевание суставов неизвестной этиологии, характеризующееся дегенерацией суставного хряща и структурными изменениями субхондральной кости, а также явно или скрыто протекающим умеренно выраженным синовитом» [1].
В последние годы произошел коперниковский поворот в воззрениях на ОА. Ранее заболевание расценивалось как стигма старения организма в целом и сопутствующей этому процессу дегенерации суставных структур в частности. В настоящее время ОА воспринимается как агрессивный катаболизм суставного хряща на фоне протекающего воспаления в суставе, требующий активного противовоспалительного и хондропротективного лечения [2–4].
Сегодня за ОА принимается гетерогенная группа заболеваний различной этиологии со сходными биологическими, морфологическими, клиническими проявлениями и исходом, в основе которых лежит поражение всех компонентов сустава, в первую очередь хряща, а также субхондральной кости, синовиальной оболочки, связок, капсулы, околосуставных мышц [5]. Вторичные воспалительные процессы, и прежде всего синовит, сопровождают течение ОА, играют значительную роль как в формировании клиники болезни, так и в дальнейшей деструкции суставных структур [5, 6].
В данном определении примечательно несколько моментов. Во-первых, ОА расценивается как группа нескольких заболеваний. Наверняка в недалеком будущем из ОА отдельно выделятся полиостеоартроз межфаланговых суставов кистей, передающийся по наследству в основном по женской линии; гонартроз, часто возникающий в менопаузу у женщин и связанный с возникающей в тот момент эстрогенной недостаточностью; различные вторичные, прежде всего посттравматические, артрозы и многие другие формы ОА.
Во-вторых, до конца неясно, что является первичным эпицентром поражения при ОА: гиалиновый хрящ или субхондральная кость? Суставной хрящ не имеет ни кровеносных сосудов, ни нервных окончаний, и неясно, как протекает иннервация хряща и особенно его трофика: из синовиальной жидкости или из субхондральной кости? Поэтому не исключено, что первичным субстратом поражения в суставе при ОА является подлежащая под гиалиновым хрящом кость, а суставной хрящ страдает вторично, т. к. недополучает адекватного питания из подхрящевого отдела кости.
Все больше и больше внимания уделяется суставу не как совокупности костных суставных поверхностей, хрящевых структур, синовиальной жидкости, суставной капсулы и параартикулярного аппарата, а как единому органу с присущими ему едиными нейротрофическими, метаболическими, иммунными и функциональными составляющими.
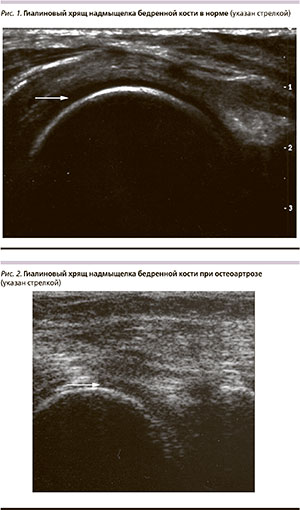
 Морфологические изменения при ОА отмечаются во всех суставных структурах, прежде всего в гиалиновом хряще в виде истончения, потери эластичности, разволокнения. На рис. 1 показан нормальный гиалиновый хрящ надмыщелка бедренной кости (отмечен стрелкой) при ультразвуковом исследовании (УЗИ): он эхопрозрачен, гомогенен, структурный, равномерной толщины. На рис. 2 данный хрящ при ОА также отмечен стрелкой, изменен: он неравномерно отечен, неоднороден, тускл, гипоэхогенен, с неоднородными включениями.
Морфологические изменения при ОА отмечаются во всех суставных структурах, прежде всего в гиалиновом хряще в виде истончения, потери эластичности, разволокнения. На рис. 1 показан нормальный гиалиновый хрящ надмыщелка бедренной кости (отмечен стрелкой) при ультразвуковом исследовании (УЗИ): он эхопрозрачен, гомогенен, структурный, равномерной толщины. На рис. 2 данный хрящ при ОА также отмечен стрелкой, изменен: он неравномерно отечен, неоднороден, тускл, гипоэхогенен, с неоднородными включениями.
Изменения при ОА отмечаются в интра- и параартикулярных связках, сухожилиях в виде лигаментитов, теносиновитов, энтезитов; в виде гипо- и атрофий параартикулярных мышц, бурситов околосуставных сумок; в субхондральной костной ткани – в виде остеосклероза, нарушения конгруэнтности суставных поверхностей, формирования краевых остеофитов, хорошо видимых при рентгенологическом исследовании и УЗИ суставов.
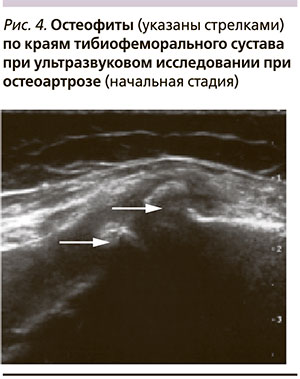
При УЗИ коленного сустава на рис. 3 показано заострение костных краевых суставных поверхностей тибиофеморального сустава с формированием мелких остеофитов при ОА в начальной стадии. На рис. 4 видны грубые костные остеофиты (показаны стрелками) при далеко зашедших стадиях ОА коленного сустава.
В-третьих, параартикулярные мышечные структуры страдают как от реактивного воспаления, развивающегося в суставах, так и от нарушения кинематических функций больного сустава. При этом мышечный аппарат берет на себя повышенную механическую нагрузку, которая в конечном итоге приводит к дистрофическим и гипотрофическим процессам в мышцах.
В-четвертых, до конца не выяснена роль нервного внутрисуставного и параартикулярного аппарата. При ОА страдают структуры неиннервированного хряща, высокоиннервированные компоненты сустава в виде прилегающей к нему надкостницы и многие другие. Многообразный характер боли при ОА позволяет заподозрить значимую роль нервной системы как в поддержании воспаления и дегенерации суставных тканей, так и в формировании болевого синдрома.
В-пятых, в последних определениях ОА все больше и больше размываются понятия об основных механизмах, ведущих к поражению суставных тканей, – дегенеративно-дистрофических процессах или воспалительном синовите, в конечном итоге определившем в англоязычной литературе название болезни как остеоартрит. Значение синовита при ОА подлежит дальнейшему изучению. Синовит при ОА усиливает деструкцию суставных структур. Активизирующиеся при синовите различные медиаторы воспаления: цитокины, интерлейкины, фактор некроза опухоли, простагландины, металлопротеиназы, супероксидные радикалы, оксид азота и многие другие, пагубно, деструктивно влияют на различные суставные структуры, прежде всего на гиалиновый хрящ, усиливая в них катаболические – разрушительные – процессы [7, 8]. Главная трагедия синовита при ОА состоит в его деструктивном действии на хрящ за счет активации литических ферментов на фоне активации фагоцитарных, воспалительных, иммунных и ферментноклеточных реакций, которые усиливают катаболические процессы в структурах сустава.
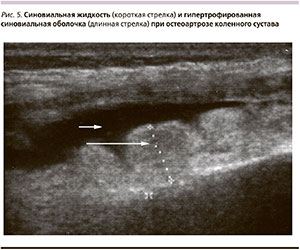
Обострение ОА характеризуется усилением вторичного синовита сустава, когда увеличивается боль, припухлость сустава из-за скопления в его полости воспалительной жидкости, ухудшения подвижности в нем. Воспалительная жидкость и воспаленная утолщенная синовиальная оболочка, выстилающая полость суставной капсулы при синовите, хорошо видны при УЗИ коленного сустава (рис. 5). Длинными стрелками указаны утолщения синовиальной оболочки в верхнем завороте коленного сустава, хорошо визуализируемые на фоне гиперпродукции анэхогенной гомогенной синовиальной жидкости – короткие стрелки.
Синовит при ОА занимает значимое место не только в патогенезе болезни, но и в клинической картине заболевания, резко усугубляя страдания и заставляя больного обращаться за врачебной помощью. Клиника ОА во многом определяется болевым синдромом, многогранным при ОА.
Боль при ОА носит неоднородный характер. В целом для ОА характерен механический ритм болей – возникновение боли под влиянием физической нагрузки и стихание ее за период отдыха, что связано со снижением амортизационных способностей хряща и подхрящевых костных структур к нагрузкам.
 Возможны ночные боли, связанные с венозным стазом и повышением кровяного внутрикостного давления в спонгиозной подхрящевой части кости. Нередко боли в пораженных суставах усиливаются под влиянием неблагоприятных метеорологических условий – высокого атмосферного давления, низкой температуры, повышения влажности, которые могут воздействовать на интраартикулярные рецепторы.
Возможны ночные боли, связанные с венозным стазом и повышением кровяного внутрикостного давления в спонгиозной подхрящевой части кости. Нередко боли в пораженных суставах усиливаются под влиянием неблагоприятных метеорологических условий – высокого атмосферного давления, низкой температуры, повышения влажности, которые могут воздействовать на интраартикулярные рецепторы.
Кратковременная «стартовая боль» возникает при первых движениях после покоя и вскоре проходит на фоне двигательной активности. Стартовые боли обусловлены трением суставных поверхностей, на которых оседает детрит – продукт разрушения хрящевой ткани. После нескольких движений в суставе детрит выталкивается в завороты суставной сумки и боли прекращаются.
Возможна т. н. блокада сустава – быстро развивающийся, резко выраженный болевой синдром вследствие ущемления «суставной мыши» – костного или хрящевого фрагмента между суставными поверхностями. При этом боль лишает больного возможности выполнять малейшие движения в данном суставе. Блокаде коленного сустава часто способствует параллельно развивающаяся при ОА дегенеративная менископатия.
Боли при движении, «стартовая» боль и «блокада сустава» объясняются нарушениями кинематики сустава, поэтому в покое данная болезненность, как правило, уменьшается. ОА – первично хроническое заболевание. Человек, у которого возник ОА, обречен страдать им навсегда и сталкивается с суставной болью на протяжении всей оставшейся жизни. В данных случаях боль носит охранительный характер и, как «сторожевой пес здоровья», определяет лечебный щадящий двигательный режим для больного, является своего рода индикатором адекватности физической нагрузки на суставы.
Иной механизм боли формируется при синовите: появляется постоянная боль, связанная с длительной сенситизацией ноцицепторов в процессе воспаления и мало связанная с механическими нагрузками на сустав. Данную боль, которой сопутствуют утренняя скованность, припухлость сустава, локальное повышение кожной температуры, можно трактовать как хроническую, которая в сочетании с вегетативными, психологическими и эмоциональными факторами теряет приспособительное биологическое значение.
Синовит при ОА характеризуется повышенным образованием провоспалительных цитокинов, простагландинов, фактора некроза опухоли, лизосомальных и других ферментов, которые не только поддерживают воспаление в суставе, но и усиливают катаболические процессы в хрящевой и субхондральной костной ткани сустава. Сложная связь взаимодействий цитокинов, ферментов, свободных радикалов и продуктов распада матрикса приводит к уменьшению содержания протеогликанов в матриксе хряща (молекулярный уровень), нарушению архитектоники хряща (макромолекулярный уровень), появлению микротрещин (микроскопический уровень), а также истончению и надрывам хряща (макроскопический уровень).
Синовит побуждает врача (и больного) к проведению противовоспалительного лечения, которое на сегодняшний момент остается краеугольным камнем в курации данной болезни, несмотря на активное внедрение хондропротективной терапии. Противовоспалительная терапия не только снимает тягостный для пациента симптом суставной боли, но и устраняет другие симптомы воспаления при ОА: припухлость, гипертермию сустава, улучшает его функцию. Более важный смысл противовоспалительной терапии при ОА заключается в ингибиции провоспалительных цитокинов и за счет этого – уменьшения катаболических процессов суставных структур [9].
С учетом того что при ОА наблюдаются как воспалительные, так и метаболические дегенеративные интра- и параартикулярные расстройства, желательно лечить данных больных препаратами, воздействующими на оба отмеченных нарушения.
Лечение синовита и сопутствующего болевого синдрома при ОА предпочтительно проводить препаратами, подавляющими воспаление, к которым относятся прежде всего нестероидные противовоспалительные средства (НПВС). Для лечения болевого и воспалительного синдромов при обострении ОА коленного сустава был выбран мелоксикам (Амелотекс, АМТ) – НПВС, относящееся к классу оксикамов. Амелотекс селективно ингибирует ферментативную активность циклооксигеназы-2 (ЦОГ-2), чем подавляет синтез провоспалительных простагландинов в области воспаления в большей степени, чем физиологических простагландинов [10–12].
 Для коррекции нарушений метаболического характера и воздействия на проводники боли был выбран поливитаминный препарат с нейротропной направленностью Комплигам В (КГ) – комбинированный продукт, содержащий витамины группы В (пиридоксин, тиамин, цианокобаламин), а также лидокаин. Витамины группы В оказывают благоприятное действие на воспалительные и дегенеративные заболевания двигательного аппарата и нервов. Они применяются для устранения дефицитных состояний, а в больших дозах обладают анальгезирующими свойствами, способствуют усилению кровотока, нормализуют работу нервной системы и процесс кроветворения. Тиамин (витамин В1) играет ключевую роль в процессах углеводного обмена, имеющих решающее значение в обменных процессах нервной ткани. Пиридоксин (витамин В6) участвует в метаболизме белков и частично – в метаболизме углеводов и жиров. Физиологической функцией обоих витаминов (В1 и В6) служит потенцирование действия друг друга, проявляющееся в положительном влиянии на нервную, нейромышечную и сердечно-сосудистую системы. Цианокобаламин (витамин В12) участвует в синтезе миелиновой оболочки, стимулирует гемопоэз, сокращает болевые ощущения, связанные с поражением периферической нервной системы, стимулирует нуклеиновый обмен через активацию фолиевой кислоты. Лидокаин – местноанестезирующее средство, вызывает все виды местной анестезии.
Для коррекции нарушений метаболического характера и воздействия на проводники боли был выбран поливитаминный препарат с нейротропной направленностью Комплигам В (КГ) – комбинированный продукт, содержащий витамины группы В (пиридоксин, тиамин, цианокобаламин), а также лидокаин. Витамины группы В оказывают благоприятное действие на воспалительные и дегенеративные заболевания двигательного аппарата и нервов. Они применяются для устранения дефицитных состояний, а в больших дозах обладают анальгезирующими свойствами, способствуют усилению кровотока, нормализуют работу нервной системы и процесс кроветворения. Тиамин (витамин В1) играет ключевую роль в процессах углеводного обмена, имеющих решающее значение в обменных процессах нервной ткани. Пиридоксин (витамин В6) участвует в метаболизме белков и частично – в метаболизме углеводов и жиров. Физиологической функцией обоих витаминов (В1 и В6) служит потенцирование действия друг друга, проявляющееся в положительном влиянии на нервную, нейромышечную и сердечно-сосудистую системы. Цианокобаламин (витамин В12) участвует в синтезе миелиновой оболочки, стимулирует гемопоэз, сокращает болевые ощущения, связанные с поражением периферической нервной системы, стимулирует нуклеиновый обмен через активацию фолиевой кислоты. Лидокаин – местноанестезирующее средство, вызывает все виды местной анестезии.
Пятнадцать пациентов (2 мужчин, 13 женщин, средний возраст – 61,8 ± 9,7 года, с давностью заболевания – 7,8 ± 4,5 года, преимущественно II и III рентгенологических стадий по Kellgren) с ОА коленных суставов в фазе обострения получали АМТ И КГ. Обострение характеризовалось усилением болей в суставе и параартикулярных мышцах как при движении, так и в покое, а также припухлостью сустава, уменьшением подвижности в нем. В течение 10 дней больные получали АМТ по 15 мг в день перорально, а также КГ внутримышечно по 2 мл в сутки. На фоне лечения АМТ и КГ другая терапия не проводилась, кроме стандартных рекомендаций по режиму. Другие методы лечения ОА также не использовались в течение 2 недель до начала лечения АМТ и КГ. Внутрисуставные и параартикулярные инъекции глюкокортикоидов не проводились пациентам за месяц до начала терапии АМТ м КГ.
На фоне проведенного лечения у значительного большинства пациентов уменьшилась боль в суставе, что выражалось улучшением самочувствия, повышением настроения, уменьшением раздражительности и нормализацией сна, прежде всего за счет уменьшения ночных болей. До начала лечения боль, по оценке больных, по ВАШ равнялась 68,6 ± 8,3 мм, в конце лечения боль составила 30,7 ± 6,4 мм. Средняя окружность больного коленного сустава уменьшилась с 43,7 ± 3,6 до 42,3 ± 3,5 см. Объем сгибания в суставе в среднем увеличился с 94,3 ± 9,6 до 121,4 ± 7,5 °. Уменьшение болей и увеличение амплитуды движений в суставе привели к положительной динамике индекса WOMAC, который сократился на фоне терапии с 678,7 ± 134,5 до 427,4 ± 121,3 мм. По окончании лечения АМТ и КГ значительное улучшение отметили восемь больных, улучшение – шесть, отсутствие динамики – один больной. Отрицательной динамики при лечении не отмечено. На фоне терапии в конце лечения у 9 больных присутствовало значительное уменьшение количества жидкости в полости коленного сустава по данным ультразвукового исследования. Уменьшение жидкости в суставе вместе со снижением параартикулярных воспалительных процессов отразилось на уменьшении окружности коленного сустава в процессе терапии. Полученные хорошие клинически результаты позволяют использовать АМТ и КГ в лечении ОА, а ОА расценивать как воспалительное и метаболическое расстройство.
В целом, как видно из данной работы, синовит определяет боль, патоморфогенез, клинику, качество жизни при ОА и требует активного лечения. С другой стороны, синовит при ОА не вызывает лихорадочного синдрома, симптомов хронического воспаления (слабости, психастении, анорексии, похудания), что не позволяет ему возвыситься до роли синовита, как, например, при ревматоидном артрите.
Данные о трагических воспалительных процессах в артрозном суставе, ведущих к катастрофическим деструктивным процессам в нем, эффективность противовоспалительной терапии артроза склоняют нас пересмотреть название ОА в пользу остеоартрита. Это позволит врачам «узаконить» и уточнить противовоспалительную терапию при данном процессе. С другой стороны, название болезни «остеоартрит» с воспалительным окончанием на «-ит» может побудить практических врачей к ошибке сблизить данное заболевание с такими воспалительными суставными нозологиями, как ревматоидный артрит, реактивный артрит и т. п., отличающимися активной, даже агрессивной, и во многом единственной противовоспалительной терапией. Тщательное изучение различных вариантов воспаления в суставе позволит закрепить и обособить название «остеоартрит», а термин «остеоартроз» останется частным понятием, отражающим конечные морфологические дегенеративно-деструктивные итоги в суставе при остеоартрите.
Распространение ОА, по данным экспертов ВОЗ, достигло размеров широкомасштабной неинфекционной эпидемии, развития ОА у лиц молодого и среднего трудоспособного возраста, что обусловливает большую социально-экономическую значимость проблемы ОА и стимулирует поиск новых и эффективных методов консервативного лечения. Полученные результаты исследований, выполненных в соответствии с требованиями доказательной медицины, посвященных изучению эффективности комплексного применения витаминов группы В и НПВС (Амелотекс + Комплигам В) при лечении пациентов с ОА, показали сокращение сроков купирования болевого синдрома, снижение параартикулярных воспалительных процессов, уменьшение потребности пациентов в приеме НПВС, но и привели к увеличению периода ремиссии. В свою очередь правильная дефиниция ОА послужит как более точной диагностике, так и конструктивной патогенетической терапии данного заболевания.



