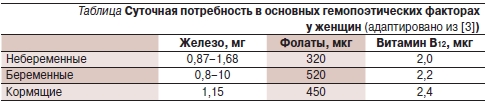
По данным Всемирной организации здравоохранения (ВОЗ), распространенность анемий среди женщин, как беременных (41,8 %), так и небеременных (30,2 %), значительно превышает таковую среди мужчин (12,7 %) [1]. Следовательно, в повседневной практической деятельности чаще приходится заниматься диагностикой и лечением анемий именно у женщин. Согласно рекомендациям ВОЗ, анемия у женщин диагностируется при содержании гемоглобина ниже 120 г/л или гематокрита ниже 36 %, для беременных эти показатели составляют 110 г/л и 33 % соответственно. Следует помнить, что эти значения выше у людей, постоянно проживающих на высоте более километра над уровнем моря и/или курящих [2]. Суточная потребность в фолатах и витамине В12 у небеременных женщин и мужчин существенно не различается. В то же время потребность женского организма в железе превосходит таковую у мужчин в связи с тем, что во время менструации теряется от 4 до 100 мг железа. В периоды беременности и лактации закономерно возрастает потребность в железе, фолатах и витамине В12 (см. таблицу).
Для удобства следует выделить следующие основные группы женщин, у которых развиваются анемии: анемия у женщин в пре- и постменопаузе, куда следует отнести и анемию хронических заболеваний, анемия вследствие меноррагий и анемия беременных.
Анемия у женщин в пре- и постменопаузе
Проведенные несколько лет назад исследования показали, что пациентам с ожирением свойственны нарушения обмена железа: повышение содержания ферритина, растворимых рецепторов трансферрина, снижение содержания сывороточного железа и сатурации трансферрина [4, 5]. Кроме того, была выявлена достоверная отрицательная связь между содержанием железа в плазме крови и индексом массы тела у женщин. В пременопаузе у женщин с ожирением отмечается достоверное повышение содержания гепсидина (острофазового белка, являющегося регулятором обмена железа в организме) и растворимых рецепторов трансферрина [6]. Теми же авторами было продемонстрировано достоверное снижение содержания гепсидина и растворимых рецепторов трансферрина на фоне снижения массы тела через 6 месяцев после хирургического лечения ожирения [7]. Увеличение содержания растворимых рецепторов трансферрина, а также соотношения рецепторы трансферрина/ферритин при наличии ожирения продемонстрировано и у женщин в постменопаузе [8]. В то же время у женщин в пременопаузе без ожирения, но с избыточной массой тела (индекс массы тела – 25–30 кг/м²) уровень растворимых рецепторов трансферрина достоверно не повышен [9]. Исследования показывают, что низкий уровень железа у пациентов с ожирением не связан с различиями в потреблении железа, а также продуктов, влияющих на всасывание железа у пациентов с нормальной и избыточной массой тела [10].
Наиболее вероятной причиной нарушений обмена железа при ожирении является опосредованное воспалением повышение синтеза гепсидина. Известно, что ожирение сопровождается системной воспалительной реакцией. До 25 % циркулирующего интерлейкина-6 вырабатывается в жировой ткани, и уровень этого цитокина у пациентов с ожирением повышен [11, 12]. В то же время интерлейкин-6 – основной индуктор синтеза гепсидина в ответ на воспаление [13]. Еще одним адипокином является лептин. В экспериментах in vitro продемонстрировано усиление синтеза мРНК гепсидина в гепатоцитах под действием лептина [14]. Помимо этого лептин способен усиливать синтез интерлейкина-6 B-лимфоцитами [15]. Обсуждается возможность синтеза гепсидина непосредственно в подкожной жировой клетчатке [16], однако его роль в нарушениях обмена железа, вероятно, невелика, т. к. в печени синтезируется приблизительно в 700 раз больше этого вещества [6]. Гепсидин, связываясь с ферропортином, снижает всасывание железа в кишечнике и нарушает высвобождение депонированного железа. Это приводит к снижению содержания железа в костном мозге и появлению признаков железодефицитного кроветворения (гипохромия, микро- и анизоцитоз эритроцитов, повышение уровня растворимых рецепторов трансферрина). При этом уровень ферритина может быть повышен (см. рисунок).
Таким образом, у пациентов с ожирением имеются нарушения обмена железа, свойственные анемии хронических заболеваний (АХЗ), т. е. признаки железодефицитного кроветворения в отсутствие снижения общего содержания железа в организме (хотя патогенез АХЗ этим, разумеется, не исчерпывается). Едва ли назначение препаратов железа в такой ситуации является патогенетически оправданным. Однако ожирение не исключает наличия дефицита железа, вызванного хронической кровопотерей или другими причинами, и в такой ситуации терапия препаратами железа может иметь патогенетическое обоснование. Дифференциальная диагностика АХЗ, в т. ч. на фоне ожирения, и железодефицитной анемии (при том, что возможно сочетание этих состояний) представляется весьма непростой задачей.
Для выявления дефицита железа ВОЗ рекомендует использовать уровень ферритина. Однако чувствительность и особенно специфичность этого метода не являются стопроцентными. Ложноположительные результаты, т. е. снижение уровня ферритина в отсутствие дефицита железа, возможны при гипотиреозе и дефиците аскорбиновой кислоты; ложноотрицательные – при воспалении, т. к. ферритин относится к острофазовым протеинам. По данным мета-анализа 32 исследований, включивших 8796 пациентов, в т. ч. 16 исследований, включивших 3086 женщин, продемонстрировано, что при повышении уровня С-реактивного белка более 5 мг/мл уровень ферритина увеличивается на 50 % (у женщин – на 48 %). Авторы предлагают корректировать уровень ферритина (коэффициент = 0,67) у пациентов с высоким уровнем СРБ. В этом исследовании продемонстрировано, что использование некорректированного уровня ферритина приводит к гиподиагностике дефицита железа в 14 %, а у женщин – в 16 % случаев [17].
Выяснение причин анемии у женщин с ожирением может вызывать затруднения. По сути, в такой ситуации необходимо проводить дифференциальный диагноз между АХЗ и железодефицитной анемией (ЖДА) или их сочетанием. В данном случае исследование таких параметров обмена железа, как сатурация трансферрина и ферритина, может оказаться недостаточным. В дополнение к этому возможно определение уровня растворимых рецепторов трансферрина, диагностическая ценность этого исследования (чувствительность – 68–97 %, специфичность – 47–100 %) при разграничении ЖДА и АХЗ достаточно высока [18]. Следует помнить, что уровень растворимых рецепторов трансферрина повышается не только при дефиците железа, но и в случае усиленного эритропоэза (например, при гемолизе или неэффективном эритропоэзе на фоне дефицита фолатов и витамина B12).
Анемии вследствие меноррагий
В ситуации избыточной кровопотери во время обильных менструаций в настоящее время целесообразным представляется не только проведение ферротерапии как способа нормализовать уровень гемоглобина, но и назначение гормональных препаратов. Так, в двух международных плацебо-контролируемых исследованиях с участием более 400 женщин с обильными или пролонгированными менструациями было показано, что комбинированная терапия эстрагеном и гестагеном приводила к достоверному снижению на 88 % объема кровопотери в течение 6 месяцев терапии по сравнению с 24 % в группе плацебо [19].
Тем не менее не следует считать, что при интенсивных (особенно со слов женщины) меноррагиях диагноз не вызывает сомнений. В одном из исследований, включившем 45 женщин со средним возрастом 35 лет и уровнем гемоглобина 9,3 г/дл, было показано, что у 58 % пациенток при проведении эзофагогастродуоденоскопии обнаруживаются “немые” заболевания верхних отделов желудочно-кишечного тракта, действительно приводящие к выраженной кровопотере: эрозивный гастрит, эрозивный дуоденит, эрозивный эзофагит, язва луковицы двенадцатиперстной кишки и пр., а еще у 16,3 % – заболевания кишечника (аденокарцинома восходящего отдела ободочной кишки, аденоматозные полипы на ножке и болезнь Крона). Авторы исследования указывают, что, поскольку в 65 % случаев была найдена конкретная желудочно-кишечная причина низкого уровня гемоглобина, в подобных клинических ситуациях не следует забывать о необходимости проведения эндоскопических исследований в случаях довольно банального объяснения “женской” анемии [20].
Анемия у беременных
В настоящее время считается, что около 40 % беременных женщин во всем мире имеют ЖДА [21]. К сожалению, тяжелая анемия может сказываться на здоровье не только матери, провоцируя преэклампсию, но и будущего ребенка, приводя к недоношенности, преждевременным родам и перинатальной смертности по разным причинам [22].
Максимальное количество железа, которое может поступать в организм из пищи, составляет 2,5 мг в сутки. Поэтому питание беременных должно быть полноценным, содержать достаточное количество железа и белка. В то же время очевидно, что при выраженном токсикозе питание не может быть полноценным, в то время как высокие физиологические потребности организма в железе будут сохраняться. Именно поэтому в последнее время беременным рекомендуют принимать препараты железа, не дожидаясь развития анемии. Обычная рекомендуемая доза составляет всего 30 мг железа в сутки [23]. Однако существует и более агрессивная стратегия: 60 мг в сутки беременным женщинам без анемии при продолжительности приема около 6 месяцев и 120 мг железа в сутки – при развитии анемии и более коротком периоде лечения. Современные рекомендации предписывают назначать железо совместно с 400 мкг фолиевой кислоты [24].
Прием препаратов железа в виде монотерапии или в комбинации с фолиевой кислотой способствует хорошему самочувствию матери и плода. Данный подход приводит к достоверному повышению уровня гемоглобина во время беременности и, таким образом, является основой снижения материнской заболеваемости и смертности.
Относительно недавно была предложена новая, еженедельная (в отличие от ежедневной) схема приема железа в комбинации с фолиевой кислотой, но к настоящему времени слишком мало данных, позволяющих сопоставить эффективность двух этих подходов. В то же время именно еженедельный прием железа и фолиевой кислоты, синхронизированный с обновлением клеток слизистой оболочки желудка, может рассматриваться в качестве альтернативы ежедневному приему железа и быть даже более эффективным с точки зрения профилактики развития анемических состояний [25, 26]. Одновременно Кокрейновский обзор, опубликованный в 2011 г. и включивший 21 исследование и более 10 тыс. женщин, не выявил хорошего антианемического эффекта схемы ферротерапии с периодичностью 1 раз в неделю [27].
Позиция ВОЗ заключается в том, что схема “железо + фолиевая кислота” должна стать основой профилактики дефицита железа в популяциях, где распространенность анемии составляет более 20 % от числа женщин репродуктивного возраста. С учетом вышеуказанных рекомендаций ВОЗ при профилактике и лечении анемии у беременных можно рекомендовать комплексный препарат Ферро-Фольгамма, который полностью удовлетворяет требованиям, предъявляемым к современному лечению ЖДА у беременных. Ферро-Фольгамма имеет в своем составе все необходимые компоненты (сульфат железа 112,6 мг, фолиевая кислота 5 мг, цианокобаламин 10 мкг, аскорбиновая кислота 100 мг), обеспечивающие стимуляцию структурного синтеза гемоглобина и повышающие продукцию эритроцитов красным ростком костного мозга. Препарат оказывает стимулирующее действие на синтез как железосодержащей, так и белковой частей гемоглобина. Сульфат железа обладает высоким коэффициентом всасывания в желудочно-кишечном тракте, поскольку практически не образует там сложных соединений. Абсорбционный коэффициент препарата в целом довольно высок также за счет присутствия аскорбиновой кислоты. Активные компоненты Ферро-Фольгаммы находятся в специальной нейтральной оболочке, которая обеспечивает их всасывание, главным образом в тонкой кишке, снижая до минимума раздражающее действие железа на слизистую оболочку желудка. Препарат назначается по 1–3 капсулы в день с предпочтительным приемом препарата до еды.
Таким образом, причины и структура анемических состояний у женщин довольно разнообразны, что требует прежде всего всесторонней клинической оценки причин снижения уровня гемоглобина у женщины до начала какого-либо медикаментозного лечения.


