Физиологическая беременность всегда считалась серьезным испытанием прочности механизмов, регулирующих углеводный обмен. В основе подобного явления лежит развивающаяся во время беременности физиологическая инсулинорезистентность (ИР), имеющая важный адаптационно-приспособительный характер. Биологический смысл формирования ИР при беременности заключается в создании исключительных возможностей накопления и запасания энергии матерью, чтобы в случае голода обеспечивать питательными веществами плод и саму мать. Развитию ИР способствуют существенные гормональные и метаболические изменения, последовательно происходящие у беременной на всех уровнях обмена веществ.
С первых дней физиологической беременности у всех женщин наблюдается снижение уровня гликемии натощак (в среднем на 0,5–1,0 ммоль/л). Причиной низкого уровня гликемии в утренние часы при беременности является ускоренный клиренс глюкозы вследствие снижения ее почечного порога до 8,0 ммоль/л (по сравнению с 10,0 ммоль/л вне беременности). Другими причинами более низкой гликемии натощак являются снижение предшественников глюконеогенеза в крови и повышение потребления глюкозы фетоплацентарным комплексом.
Ведущую роль в изменениях метаболизма во время беременности играет плацента – мощный эндокринный орган, обеспечивающий поддержание нормального гормонального гомеостаза как у матери, так и у плода. Наиболее значимое влияние на обмен веществ оказывают такие гормоны фетоплацентарного комплекса, как прогестерон, плацентарный лактоген и эстрогены, концентрация которых на протяжении беременности существенно меняется. Так, до 16-й недели беременности наблюдается лишь незначительное нарастание уровня эстрогенов и прогестерона. С 17–18-й недели их продукция начинает быстро увеличиваться. После 10-й недели беременности в крови начинает определяться плацентарный лактоген (ПЛ), которому отводится ведущая роль в нарушении углеводного обмена, а сам плацентарный лактоген считается главным диабетогенным гормоном беременности. Концентрация этих гормонов на протяжении беременности прогрессивно увеличивается и к третьему триместру в 5–6 раз превышает их уровень до зачатия.
Плацентарный лактоген имеет чисто плацентарное происхождение и синтезируется в синцитиотрофобласте с самых ранних сроков гестации. Его концентрация нарастает параллельно сроку беременности и массе плаценты. По структуре ПЛ имеет большое сходство с гормоном роста (ГР) (хорионический соматомаммотропин). Подобно ГР, он активизирует синтез ДНК и пролиферацию клеток у плода, что ускоряет его рост. Плацентарный лактоген обладает не только лакто-, сомато- и лютеотропной активностью, но и оказывает значительное влияние на все виды обмена веществ у матери и плода. В частности, ПЛ является антагонистом действия инсулина на периферии и обладает мощной липолитической активностью, что приводит к повышению в крови уровня свободных жирных кислот. Следовательно, при беременности имеется предрасположенность к повышению в крови кетоновых тел, а при сахарном диабете (СД) – к кетоацидозу.
Прогестерон совместно с ПЛ снижает транспорт глюкозы внутрь клетки. Кроме того, прогестерон угнетает связывание инсулина на пострецепторном уровне, что также усиливает имеющуюся ИР.
Эстриол стимулирует образование печенью большого количества кортизолсвязывающего глобулина. Высокая его концентрация ведет к снижению уровня кортизола в крови, что по принципу обратной связи стимулирует секрецию адренокортикотропного гормона гипофизом и приводит к повышению продукции кортизола корой надпочечников. Гиперкортизолемия у беременных способствует замедлению транспорта глюкозы в клетки и усилению ИР уже на самых ранних сроках беременности.
Нарастающий уровень эстрогенов усиливает секрецию пролактина, возможно, также влияющий на углеводный обмен, снижая толерантность к глюкозе во второй половине беременности.
Помимо развивающихся физиологических гормональных изменений большой вклад в развитие ИР во время беременности вносят и другие факторы: высокая активность инсулиназы плаценты, повышение калорийности пищи и снижение физической активности у матери.
Несмотря на перечисленные изменения метаболизма, глюкоза крови у здоровых беременных ниже нормальных значений. Использование системы постоянного мониторирования глюкозы доказало, что во время физиологической беременности у здоровых женщин гликемия ниже принятых в настоящее время норм, но при этом колеблется в очень узких пределах. Так, гликемия натощак составляет 4,10 ± 0,66 ммоль/л, а на пике всасывания углеводов (через 70 ± 13 минут после начала приема пищи) – 6,1 ± 0,7 ммоль/л.
Физиологические изменения обмена веществ у здоровых беременных, связанные с естественным течением данного процесса, неминуемо приводят больных СД к декомпенсации заболевания. Так, во время беременности у больных СД наблюдается склонность к развитию диабетического кетоацидоза и гипогликемических состояний, нередко требующих экстренных вмешательств.
В I триместре беременности активное поглощение глюкозы формирующейся плацентой и периферическими тканями, а также снижение глюконеогенеза могут стать причиной тяжелых гипогликемий, особенно в утренние часы. Потребность в экзогенном инсулине на ранних сроках беременности при любом типе СД обычно снижается более чем на 10–20 % по сравнению с таковой до зачатия. Вследствие этого у большинства больных СД 2 типа потребность в экзогенном инсулине в этот период беременности вообще отсутствует и лишь незначительной части пациенток для поддержания нормогликемии достаточны минимальные дозы инсулина, естественно, при жестком соблюдении диеты.
В то же время токсикоз первой половины беременности у больных СД 1 типа может стать причиной быстрого развития диабетического кетоацидоза.
Во II и III триместрах у всех беременных нарастает ИР, при наличии СД требующая обязательного увеличения дозы вводимого инсулина. Обычно потребность в экзогенном инсулине увеличивается в 2–3 раза по сравнению с таковой до беременности, с 36-й недели может еще незначительно увеличиться или даже снизиться к родам. На самых последних сроках беременности требуется особенно тонкий подбор дозы инсулина. Введение необоснованно больших доз препарата незадолго до родоразрешения создает подкожное депо инсулина, который продолжает всасываться в кровь, а резкое снижение ИР после отделения последа приводит к риску возникновения гипогликемии у матери. В связи с этим необходимость введения инсулина в раннем послеродовом периоде и в первые 24–48 часов после родов нередко отпадает. На этом этапе также требуется обязательный контроль гликемии, т.к. для формирования физиологической лактации у женщины необходима нормогликемия.
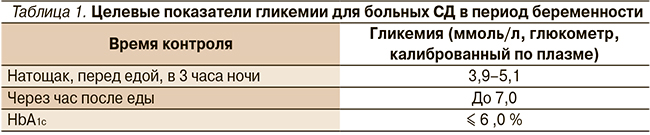
С учетом изложенного выше современные представления об изменении метаболизма во время беременности очевидно, что для поддержания нормогликемии у пациенток с СД требуется постоянный самоконтроль сахара крови для четкой коррекции дозы вводимого инсулина в каждую инъекцию. Идеальная компенсация СД (табл. 1) необходима для физиологического течения беременности и развития плода.
Одним из серьезных последствий декомпенсации СД на самых ранних сроках беременности является эмбриопатия, которая проявляется прежде всего врожденными пороками развития (ВПР). Формирование ВПР происходит в процессе органогенеза, т. е. до 8-й недели беременности от последней менструации (до 6-й недели от момента зачатия). Декомпенсация СД в течение всего остального срока беременности приводит к развитию у ребенка диабетической фетопатии, которая проявляется опережением внутриутробного развития плода (макросомия) или, наоборот, его задержкой. На фоне хронической гипергликемии матери развивается хроническая гипоксия, возможно внутриутробное инфицирование.
Последствия диабетической фетопатии:
- преждевременные роды;
- асфиксия в родах;
- метаболические и другие нарушения адаптации новорожденных к внеутробной жизни;
- неонатальные болезни;
- перинатальная смертность.
Таким образом, для исключения эмбриопатии и ВПР женщина, страдающая СД, должна быть идеально компенсирована уже к моменту зачатия. Для предотвращения развития диабетической фетопатии необходимо обеспечить компенсацию углеводного обмена в течение всей беременности, что значительно снижает опасность любых последствий и позволяет большинству больных их полностью избежать. Это значит, что женщины детородного возраста, страдающие СД любого типа, должны заранее планировать будущую беременность.
Недостаточная информированность больных СД о последствиях зачатия и вынашивания плода на фоне декомпенсированного СД приводит к тому, что большинство женщин с СД не планируют беременность. Как правило, беременность у них наступает случайно – на фоне декомпенсации углеводного обмена, прогрессирующих сосудистых осложнений СД и различных сопутствующих заболеваний.
Обеспечение компенсации СД во время беременности, родов и лактации
Самоконтроль гликемии
Целью лечения беременных с СД является достижение и поддержание гликемии, соответствующей таковой при физиологической беременности, обеспечение акетонурии и отсутствия симптоматической гипогликемии. Гликемия контролируется ежедневно перед едой и через час после каждого приема пищи, перед сном и в 3 часа ночи (8–10 раз/сут), целевые значения терапии представлены в табл. 1.
Проводить контроль глюкозурии у беременных с СД нецелесообразно, т.к. глюкозурия не отражает степень компенсации углеводного обмена и не служит альтернативой самоконтролю гликемии, тем более во время беременности. В этот период у женщин усиливается скорость образования мочи, а реабсорбция глюкозы остается на прежнем уровне. Поэтому нередко можно видеть глюкозурию на фоне нормогликемии во время беременности женщин с СД.

Беременным с СД 2 типа, которые находятся только на диетотерапии, достаточно самоконтроля гликемии натощак и после приема пищи. Если женщина получала до беременности пероральные сахароснижающие препараты, то при подтверждении беременности они отменяются и пациентка при необходимости переводится на инсулинотерапию.
Уровень гликозилированного гемоглобина (HbA1c) в связи с ускоренным эритропоэзом во время беременности следует определять через каждые 4–6 недель. Средняя концентрация глюкозы крови и уровень HbA1c у здоровых беременных женщин снижается приблизительно на 20 %. Следовательно, компенсацией СД у беременных следует считать уровень HbA1c ≤ 6,0 %.
При наступлении беременности на фоне декомпенсации СД быстрое снижение гликемии до целевых значений, указанных в табл. 1, может приводить к развитию и прогрессированию ретинопатии, тяжелым гипогликемическим состояниям, что еще раз подтверждает необходимость планирования беременности женщинам с СД.
В случае пролонгирования беременности у таких пациенток сначала определяются более высокие целевые значения, чтобы снизить вариабельность гликемии, провести осмотр состояния сосудов глазного дна и лазерную фотокоагуляцию по показаниям, а затем уже добиваться рекомендуемых норм. Жесткие требования к уровню гликемии при беременности всегда сопровождаются риском развития гипогликемий, опасных не только для матери, но и для ребенка, т. к. могут вызывать внутриутробную задержку развития плода. Кроме того, частые даже легкие гипогликемии сопровождаются рикошетной длительной гипергликемией и становятся причиной развития многоводия, отечности и макросомии плода. При склонности к гипогликемиям женщинам приходится проводить самоконтроль чаще 8 раз в день – не только перед едой и через час после, но дополнительно еще и через 2 часа после еды, чтобы при тенденции к гипогликемии своевременно принимать углеводы и избегать резкого снижения сахара крови.
Самоконтроль кетонурии
Причины возникновения кетонурии во время беременности:
- декомпенсация СД,
- неадекватное количество употребляемых углеводов,
- низкая калорийность питания, длительная физическая нагрузка,
- пропуск приема пищи или ее отсутствие более 10 часов.
Хроническая кетонурия во время беременности влияет на развитие нервной системы плода и интеллектуальный потенциал будущего ребенка. Необходимо ежедневно проводить самоконтроль кетонурии в утренней порции мочи для коррекции «голодного» кетоза. Дополнительные измерения уровня глюкозы крови и кетонурии необходимы при гликемии выше 10 ммоль/л и/или при инфекциях, сопровождающихся повышением температуры тела, для предупреждения развития диабетического кетоацидоза.
Питание беременной должно быть достаточно калорийным и сбалансированным по основным пищевым ингредиентам для обеспечения всех потребностей растущего организма независимо от того, болеет женщина СД или нет. Полноценная диета при СД и беременности учитывает калорийность продуктов, состав углеводов и равномерное распределение пищевых ингредиентов в течение дня.
Необходимое суточное количество килокалорий беременной зависит от исходной массы тела женщины до зачатия (табл. 2).
Большая часть суточного калоража пищи во время беременности обеспечивается углеводами (40–50 %), остальная – белками (20–30 %) и жирами (30–40 %), из которых на долю насыщенных жиров приходится 30 %, а полиненасыщенных – 70 %.
Постпрандиальный уровень гликемии в значительной степени зависит от состава потребляемых углеводов.
В ряде исследований доказана прямая корреляция между уровнем постпрандиальной гликемии выше 6,7 ммоль/л в капиллярной крови и частотой развития макросомии плода. Для предотвращения гипергликемии после еды беременным с СД рекомендуется дробное питание с небольшим количеством углеводов в каждый прием пищи – 2–4 хлебные единицы (ХЕ) (максимум 5 ХЕ в основной прием). Не рекомендуется употребление углеводов с высоким гликемическим индексом, за исключением экстренной необходимости при купировании гипогликемии. Предпочтение в питании должно отдаваться продуктам с высоким содержанием клетчатки и пищевых волокон.
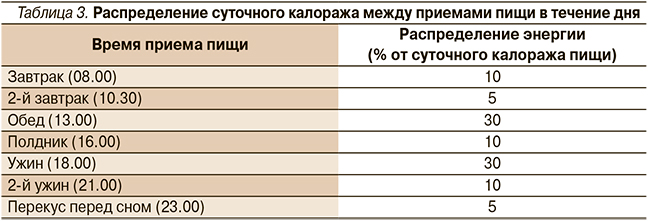
Для равномерного распределения количества килокалорий и углеводов в течение дня рекомендуется три основных и три дополнительных приема пищи в сутки (табл. 3).
Женщинам, имеющим избыточную массу тела или значительную прибавку массы тела во время беременности, рекомендуется сокращать или исключать продукты с высоким содержанием жиров.
В период лактации суточная калорийность питания рассчитывается по следующей формуле: суточная калорийность при лактации = количество килокалорий, получаемых до беременности, + дополнительные 500–600 ккал, но не менее 1800 ккал/сут даже женщинам с избыточным весом. Кроме того, в период лактации во избежание гипогликемии больная СД 1 типа должна увеличивать количество углеводов на 50 г/сут, а во время кормления ребенка грудью обязательно принимать пищу с высоким содержанием белка и углеводов (молоко, кефир, питьевой йогурт).
Беременным с СД 2 типа в отсутствие противопоказаний дозированные физические нагрузки служат обязательным компонентом комплексной сахароснижающей терапии. У женщин с СД 1 типа в первой половине беременности польза от физических нагрузок не так очевидна, т.к. на фоне лечения инсулином увеличивается риск гипогликемических состояний. Однако во второй половине всем беременным рекомендуются ежедневные прогулки после еды в целях снижения постпрандиальной гипергликемии. Перед физической нагрузкой больные любым типом СД обязательно должны исследовать гликемию и при необходимости принимать углеводы во избежание гипогликемии.
При беременности используются только человеческие генно-инженерные инсулиновые препараты или разрешенные аналоги. Результаты контроля гликемии, кетонурии и количество потребляемых углеводов обязательно фиксируются беременными в личном дневнике самоконтроля, т.к. от этого зависит тактика интенсифицированной инсулинотерапии.
В связи с вышеперечисленными физиологическими изменениями обмена веществ суточная потребность в инсулине (ЕД/кг фактической массы тела/сут) во время беременности постоянно меняется.
В I триместре потребность в инсулине составляет 0,7 ЕД/кг/сут, во II – 0,8 и в III – 0,9–1,0 ЕД/кг/сут; 50 % суточной дозы инсулина (СДИ) приходится на пролонгированный инсулин (ИПД), а 50 % – на инсулин короткого действия (ИКД) или его аналоги, разрешенные во время беременности (Аспарт, Лизпро). Во второй половине беременности процентное содержание ИПД может достигать до 60 % из-за нарастающей ИР. По той же причине может увеличиваться время введения болюса до еды: от 30 до 60 минут для ИКД и от 15 до 30 – для ультракокроткого аналога. Распределение суточной дозы между инъекциями представлено в табл. 4.
Пример расчета и распределения суточной дозы инсулина и углеводов для беременной, страдающей СД 1 типа: вес беременной с СД 1 типа составляет 57 кг, срок беременности – 7–8 недель.
СДИ: 0,7 × 57 = 40 ЕД/сут. Из СДИ 50 % инсулина приходится на ИПД (20 ЕД/сут), а 50 % – на ИКД (короткий человеческий инсулин или ультракороткий аналог, разрешенный к применению беременным, – 20 ЕД/сут).
Распределение дозы ИКД в течение суток:
- перед завтраком 0,2 × 40 = 8 ЕД;
- перед обедом 0,15 × 40 = 6 ЕД;
- перед ужином 0,15 × 40 = 6 ЕД.
Распределение дозы ИПД в течение суток:
- утром 0,2 × 40 = 8 ЕД;
- через 8 часов 0,1 × 40 = 4 ЕД;
- через 8 часов 0,2 × 40 = 8 ЕД.
Суточная потребность в килокалориях составляет 57 × 30 = 1710 ккал, из которых на долю углеводов приходится, например, 40 %, т. е. 684 ккал. При сгорании 1 г углеводов выделяется примерно 4 ккал. То есть образование 684 ккал обеспечивается 171 г углеводов (684 ккал/4 ккал = 171 г). Необходимое в сутки количество углеводов соответствует приблизительно 14 ХЕ; 1 ХЕ соответствует приблизительно 12 г углеводов (171 г/12 г = 14,25 × 14 ХЕ/сут).
Распределение суточного количества ХЕ между приемами пищи:
- завтрак – 2 ХЕ;
- 2-й завтрак – 1 ХЕ;
- обед – 3–4 ХЕ;
- полдник – 1–2 ХЕ;
- ужин – 3–4 ХЕ;
- 2-й ужин – 1–2 ХЕ;
- перед сном – 1 ХЕ.
По ряду объективных причин беременным, страдающим СД, очень трудно в течение всех суток обеспечить такой же профиль гликемии, как при физиологической беременности, когда колебания гликемии происходят в очень узких пределах. Кроме того, ранний токсикоз, гастропарез, рефлюкс-заболевания, склонность к гипогликемиям и кетоацидозу создают дополнительные сложности в процессе подбора адекватной дозы инсулина. Вариабельность абсорбции и временные параметры действия базального и препрандиального инсулина, а также развивающаяся при беременности физиологическая ИР еще больше усложняют задачу. Недостатки инъекционной инсулинотерапии успешно устраняются при использовании постоянной подкожной инфузии инсулина с помощью инсулинового дозатора (помп), являющегося в прямом смысле «золотым» стандартом введения инсулина беременным с СД.

Преимущества помповой инсулинотерапии в период беременности очевидны. Так, гибкий режим введения инсулина позволяет сразу реагировать на постоянно меняющуюся потребность в препарате. Техническая возможность быстрого отключения режима базального или болюсного введения инсулина при раннем токсикозе беременных снижает до минимума риск гипогликемий. Использование помповой инсулинотерапии позволяет обеспечивать компенсацию СД даже беременным с гастропарезом, наличие которого в отсутствие помповой инсулинотерапии является абсолютным противопоказанием к беременности. Возможность использования различных болюсных режимов при приеме смешанной пищи снижает резкие колебания постпрандиальной гликемии, являющиеся основным фактором риска развития диабетической фетопатии. Особые возможности базального режима инсулинотерапии при использовании помпы позволяют полностью ликвидировать «феномен утренней зари», нормализовать сон и тем самым улучшить психо-эмоциональное состояние беременной. Сохранение в памяти помпы последних болюсов позволяет правильно менять дозу инсулина на коррекцию гипергликемии в будущем. Очень важно, что при помповой терапии при угрозе преждевременных родов или экстренном родоразрешении можно быстро и эффективно отрегулировать режим базальной инсулинотерапии, что снижает риск декомпенсации СД в этот важный период и тем самым предотвращает гипогликемию новорожденных. Более низкая суточная доза инсулина при помповой терапии во второй половине беременности способствует меньшей прибавке в весе и более быстрому восстановлению формы после родов. Временное снижение базального введения инсулина или его отключение после родов снижает риск гипогликемии и рикошетной гипергликемии в послеродовом периоде, что является залогом успешного становления лактации.
Единственным недостатком инсулинотерапии с помощью дозатора является риск быстрого развития кетоацидоза при возникшей неполадке в системе и прекращении подачи инсулина в течение нескольких часов. Поэтому перевод на помповую инсулинотерапию во время беременности показан только грамотным, хорошо обученным и высокомотивированным на данный метод лечения пациенткам.
Сахарный диабет сам по себе не является показанием к досрочному родоразрешению и плановому кесареву сечению. При нормальных биометрических УЗ-параметрах плода, отсутствии осложнений у матери и компенсированном углеводном обмене возможно пролонгирование беременности до полных 39 недель или начала самостоятельной родовой деятельности. Выявленная на 38-й неделе беременности макросомия плода (предполагаемая масса тела плода – более 90 перцентилей для гестационного возраста или превышает 4000 г) является показанием к индуцированию родовой деятельности или родоразрешению через операцию кесарева сечения.
Гипергликемия матери служит причиной неонатальной гипогликемии и возникающих в связи с ней неврологических осложнений у новорожденного. С учетом данного обстоятельства поддерживать нормогликемию во время родов не менее актуально, чем во время беременности.
Независимо от способа родоразрешения накануне родов вводится обычная доза ночного пролонгированного инсулина или на 20–30 % меньше, если за день до родов отмечена ночная или утренняя гипогликемия. В активном периоде родов ИР резко снижается и потребность в инсулине падает практически до нуля. В связи с этим введение инсулина во время потуг обычно отменяется, а контроль гликемии осуществляется ежечасно. Целевая гликемия в родах – от 3,9 до 7,0 ммоль/л.
При гликемии < 3,9 ммоль/л для предотвращения гипогликемии необходимо внутривенно капельно вводить раствор 10 %-ной глюкозы со скоростью 80–100 мл/ч (2,5 мг/кг/мин). При уровне гликемии < 3,3 ммоль/л скорость инфузии в последующий час увеличивают вдвое.
При гликемии ≥ 7,0 ммоль/л требуется внутривенное введение короткого или ультракороткого инсулина в дозе 2–4 ЕД/ч до достижения уровня гликемии ≥ 3,9, но менее 7,0 ммоль/л.
При наличии показаний к родоразрешению беременной с СД может осуществляться путем проведения операции кесарева сечения. Плановая операция должна проводиться утром и в первую очередь.
Накануне родов при тенденции к ночной гипогликемии доза базального инсулина снижаетя на 30 %. Завтрак и утренние инъекции всех инсулиновых препаратов отменяются. Контроль гликемии осуществляется ежечасно. При гликемии < 3,9 ммоль/л внутривенно капельно вводится раствор 10 %-ной глюкозы (100 мл/ч), а при гликемии > 7,0 ммоль/л – 2–4 ЕД короткого инсулина внутривенно с помощью инфузомата.
Потребность в экзогенном инсулине после родов резко падает, вплоть до отсутствия необходимости его введения в течение первых 24–72 часов после рождения ребенка. Однако и это очень важно, контроль гликемии при этом не прекращается. После родов инсулинотерапию при СД 1 типа необходимо возобновлять при гликемии натощак > 5,5 ммоль/л, а через 2 часа после приема пищи > 8,0 ммоль/л. Требуемая суточная доза инсулина в этот период составляет около 0,5–0,6 ЕД/кг/сут.
Женщинам с СД 2 типа, получавшим до беременности пероральные сахароснижающие препараты, инсулинотерапия показана в том случае, если пациентка кормит ребенка грудью, а гликемия на фоне одной диеты (пероральные сахароснижающие препараты при грудном кормлении противопоказаны) превышает вышеуказанные показатели.



