Высокая заболеваемость острыми кишечными инфекциями (ОКИ) во всех возрастных категориях, их повсеместное распространение, разнообразный спектр возбудителей, а также недостаточный уровень диагностики определяют необходимость постоянного внедрения новых методов исследования и лечения в учреждениях практического здравоохранения. Причины большей части острых гастроэнтеритов, даже в экономически развитых странах, остаются неустановленными. В России, по данным последних лет, этиология 57–67 % случаев острого гастроэнтерита неизвестна. В последние годы все чаще регистрируются “новые” ОКИ, вызываемые преимущественно вирусами [1, 2]. В развивающихся странах на каждого ребенка приходится в среднем более трех эпизодов диареи в год [3]. В России на практике выявляются лишь ОКИ, вызванные ротавирусами. Внедрение методов молекулярной биологии с начала 2000-х гг. позволило установить, что наиболее частой причиной острых гастроэнтеритов являются вирусы и вирусно-бактериальные миксты. Спектр клинических проявлений диарейных заболеваний вирусно-бактериальной этиологии среди детей варьируется от маломанифестной формы до тяжелейшего заболевания с нередкими летальными исходами, которые наиболее часто встречаются среди детей в возрасте до 3 лет.
Как показывает клинический опыт, ротавирусы наиболее часто выявляются при вирусно-бактериальных микстинфекциях. В последние годы проблема ротавирусной инфекции (РВИ) стала актуальной и для инфекционной патологии взрослых: по данным отдельных авторов, ее удельный вес в группе ОКИ у взрослых колеблется от 3 до 40 %. Однако диагностика РВИ у взрослых, особенно в семейных очагах, в РФ остается в целом на низком уровне: по данным Федерального центра государственного санитарно-эпидемиологического надзора, в 2004 г., ее удельный вес в группе ОКИ составил всего 1,3 %.
Также требует уточнения ряд вопросов этиологии и клиники микстинфекций, недостаточно изучены отдельные аспекты локальных механизмов врожденного и приобретенного иммунитета у больных РВИ. В то же время особенности клинической манифестации РВИ в достаточной мере освещены в литературных источниках [1, 2, 4, 6, 8, 9].
На сегодняшний день наиболее распространенными методами диагностики как РВИ, так и микст-инфекций являются исследования фекалий с помощью иммуноферментного анализа, реакции косвенной гемагглютинации и латекс-агглютинации, полимеразной цепной реакции и иммунохроматографического анализа [2–4, 6, 11]. Однако, несмотря на хорошо изученные особенности клиники и патогенеза ОКИ, проблема их лечения сохраняет высокую актуальность в связи с увеличением количества микст-инфекций с ротавирусом.
Несмотря на значительный арсенал лекарственных средств, которые используются для лечения РВИ (применение в качестве этиотропной терапии различных иммуноглобулиновых препаратов и рекомбинантных интерферонов, а в качестве патогенетической терапии – сорбентов, эубиотиков и препаратов для оральной регидратации), сохраняется необходимость поиска лекарственных средств, способных улучшать состояние больного и ускорять процесс его выздоровления [1, 4, 6].
В качестве неадсорбируемых топически активных антисептиков широко известны нитрофурановые препараты (фуразолидон, фуразидин, нитрофурантоин, нифуроксазид и др.). Нитрофураны проявляют антимикробную активность в отношении как грамположительных, так и грамотрицательных бактерий. Они конкурируют с флавиновыми ферментами, нарушают синтез нуклеиновых кислот, угнетают метаболизм пирувата, активность дегидрогеназ, альдолаз и транскетолаз, что в целом изменяет энергетический обмен микробной клетки, тем самым блокируя ее рост и размножение. В отличие от антибиотиков нитрофураны стимулируют иммунитет за счет повышения фагоцитарной активности лейкоцитов, усиления комплементсвязывающей способности сыворотки крови, увеличения содержания антител в крови и адсобционно-поглотительной способности ретикулоэндотелиальной системы печени и селезенки [7].
Фармакоэпидемиологические исследования свидетельствуют, что в России остается широко распространенной практика назначения фуразолидона, к которому наблюдается высокий уровень резистентности основных патогенных микроорганизмов. Последними клиническими исследованиями доказано, что санирующая эффективность фуразолидона в отношении шигелл составляет всего 57,2 %, сальмонелл – 33,3 %, а клебсиелла пневмонии и энтеробактер практически не чувствительны к препарату [9]. Кроме того, практически во всех экономически развитых странах применение фуразолидона ограничено не только в связи с высоким уровнем устойчивости, но и из-за низкой безопасности, особенно среди детей и лиц пожилого возраста.
Одним из современных нитрафурановых препаратов, в качестве активного содержащим вещества нифуроксазид, является Энтерофурил (АО “Босналек”, Босния и Герцеговина), который на протяжении последних лет активно используется благодаря ряду его положительных свойств.
Энтерофурил является местнодействующим кишечным антисептиком и из просвета желудочнокишечного тракта не всасывается. В ходе интенсивного изучения Энтерофурила доказано, что в терапевтических дозах препарат оказывает бактериостатическое, а в высоких дозах – бактерицидное действие. Предположительно он ингибирует активность дегидрогеназ и синтез определенных белков в клетках бактерий, в результате чего нарушаются процессы роста и деления бактериальной клетки. Прямой антимикробный эффект установлен в отношении ряда возбудителей ОКИ и активных условно-патогенных микроорганизмов, таких как Salmonella typhimurium,Yersiniaenterocolitica, Shigelladysenteriae, Escherichiacoli, Clostridiumdifficile, Klebsiellapneumoniae, Enterobacterspp., Campilobacterspp., Citrobacterspp., Streptococcuspyogenes, Staphylococcuspyogenes.
Такой широкий спектр антимикробного действия обосновывает применение Энтерофурила как антидиарейного и антисептического средства при ОКИ (как разумная альтернатива антибиотикам), а также дисбактериозе кишечника.
Преимуществом препарата считается его хорошая переносимость при минимуме нежелательных реакций, что позволяет использовать Энтерофурил для детей раннего возраста, а также беременных и кормящих женщин. В то же время необходимо учитывать, что недоношенным и детям в первый месяц жизни все препараты нитрофуранового ряда, в т. ч. Энтерофурил, противопоказаны, поскольку в условиях незрелости глюкозо-6-фосфатдегидрогеназы способны вызывать гемолиз.
Энтерофурил является одним из наиболее доступных антимикробных препаратов, выпускаемых в детской форме (суспензии), обеспечивающей легкость предписанного режима дозирования в зависимости от возраста ребенка. Среднесуточные дозы препарата в суспензии составляют для детей в возрасте от 2 до 6 месяцев 7,5 мл при 3-кратном приеме, до 2 лет – 10,0 мл при 4-кратном приеме, старше 2 лет – 15,0 мл при 3-кратном приеме. Детям с 6 лет и взрослым назначают по 2 капсулы препарата 3–4 раза в сутки.
Цель настоящего исследования состояла в оценке эффективности применения Энтерофурила в комплексном лечении детей, больных гастроэнтеритами вирусно-бактериальной этиологии.
Материал и методы
В специализированной Краевой детской инфекционной больнице г. Краснодара изучены эффективность и переносимость применения препарата Энтерофурил в комплексном лечении больных гастроэнтеритами, вызванными вирусно-бактериальными возбудителями.
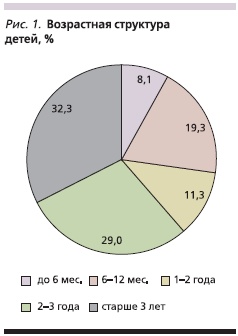
На стационарном лечении за период с мая 2011 по август 2011 г. находились 62 ребенка (34 мальчика и 28 девочек). Из них у 5 (8,1 %) детей отмечено тяжелое течение болезни, у 57 (91,9 %) — среднетяжелое. Возрастная структура детей представлена на рис. 1. Большая часть обследованных, а именно 55 (88,7 %) детей, были в возрасте до 3 лет. Среди больных грудного возраста было больше детей второго полугодия жизни.
При поступлении в стационар всем детям проводились общеклинические обследования, выполняли копроцитограмму, традиционные бактериологические исследования кала на Shigella, Salmonella, Escherichia coli и условно-патогенную флору кишечника. Кроме того, проводилось исследование фекалий на наличие РВИ. Ротавирусы выявлены также с помощью полимеразной цепной реакции. Забор материала проведен в первые двое суток после госпитализации больных, но не позднее пятых суток заболевания.
В качестве вирусного компонента у всех детей выявлен ротавирус. В 9,6 % случаев (у 6 детей) в качестве бактериального агента обнаружена E. coli, в 27,4 % (у 17 детей) выявена условно-патогенная флора.
Больные были распределены в две группы. В первую группу (сравнения) вошли 30 детей, которые при поступлении в стационар получали базисную терапию. Данная терапия включала диетическое низколактозное питание, применение сорбентов, ферментов, эубиотиков, препаратов для оральной регидратации. Во вторую (основную) группу вошли 32 ребенка, которые получали кроме базисной терапии препарат Энтерофурил. Лечение проводилось с первого дня госпитализации, Энтерофурил назначался в соответствии с возрастом: с 2 до 6 месяцев – по 2,5 мл 3 раза в сутки, от 6 месяцев до 2 лет – по 2,5 мл 4 раза в сутки, старше 2 лет – по 5 мл 3 раза в сутки, старше 6 лет – по 2 капсулы 3 раза в сутки. Продолжительность лечения колебалась от 3 до 5 суток. Энтерофурил отменяли через 2 суток после нормализации стула.
Исследуемые группы больных сравнения были репрезентативны по возрасту и тяжести состояния.
Эффективность назначенных схем лечения оценивалась по регрессу основных клинических симптомов (лихорадки, рвоты, признаков токсикоза и эксикоза), нормализации аппетита, динамике нормализации стула, а также по данным копроцитограммы и продолжительности применения интенсивной терапии.
Результаты
У большей части – 45 (72,6 %) – больных заболевание протекало на отягощенном преморбидном фоне. Наиболее часто встречалась железодефицитная анемия (24 больных, 38,7 %), у 18 (29,0 %) детей отмечен аллергологический анамнез, у 4 (6,5 %) – имели место проявления рахита, 5 (8,1 %) больных состояли на диспансерном учете как часто болеющие дети.
У большинства (56 человек, 90,3 %) пациентов заболевание начиналось остро. Симптоматика развивалась в полном объеме в первые двое суток заболевания. Большая часть детей были госпитализированы в ранние сроки (в первые часы от начала заболевания или в течение первых двух суток). Шесть пациентов в связи с постепенным развитием клинических симптомов гастроэнтерита были госпитализированы на 3–4-е сутки заболевания.
Сравнительный анализ клинической эффективности предложенных схем лечения показал, что у детей основной группы быстрее, чем у детей группы сравнения, исчезали симптомы интоксикации и признаки диспепсического и диарейного синдромов (см. таблицу). Так, у пациентов основной группы повышение температуры тела имело место на протяжении 2,6 ± 0,9 суток, тогда как в контрольной группе температурная реакция сохранялась в течение 4,2 ± 1,1 суток.
Таблица. Продолжительность основных клинических симптомов и лечебных мероприятий (дни) при вирусно-бактериальном гастроэнтерите у детей в зависимости от проводимой терапии (М ± m).
У больных, которые получали Энтерофурил, рвота исчезала на сутки раньше, чем у детей группы сравнения (1,9 ± 0,7 против 2,9 ± 0,8 суток). Кроме того, кратность рвоты значительно уменьшалась уже в первые сутки приема препарата 78,1 % больных, в то время как в группе сравнения такие изменения наблюдались только у 36,7 % пациентов. У большинства (75 %) детей основной группы уже на третьи сутки лечения наблюдались нормализация аппетита и восстановление адекватной оральной регидратации, в то время как в группе сравнения подобная динамика наблюдалась только у 13 (43,3 %) больных. Средняя продолжительность эксикоза у пациентов основной группы составила 2,1 ± 0,5 против 3,6 ± 0,7 суток в группе сравнения, что на 1,5 суток меньше. Признаки интоксикации у больных основной группы исчезали на двое суток быстрее, чем в группе сравнения (2,4 ± 0,5 и 4,1 ± 0,6 суток соответственно; р < 0,05). Средняя продолжительность диарейного синдрома на фоне приема Энтерофурила была почти в 2 раза меньше, чем в группе сравнения (3,1 ± 0,7 и 6,2 ± 0,8 суток соответственно (р < 0,01).
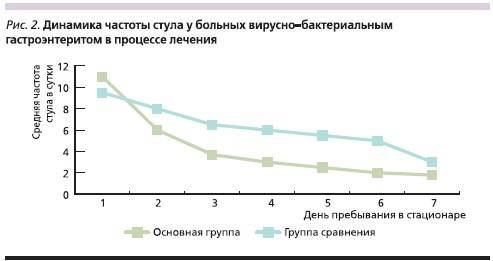
Среди больных основной группы на протяжении первых трех суток лечения Энтерофурилом частота стула значительно уменьшалась и составляла 4 раза в сутки по сравнению с группой сравнения, в которой количество испражнений уменьшалось постепенно и составило 7–8 раз в сутки. На 6-е сутки пребывания в стационаре у детей основной группы частота стула нормализовалась и составила 2 раза в сутки, тогда как среди больных группы сравнения повышение частоты стула наблюдались еще на 7-е сутки лечения (рис. 2).
Параллельно с улучшением клинической картины наблюдалась положительная динамика лабораторных показателей. У 22 (68,8 %) пациентов, которые получали Энтерофурил, нормализация показателей копроцитограммы была отмечена к 4-м суткам лечения, в то время как показатели ферментативной недостаточности в группе сравнения нормализовались лишь у 12 (40 %) пациентов.
Сравнительный анализ эффективности предложенных схем лечения показал, что лишь у 11 (34,3 %) больных основной группы применялась инфузионная терапия, продолжительность которой составила 1,5 ± 0,5 суток, в то время как в группе сравнения инфузионную терапию получали 50 % детей, при этом продолжительность ее составила 3,2 ± 0,7 суток (р < 0,05). Применение препарата Энтерофурил в комплексном лечении больных гастроэнтеритами вирусно-бактериальной этиологии позволило уменьшить сроки пребывания больных в стационаре с 7,4 ± 2,4 суток в группе сравнения до 5,2 ± 1,6 – в основной группе.
Энтерофурил хорошо переносился больными, был удобен в дозировании, побочных эффектов при его использовании у наблюдавшихся нами больных не выявлено.
Выводы
- Одной из важных проблем современной инфектологии являются ОКИ. Среди них преобладает секреторная диарея, при которых РВИ является ведущим этиологическим фактором.
- Применение препарата Энтерофурил в комплексном лечении больных гастроэнтеритом вирусно-бактериальной этиологии ускоряет улучшение общего состояния больных, нормализацию аппетита, сокращает продолжительность лихорадки, рвоты, интоксикации и диарейного синдрома, а также в 2 раза уменьшает продолжительность инфузионной терапии по сравнению с контрольной группой. Это позволяет сократить сроки пребывания в стационаре на 2,3 суток по сравнению с группой детей, получавших базисную терапию.
- Энтерофурил хорошо переносится больными, удобен в дозировании и применении, отказов от приема или нежелательных явлений при его использовании не наблюдалось.
- Проведенные исследования по применению препарата Энтерофурил в комплексном лечении детей с вирусно-бактериальным гастроэнтеритом свидетельствуют об эффективности и необходимости его применения при данной патологии.
Информация об авторах:
Соболева Наталья Геннадьевна – доктор медицинских наук, научный консультант
ГБУЗ "Специализированная клиническая детская инфекционная больница".
Тел. 8 (861) 222-03-11;
Тхакушинова Нафисет Хусейновна – кандидат медицинских наук, главный врач
ГБУЗ "Специализированная клиническая детская инфекционная больница".
Тел. 8 (861) 222-03-11


