Постоянная подкожная инфузия инсулина (ППИИ) с помощью инсулиновых дозаторов (помп) становится все более популярным методом инсулинотерапии людей с сахарным диабетом 1 (СД1) и 2 (СД2) типов [15]. Предпочтение ППИИ связано прежде всего с улучшением качества жизни пациентов на фоне стабилизации показателей гликемии, снижением риска гипогликемий и более гибким контролем заболевания по сравнению с инъекционной инсулинотерапией (ИИ) [2–4, 8, 10, 14, 15, 19].
Метод ППИИ отличается от ИИ в первую очередь тем, что в нем используется только один вид инсулина – человеческий простой инсулин (ЧПИ) или ультракороткий аналог инсулина (УАИ), что позволило усовершенствовать фармакокинетические параметры препарата на фоне ППИИ [12, 13, 18]. Подача инсулина осуществляется инсулиновым дозатором (помпой) по базис-болюсному принципу.
Базисный принцип работы помпы основывается на круглосуточной автоматической подаче микродоз ЧПИ или УАИ каждые несколько минут (в зависимости от модели инсулиновой помпы), что позволяет имитировать секрецию инсулина здоровой поджелудочной железой, особенно при использовании УАИ, отличающихся по степени всасываемости менее чем на 3 % в течение суток [12, 13]. Скорость подачи инсулина программируется в соответствии с показателями гликемии вне приемов пищи и может быть изменена в зависимости от индивидуальных особенностей углеводного обмена и режима дня. Однажды запрограммированная базальная скорость не требует дополнительных нажатий кнопок каждый раз, когда по физиологическим потребностям организма в течение суток требуется увеличение или снижение скорости введения инсулина. Такой индивидуальный подход к введению инсулина снижает риск развития гипогликемии в ночное время или в отсутствие приема пищи, а также позволяет избегать “феномена утренней зари”. В любой момент пациент может самостоятельно увеличить или снизить поступление инсулина с помощью временной базальной скорости (ВБС), например в период болезни или повышенной физической активности. Более низкая суточная потребность в инсулине на фоне ППИИ, отсутствие депо инсулина, как в случае ИИ, способствуют снижению риска гипогликемий, избавляют от необходимости принимать пищу в отсутствие чувства голода, позволяют избегать инсулинорезистентности и значительной прибавки массы тела [4, 6, 14, 16, 19].
Постпрандиальные колебания гликемии при использовании помпы нивелируются болюсным введением инсулина, которое может быть индивидуально запрограммировано в зависимости от вида пищи. “Нормальный” болюс вводится, как правило, на углеводную пищу или с целью снижения гипергликемии. Выбранная доза в “пролонгированном” болюсе вводится заранее (от 30 минут до 8 часов). “Многоволновой”, или болюс “двойной волны”, содержит “нормальный” и “пролонгированный” болюсы, процентное распределение которых рассчитывается пациентом в зависимости от состава пищи, планируемой к приему. “Пролонгированный” и “многоволновой” болюсы применяются при сложном составе пищи (богатой белком и жиром), гастропарезе, раннем токсикозе беременных, при необходимости постепенного снижения гипергликемии (у лиц с пролиферативной ретинопатией, пожилых людей). Использование болюсов различных видов обеспечивает пациентам высокую степень свободы в повседневной жизни, позволяя избегать постпрандиальной гипергликемии [5, 7, 9, 17].
Алгоритмы расчета потребности в базальном инсулине, пищевого и корректирующего болюсов могут быть разными [1, 17]. Нет доказательной базы по преимуществам того или иного алгоритма. В основе расчета базальной потребности могут быть масса тела пациента или дозы инсулина, применяемые при ИИ, из которых уже в зависимости от степени компенсации углеводного обмена рассчитывается суточная потребность в инсулине для перевода на ППИИ [1]. Однажды установленная базальная скорость не может оставаться постоянной. Периодически она требует пересмотра и пересчета, т. к. на потребность в базальном инсулине влияет множество факторов – стресс, менструальный цикл, заболевание, беременность, операции, увеличение физической активности. К сожалению, помпа не является полным аналогом поджелудочной железы, и при возникающих экстренных жизненных обстоятельствах требуется моментальное изменение дозы вводимого инсулина, что возможно при использовании функции временной базальной скорости (ВБС).
Временная базальная скорость
ВБС введения инсулина пациент должен уметь запрограммировать самостоятельно в любой момент, когда требуется увеличить или снизить поступление инсулина на короткий период времени. Временное снижение скорости введения базального инсулина может варьироваться от 10 до 90 %, а повышение – от 110 до 200 %, временнoй отрезок будет зависеть от выбора пациента в зависимости от ситуации.
Сниженная ВБС должна применяться пациентом при физической активности. Прежде всего ему необходимо определить интенсивность нагрузки – легкая, средняя или тяжелая. Под физической нагрузкой легкой степени подразумевается пешая прогулка, ходьба по супермаркету, уборка дома, работа в саду. Физическая нагрузка средней степени – это 30 минут бега, игра в бадминтон, пляжный волейбол, неспортивное плавание, занятия йогой. Интенсивной нагрузкой может быть игра в футбол, спортивное плавание, катание на велосипеде по пересеченной местности, шейпинг.
При физической нагрузке легкой степени рекомендуется ВБС 70–80 % за час до нагрузки и на период до ее окончания. Если нагрузка незапланированная, а уровень гликемии не превышает 6 ммоль/л, пациенту лучше принять 10 г легкоусвояемых углеводов без введения болюса и запрограммировать ВБС 70–80 % на всю продолжительность нагрузки, чтобы избежать гипогликемии.
При физической активности средней интенсивности ВБС может быть от 30 до 50 % за час до, во время и в течение часа после нагрузки. Если в первые часы после нагрузки имеется склонность к гипогликемиям, возможно продление ВБС 70–90 % еще на 2–4 часа.
При тяжелой физической нагрузке резко повышается риск гипогликемии, в т. ч. и тяжелой. Уже за 1–2 часа до нагрузки требуется ВБС 50 %, далее 0 % на время нагрузки с ежечасным контролем гликемии. При тенденции к гипогликемии необходимо принять 10 г легкоусвояемых углеводов без введения болюса. ВБС после интенсивной нагрузки может составлять 50–80 % на 6–12 часов в зависимости от уровня гликемии. Если тяжелая нагрузка была в вечернее время, ВБС оставляется на всю ночь.
При возникновении незапланированной физической нагрузки (например, пациент опаздывает на работу и вынужден идти быстрым шагом или бежать) функция ВБС не подходит, т. к. ее эффект проявляется через 1–2 часа после подключения. В данном случае лучше всего принять 10–15 г легкоусвояемых углеводов без дополнительного введения болюса, чтобы избежать гипогликемии.
Наиболее распространенная ситуация повышения ВБС введения инсулина – это простуда или любое другое заболевание с повышением температуры, длительный стресс. В период болезни или длительного стресса ВБС увеличивается до 120–150 % в сутки, а если у женщины растет потребность в инсулине во второй половине менструального цикла, сначала используется ВБС 130–150 %, чтобы подобрать дозы базального инсулина, а затем программируется другой базальный профиль на период предменструального синдрома.
Типы болюсов
Постпрандиальная гликемия контролируется болюсным введением инсулина, требующим участия пациента в оценке состава пищи и состояния его здоровья, измерения уровня гликемии перед едой, а также выбора типа введения болюса, чтобы минимизировать колебания гликемии после еды. Использование различных типов болюсов обеспечивает пациентам бoльшую свободу в повседневной жизни и способствует снижению постпрадиальной гликемии [5].
При выборе типа болюса пациент должен учитывать следующие факторы, влияющие на скорость всасывания углеводов:
- количество углеводов, белков и жиров в принимаемой пище;
- объем порции, ее гликемический индекс (ГИ);
- прием препаратов, влияющих на углеводный обмен (глюкокортикоиды, оральные контрацептивы, токолитики);
- температура и длительность приема пищи;
- уровень гликемии перед едой;
- углеводный эквивалент и коэффициент чувствительности в данное время суток;
- наличие таких осложнений СД, как гастропарез, энтеропатия, а также интеркуррентного заболевания, стресса;
- интенсивность физической наг-рузки;
- день менструального цикла или срок беременности.
Обучение анализу вышеперечисленных факторов, учету углеводов в граммах и ведению дневника самоконтроля позволяет пользователю помпы правильно запрограммировать дозу и способ введения болюса (см. таблицу), чтобы улучшить параметры постпрандиальных колебаний гликемии и достичь оптимального контроля СД в течение длительного времени.
Таблица.Выбор типа болюса.
Современные калькуляторы болюса значительно облегчают задачу пациентам в расчете дозы инсулина, необходимой на прием пищи и/или коррекцию гликемии [7, 11]. Так, например, факторы, выделенные жирным шрифтом (см. выше), можно запрограммировать в Советнике болюса системы “Акку-Чек Комбо”, который автоматически точно рассчитает дозу прандиального и/или коррекционного болюса в зависимости от текущего уровня гликемии, состояния здоровья и физической активности пациента в данный момент, наличия активного инсулина от предыдущих болюсов. Кроме того, в системе “Акку-Чек Комбо” имеется электронный дневник, сохраняющий до 1000 учетных записей, в которых содержатся данные об уровне гликемии, времени ее измерения, количестве углеводов, дозе и типе введенного на них болюса, состоянии здоровья. Систематизация этих данных позволяет врачу и пациенту быстро анализировать эффективность инсулинотерапии и корректировать лечение.
“Пролонгированный” болюс необходимо использовать, если в пище более 20 г белка, более 15 г жира или количество свежих овощей более 100 г. Длительность введения “пролонгированного” болюса подбирается индивидуально и, как правило, может варьироваться от 1 до 3 часов.
“Многоволновой” болюс применяется, если в пище присутствуют углеводы с высоким и низким ГИ и/или с большим содержанием белка и жира, например пицца, паста, бобовые. Как правило, 70 % рассчитанной дозы вводятся сразу стандартным болюсом, а оставшиеся 30 % –в течение часа, если в пище содержатся только углеводы, или в течение 2– часов, если в состав входят белок и жир.
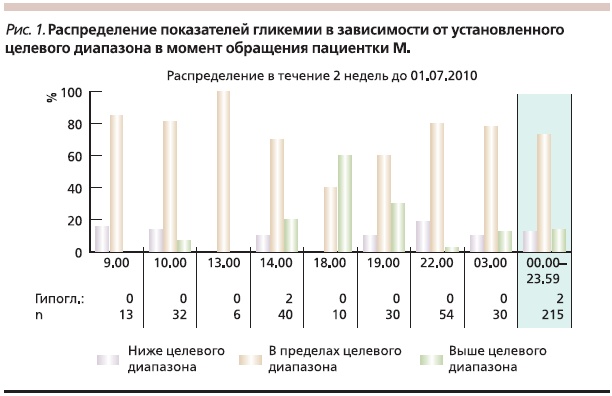
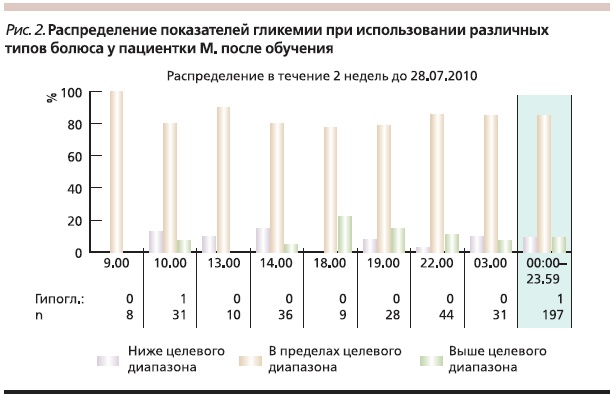
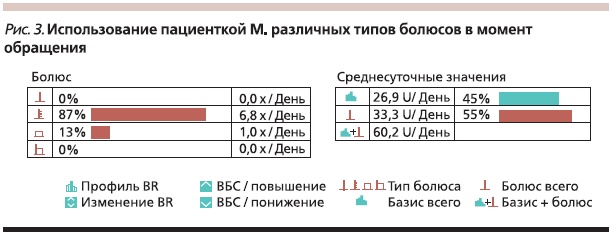
На рис 1 представлены данные по уровню гликемии в течение 2 недель у пациентки М., которая обратилась в наш центр с уже установленной инсулиновой помпой. Несмотря на соблюдение диеты, уровень постпрандиальной гликемии в 30–60 % случаев в 18–19 часов превышал целевой уровень. Анализ использования пациенткой различных типов болюса показал, что в основном после установки инсулиновой помпы она пользовалась стандартным болюсом. Обучение данной пациентки учету факторов, влияющих на скорость всасывания углеводов, и выбору типа болюса в зависимости от наличия этих факторов через 3 недели привели к значительному снижению у нее постпрандиальной гипергликемии (рис. 2).
Заключение
Таким образом, метод ППИИ можно расценивать как альтернативу ИИ, которая позволяет больным СД вести более свободный образ жизни, не подвергаясь значительным ограничениям в физической активности, организации режима и питании, добиваясь при этом компенсации СД. Однако достичь желаемых результатов пациент может только посредством изучения принципов работы помпы, особенностей действия инсулина при ППИИ, тщательно контролируя уровень гликемии и анализируя состав пищи. Нельзя не оценить важность дополнительного обучения пациента и специализированного наблюдения врача, имеющего клинический опыт применения инсулиновых помп, т. к. основными пользовательскими функциями помпы, позволяющими имитировать физиологическую секрецию инсулина, являются своевременное переключение на ВБС и грамотный выбор различных типов болюса.
Информация об авторе:
Арбатская Наталья Юрьевна – кандидат медицинских наук, врач-эндокринолог КДЦ ГКБ № 1
им. Н.И. Пирогова, ассистент кафедры эндокринологии и диабетологии ФУВ ГОУ ВПО РГМУ Росздрава.
E-mail: narbatskaya@yandex.ru


