Таргетная (биологически направленная) терапия на основе трастузумаба (рекомбинантного моноклонального гуманизированного антитела) является стандартом лечения больных ранним и диссеминированным раком молочной железы (РМЖ) с гиперэкспрессией и/или амплификацией рецептора эпидермального фактора роста 2-го типа (HER2). Способность трастузумаба увеличивать общую и безрецидивную выживаемость больных HER2-позитивным РМЖ доказана в клинических рандомизированных исследованиях [1]. Однако в некоторых случаях у больных РМЖ с гиперэкспрессией HER2, получающих трастузумаб-содержащую терапию, наступает рецидив или прогрессирование процесса. В такой ситуации показана смена лекарственного лечения (химио- или гормонотерапии). Но приемлема ли данная тактика по отношению к таргетным препаратам? К настоящему моменту накоплен значимый опыт продолжения применения трастузумаба после прогрессирования HER2-позитивного РМЖ (табл. 1 и 2), анализ которого, возможно, приблизит ответ на данный вопрос.
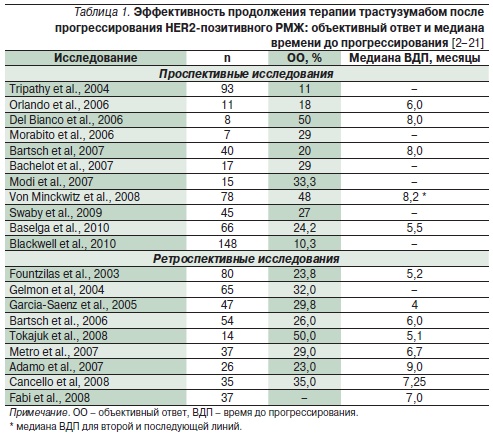
Таблица 2. Эффективность продолжения терапии трастузумабом после прогрессированияHER2-позитивного РМЖ: медиана общей выживаемости (ОВ).
В первое рандомизированное исследование III фазы (GBG-26) [9] были включены 156 больных HER2позитивным РМЖ с прогрессированием после 1-й линии лекарственной терапии или адъювантного лечения, основанного на трастузумабе. В ходе исследования больные рандомизировались в группу капецитабина в монорежиме или в группу капецитабина в комбинации с трастузумабом (КЦ + ТР). Первоначально планировалось включить в каждую группу по 241 больной, но исследование было преждевременно прервано Независимым комитетом обработки данных по нескольким причинам. Во-первых, стало ясно, что 150 больных достаточно, чтобы доказать достоверные различия между группами. Во-вторых, не этично было продолжать лечение больных РМЖ с гиперэкспрессией HER2 без таргетной анти-HER2-терапии. Частота ОО возросла с 27 (в группе химиотерапии) до 48 % при режиме КЦ + ТР (р = 0,011), клинически значимый эффект (ОО + стабилизация > 6 месяцев) – с 54,0 до 75,3 % (р = 0,0068), медиана ВДП увеличилось с 5,6 до 8,2 месяца (р = 0,034). ОВ (при средней длительности наблюдения 15,6 месяца) в группе капецитабина составила 20,4 месяца, а в группе КЦ + ТР – 25,5 (р = 0,26). При этом продолжение лечения трастузумабом характеризовалось благоприятным профилем безопасности и отсутствием выраженной кардиотоксичности (частота побочных явлений 3-й степени не превысила 5,2 %). Таким образом, в первом рандомизированном исследовании была показана очевидная тенденция к улучшению результатов лечения HER2-позитивного РМЖ при замене только комбинаторного цитостатика и продолжении терапии трастузумабом. Это подтверждается данными многочисленных исследований (табл. 1), в основном продемонстрировавших сравнительно высокую частоту ОО для 2–3-й линий лекарственного лечения HER2-позитивного РМЖ с медианой ВДП от 4 до 9 месяцев [2–21]. Существенное увеличение медианы ОВ от продолжения терапии трастузумабом после прогрессирования было зарегистрировано и в нерандомизированных исследованиях (табл. 2).
Во французском многоцентровом проспективном проекте Hermine [24] в качестве терапии 1-й линии 177 больных HER2-позитивным РМЖ получали трастузумаб. Из них после прогрессирования 107 пациенток продолжили лечение трастузумабом, а 70 – прекратили терапию препаратом. Разница в медиане ОВ больных была существенна: от начала применения трастузумаба > 27,0 месяцев в первой группе и 16,8 – во второй (р < 0,001); с момента прогрессирования заболевания – 21,3 и 4,6 месяца соответственно (р < 0,005).
В 2007 г. Jackisch и соавт. [27] представили результаты немецкого ретроспективного исследования, включившего данные из 142 центров Германии о 193 больных HER2-позитивным РМЖ с прогрессированием после 1-й линии лекарственной терапии, обязательно включавшей трастузумаб. В этом исследовании было отмечено увеличение медианы ОВ с 13,4 месяца (в группе больных, прекративших лечение трастузумабом после прогрессирования) до 20,1 – в группе продолживших терапию трастузумабом (р = 0,0014).
В итальянском ретроспективном многоцентровом исследовании (Campiglio и соавт., 2011) [28] ОВ также была выше среди больных HER-позитивным РМЖ, продолживших лечение трастузумабом при прогрессировании после 1-й линии трастузумаб-содержащего лекарственного лечения. При ОО на 1-ю линию терапии медиана ОВ составляла 27 месяцев у больных, продолживших применение трастузумаба, и 12 месяцев в группе пациенток не получавших трастузумаб (p < 0,001); среди больных с прогрессированием на 1-й линии терапии медиана ОВ составляла 21 и 11 месяцев соответственно (р < 0,001).
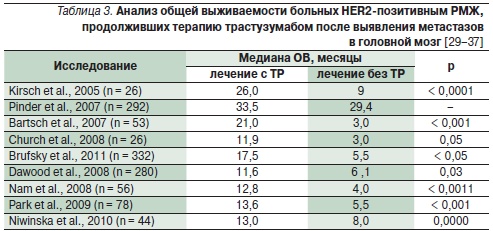
Исследования, представленные в табл. 3, продемонстрировали, что продолжение терапии трастузумабом с момента выявления метастазов в головной мозг также достоверно увеличивает ОВ больных HER2-позитивным РМЖ, прежде всего за счет эффективного контроля экстракраниальных метастазов. Так, медиана времени до прогрессирования интракраниальных очагов у больных РМЖ с гиперэкспрессией HER2, продолжавших получать трастузумаб после выявления метастазов в головной мозг, была больше по сравнению с теми, у кого трастузумаб был отменен (7,8 против 2,9 месяца; p = 0,006) [36].
Тесты invivoи invitroвыявили синергизм и отсутствие перекрестной резистентности между анти-HER2антителом – трастузумабом и обратимым тирозинкиназным ингибитором EGFR и HER2 – лапатинибом. В рандомизированном исследовании III фазы EGF104900 (Blackwell и соавт., 2010) было отмечено значительное увеличение выживаемости без прогрессирования больных HER2-позитивным РМЖ, получавших комбинацию лапатиниба и трастузумаба, по сравнению с монотерапией лапатинибом (12,0 против 8,1 недели; p > 0,008), а также клинически значимого ответа (24,7 против 12,4 %; р = 0,01). Медиана ОВ составила 51,8 недели в группе больных, продолживших лечение трастузумабом в комбинации с лапатинибом, и 39 недель при терапии одним лапатинибом (р = 0,106). У всех больных РМЖ с гиперэкспрессией HER2 в анамнезе имело место прогрессирование на фоне предыдущего лечения, основанного на трастузумабе [12]. При этом добавление лапатиниба к трастузумабу не привело к увеличению частоты серьезных кардиологических осложнений. Следовательно, своевременное таргетное воздействие трастузумаба и лапатиниба на два взаимодополняющих сигнальных пути (экстраи интрацеллюлярные домены) HER2 является приемлемой альтернативой комбинации таргетного препарата с химиотерапией, сохраняется при этом качество жизни больных.
В последнее время изучается ряд новых таргетных препаратов, в т. ч. T-DM1, пертузумаб и нератиниб. Трастузумаб-МСС-DM1 (T-DM1) – конъюгат анти-HER2-антитела трастузумаба и цитостатика DM1 (производного майтанзина – ингибитора полимеризации микротрубочек, в 20–100 раз более активного, чем винкристин), который высвобождается непосредственно в клетках HER2-позитивного РМЖ. Во II фазе исследования, несмотря на ранее проведенное лечение трастузумабом и цитостатиками (антрациклинами, таксанами, капецитабином), монотерапия T-DM1 при РМЖ с гиперэкспрессией HER2 была эффективной в 38,2 % случаев с медианой ВДП 7,3 месяца [38].
Пертузумаб – первое моноклональное рекомбинантное антитело, предотвращающее образование наиболее активных комплексов – HER2HER3-димеров, тем самым подавляющее ключевое звено в запуске HER2опосредованных сигнальных каскадов АКТ и МАРК, ответственных за патологическую пролиферацию и ингибицию апоптоза опухолевых клеток. В 2010 г. были опубликованы результаты II фазы исследования комбинации пертузумаба и трастузумаба для больных HER2-позитивным РМЖ с прогрессированием во время терапии трастузумабом [11]. При хорошей переносимости комбинации пертузумаба и трастузумаба ОО на проводимое лечение составлял 24,2 % (в т. ч. полный регресс в 7,6 % случаев), клинически значимый эффект – 50 %, медиана ВДП – 5,5 месяца. Эти результаты свидетельствуют о несомненном синергизме пертузумаба и трастузумаба вследствие связывания различных участков HER2, что, возможно, ведет к преодолению резистентности к трастузумабу.
Нератиниб (HKI-272) – необратимый ингибитор тирозинкиназэпидермального фактора роста 1-го, 2-го и 4-го типов. В отличие от других мультитаргетных тирозинкиназных пан-HER-ингибиторов (пелитиниба, канертиниба) нератиниб продемонстрировал выраженную эффективность в монорежиме. При использовании нератиниба в комбинации с трастузумабом у больных HER2-позитивным РМЖ, резистентных к трастузумабу, объективный ответ был зарегистрирован в 27 % случаев (в т. ч. полный регресс – 7 %) [10]. Медиана выживаемости без прогрессирования составила 19 недель. Выявленный синергизм этих двух таргетных препаратов, вероятно, также объясняется двойной блокадой внеклеточного и тирозинкиназного доменов HER2. Самыми частыми видами токсичности данной комбинации оказались эметогенный эффект и диарея, которые все же не являлись дозолимитирующими. Следовательно, двойную блокаду HER2 можно считать обнадеживающей перспективой таргетного лечения РМЖ с гиперэкспрессией HER2. При этом отбор больных для биологически направленной терапии по-прежнему остается важной проблемой, поэтому дальнейшее уточнение молекулярно-биологических характеристик РМЖ позволит ближе подойти к индивидуализации лечения.
Анализ кардиологической токсичности (табл. 4), одного из основных осложнений, лимитирующих совместное назначение трастузумаба и комбинаторных препаратов – цитостатиков (особенно антрациклиновых антибиотиков), показал, что продолжение лечения трастузумабом после прогрессирования HER2-позитивного РМЖ не привело к увеличению риска клинически значимых кардиологических осложнений, частота которых колебалась от 0,9 до 5,1 %. Тем не менее с учетом длительности назначения трастузумаба необходим постоянный мониторинг фракции выброса левого желудочка с целью выявления бессимптомного снижения последней и предотвращения в дальнейшем клинически значимых кардиологических проблем.

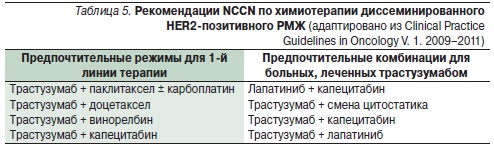
Таким образом, анализ многочисленных исследований показал, что продолжение терапии трастузумабом при прогрессировании и замена комбинаторного препарата достоверно улучшают результаты лечения HER2позитивного диссеминированного РМЖ. Эта концепция легла в основу рекомендаций NCCN по химиотерапии диссеминированного РМЖ с гиперэкспрессией HER2 в 2009 г., которые с тех пор не претерпели существенных изменений (табл. 5), но безусловно требуют дальнейшего подтверждения новыми рандомизированными исследованиями и поиска новых комбинаторных препаратов к трастузумабу.
Информация об авторах:
Семиглазова Татьяна Юрьевна – кандидат медицинских наук, старший научный сотрудник отдела терапевтической
онкологии ФГБУ “НИИ онкологии им. Н.Н. Петрова” Минздравсоцразвития РФ.
Е-mail tsemiglazova@mail.ru;
Семиглазов Владислав Владимирович – доктор медицинских наук, заведующий кафедрой
онкологии СПбГМУ им. акад. И.П. Павлова.
Е-mail:ssemiglazov@mail.ru;
Филатова Лариса Валентиновна – кандидат медицинских наук, старший научный сотрудник отдела
терапевтической онкологии ФГБУ “НИИ онкологии им. Н.Н. Петрова” Минздравсоцразвития РФ.
Е-mail: Larisa_Filatova@list.ru;
Чубенко Вячеслав Андреевич – кандидат медицинских наук, научный сотрудник отдела терапевтической
онкологии ФГБУ “НИИ онкологии им. Н.Н. Петрова” Минздравсоцразвития РФ.
Е-mail: vchubenko@me.com;
Брежнев Никита Владимирович – кандидат медицинских наук, врач-онколог химиотерапевтического
отделения с паллиативной помощью ФГБУ “НИИ онкологии им Н.Н. Петрова“ Минздравсоцразвития РФ.
Е-mail: nikitakis@mac.com;
Моисенко Федор Владимирович – кандидат медицинских наук, лаборант-исследователь отдела терапевтической
онкологии ФГБУ “НИИ онкологии им. Н.Н. Петрова” Минздравсоцразвития РФ.
Е-mail: fmoiseenko@me.com;
Латипова Дилором Хамидовна – аспирант отделения химиотерапии ФГБУ “НИИ онкологии
им. Н.Н. Петрова” Минздравсоцразвития РФ.
Е-mail: dilat77@mail.ru;
Гершанович Михаил Лазаревич – профессор, руководитель отдела терапевтической
онкологии ФГБУ “НИИ онкологии им. Н.Н. Петрова” Минздравсоцразвития РФ.
Е-mail: tsemiglazova@mail.ru


