Введение
Сахарный диабет (СД) – одно из самых распространенных эндокринных заболеваний человека, обусловленное нарушением секреции или низкой биологической активностью инсулина.
Рост внимания к СД обусловлен высокой распространенностью заболевания, быстрым увеличением числа больных, дорогостоящим лечением, ранней инвалидизацией, высокой летальностью, что делает диабет важной медико-социальной проблемой. К примеру, в Московской области в 2009 г. зарегистрированы 177 848 больных СД. Это составляет 2,7 % населения Московской области [9].
Тяжелым осложнением СД является синдром диабетической стопы (СДС). Патогенез СДС крайне сложен и с учетом возрастных изменений включает типичные для диабета микро- и макроангиопатию, остео- и невропатию, на фоне которых при присоединении инфекции развиваются гнойно-некротические поражения нижних конечностей, требующие оперативного вмешательства. В большинстве случаев центральную роль в развитии СДС играют невропатия (70–80 %), ишемия (5–12 %), деформация стопы (63 %) [9, 12]. При манифестации CД клинические признаки полиневропатии выявляются у 5 % пациентов, а при инструментальных исследованиях частота выявления поражения периферических нервов у больных СД достигает 100 % [2, 3, 14].
Сочетание гипергликемии с инсулинорезистентностью оказывает прямое повреждающее действие на сосудистую стенку, что способствует гиперкоагуляции и усугубляет нарушение микроциркуляции у пациентов с СДС. Поэтому коррекции гипергликемии должно придаваться первостепенное значение в лечении больных с гнойно-некротическими поражениями нижних конечностей [6, 13].
С учетом распространенности поражений магистральных сосудов нижних конечностей у больных СД 2 типа на первый план у этой категории пациентов выходят вопросы фармакологической коррекции ишемии и тканевой гипоксии. Это требует применения препаратов, активизирующих метаболизм в тканях, улучшающих их трофику и стимулирующих процессы регенерации. К числу таких лекарственных средств относится Актовегин – высокоочищенный гемодиализат, получаемый методом ультрафильтрации из крови телят. Препарат содержит физиологические компоненты, обладающие высокой биологической активностью: аминокислоты, олигопептиды, нуклеозиды, электролиты. Механизм действия Актовегина заключается в улучшении аэробного обмена за счет повышения поступления в ткани кислорода и глюкозы и их утилизации. Это ведет к стимуляции образования АТФ, нормализации энергетического метаболизма в условиях его недостаточности, улучшению обмена веществ и функционирования клеток [6, 11]. Активные компоненты препарата оказывают также инсулиноподобное действие. Накопленный опыт применения Актовегина у лиц, страдающих СД, свидетельствует, что на фоне его использования существенно замедляется прогрессирование диабетической ангио- и полиневропатии.
В связи с вышеизложенным нами было проведено исследование с целью определения эффективности препарата у пациентов с СДС, подвергнутых хирургическому вмешательству.
Материал и методы
Проведен ретроспективный анализ результатов комплексного лечения 230 пациентов с СДС, находившихся на лечении в Центре “Диабетическая стопа” Видновской районной клинической больницы с 2007 по 2009 г.; оценивалось влияние препарата Актовегин на микроциркуляторный кровоток у этой категории больных в послеоперационном периоде. Препарат вводился внутривенно капельно в дозе 2 г в сутки в виде 10или 20 %-ного раствора в течение 10–20 дней, затем переходили на пероральный прием Актовегина в дозе 1–2 таблетки (200–400 мг) 3 раза в сутки в течение 1–1,5 месяцев.
Основную группу составили 138 пациентов, лечение которых дополнялось внутривенным введением Актовегина. В контрольную группу были включены 92 пациента со сходным течением СД, находившихся в том же отделении, в тот же период времени и получавших стандартную терапию без использования Актовегина.
В обеих исследуемых группах длительность заболевания СД составила более 10 лет, средний возраст больных основной и контрольной групп составил 54,5 ± 7,2 и 57,3 ± 5,7 года. При поступлении в стационар у 74,6 % пациентов основной и у 52,9 % больных контрольной групп отмечена декомпенсация СД и течение заболевания расценивалось как тяжелое.
Пациенты обеих групп имели сочетание поздних осложнений СД и сопутствующих заболеваний, в основном преобладали ишемическая болезнь сердца (68,1 % в основной и 56,9 % в контрольной группах), постинфарктный кардиосклероз (38,6 и 38,2 % соответственно), артериальная гипертензия 3-й степени (63,9 и 49,3 % соответственно). Пациенты обеих групп имели различные формы гнойно-некротических поражений стопы, а именно гангрены, гнойно-некротические раны, флегмоны и их сочетания, при этом поражения захватывали несколько анатомических образований стопы.
Всем больным было проведено хирургическое лечение в объеме малых операций на стопе (некрэктомия, вскрытие флегмон подошвенных пространств, передняя резекция стопы с фасциотомией и тендэктомией, ампутации пальцев).
При выборе тактики лечения и объема хирургического вмешательства важную роль играла форма СДС. При обследовании выявлено, что в обеих группах преобладали больные с невропатической формой СДС: 44,6 % – в основной и 44,1 % – в контрольной группах.
Стандартное консервативное лечение включило проведение интенсивной инсулинотерапии, антибактериальной терапии, введение низкомолекулярных гепаринов, разгрузку пораженной конечности; местно применялись перевязочные средства.
Больные были обследованы до начала курса лечения и после его завершения. Показателем, свидетельствующим о нарушении микроциркуляции у больных СДС с гнойно-некротическими поражениями стопы, является уровень транскутанного напряжения кислорода (ТсрО2). Измерение ТсрО2 проводилось с помощью прибора TCM-4 (Финляндия).
Результаты и обсуждение
Хирургическое лечение пациентов с гнойно-некротическими поражениями стопы носило “сберегающий” характер и было направлено на купирование гнойно-воспалительного процесса и сохранение опорной функции конечности. Большинство больных были оперированы в первые 3 суток с момента поступления в стационар (59,1 и 58,8 % в основной и контрольной группах соответственно).
Наиболее часто больным проводили следующие оперативные вмешательства: ампутации пальцев (26,9 % в основной и 31,7 % в контрольной группах), трансметатарзальные резекции стопы (23,2 % в основной и 21,9 % в контрольной группах) и некрэктомии (16,3 % в основной и 26,8 % в контрольной группах) в сочетании с фасциотомией и тендэктомией (32 % в основной и 35,7 % в контрольной группах).
Клиническую эффективность проводимого послеоперационного лечения ран у больных с СДС оценивали по следующим параметрам: уменьшение отека в области послеоперационной раны, температурная реакция, гиперемия окружающих тканей, инфильтрация краев раны (табл. 1).
Таблица 1. Динамика системных изменений тканей стопы в зависимости от формы СДС
и проводимого лечения (сутки с момента операции).
Данные табл. 1 демонстрируют, что применение в послеоперационном периоде Актовегина способствует вне зависимости от формы СДС более быстрому исчезновению отека стопы (3–9-е сутки в основной группе, 6– 10-е – в контрольной), уменьшению локальной гиперемии стопы (1–5-е сутки в основной группе, 4–7-е в контрольной), исчезновению инфильтрации краев раны (4–8-е сутки в основной группе, 6–14-е в контрольной).
Скорость заживления послеоперационных ран оценивали по срокам появления грануляций и начала эпителизации (табл. 2). Данные табл. 2 отражают ускорение процессов репарации ран у больных основной группы. Так, появление грануляционной ткани в ране происходило у них в зависимости от формы СДС на 3–12-е сутки с момента оперативного вмешательства, а у пациентов контрольной группы –на 9–19-е сутки; эпителизация начиналась в основной группе на 8–19-е сутки, а в контрольной – на 11–23-е.
Таблица 2. Сроки появления грануляций и краевой эпителизации ран в зависимости
от проводимого лечения и формы СДС (сутки с момента операции).
В среднем на 3–4-е сутки от начала введения препарата Актовегин 91 % пациентов основной группы отмечали снижение выраженности болевого синдрома в нижних конечностях, объективное уменьшение отека, локальное потепление конечности, особенно у пациентов с нейроишемической и ишемической формами СДС.
Изменения уровня ТсрО2 у больных с различными формами СДС в основной (при применении Актовегина) и контрольной группах представлены на рис. 1 и 2.
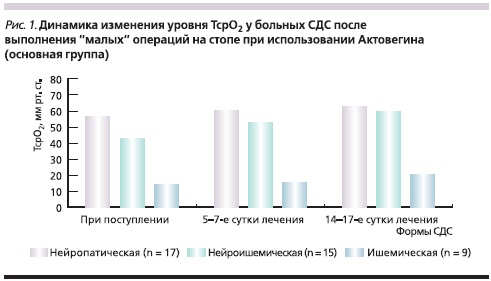
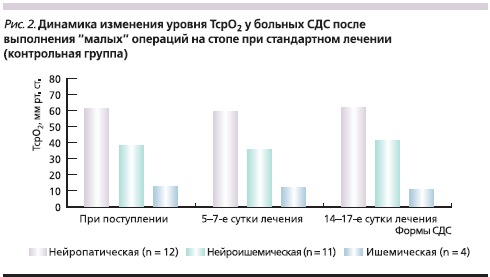
При поступлении у пациентов с нейропатической формой СДС выявлено незначительное уменьшение уровня кислородного насыщения тканей стопы, который составил 56,8 ± 4,6 мм рт. ст. в основной и 61,2 ± 4,8 мм рт. ст. в контрольной группах. У пациентов с ишемической формой СДС отмечено резкое снижение уровня насыщения тканей кислородом: 14,2 ± 0,89 и 12,8 ± 1,02 мм рт. ст. в основной и контрольной группах соответственно. У больных с нейроишемической формой СДС исходные показатели кислородного насыщения тканей составили в указанных группах 42,6 ± 2,8 и 38,4 ± 2,10 мм рт. ст. соответственно. Очевидно, что нарушение микроциркуляции более выражено при ишемической форме СДС.
При применении в послеоперационном периоде Актовегина у пациентов с нейропатической формой СДС уже на 5–7-е сутки лечения отмечено значительное повышение уровня ТсрО2, составившего 60,2 ± 4,23 мм рт. ст. У больных с нейроишемической формой СДС наблюдался более медленный прирост ТсрО2 (достигал нормальных значений только к 14-м суткам с момента начала лечения).
У пациентов с ишемической формой СДС, несмотря на проводимое лечение, уровень ТсрО2 оставался низким, находясь на субкритических значениях (20,6 ± 1,6 мм рт. ст.), что требует добавления к проводимой комплексной терапии препаратов из группы простагландинов. При исследовании динамики уровня кислородного насыщения тканей у больных, получавших стандартную терапию, показатель ТсрО2 у больных с нейропатической и нейроишемической формами СДС в ходе лечения практически не отличался от исходного при поступлении в стационар (61,2 ± 3,2 и 38,4 ± 2,7 мм рт. ст. соответственно), а при ишемической форме СДС не только не увеличивались, но даже имели тенденцию к снижению.
Следует также отметить, что применение препарата Актовегин не сопровождалось развитием побочных явлений.
Выводы
Хирургическое лечение пациентов с гнойно-некротическими поражениями нижних конечностей на фоне СД 2 типа в сочетании с применением препарата Актовегин позволяет стабилизировать течение раневого процесса и нормализовать сроки всех его фаз.
Применение препарата Актовегин в комплексном лечении больных с различными формами СДС позволяет достоверно улучшать уровень микроциркуляции по данным определения транскутанного напряжения кислорода.
Информация об авторах:
Кривихин Вячеслав Тимофеевич – заведующий 1-м хирургическим отделением МУЗ “Видновская районная клиническая
больница”, профессор кафедры общей и факультетской хирургии ГКА им. Маймонида;
Амбросимова Ольга Сергеевна – врач-хирург МУЗ “Видновская районная клиническая больница”;
Кривихин Денис Вячеславович – кандидат медицинских наук, врач-хирург МУЗ “Видновская районная клиническая больница”;
Елисеева Мария Евгеньевна – врач-хирург МУЗ “Видновская районная клиническая больница”;
Мастеров Андрей Сергеевич – врач-хирург МУЗ “Видновская районная клиническая больница”.



