За последние годы при различных сердечно-сосудистых заболеваниях отмечается существенное увеличение частоты возникновения синдрома сердечной недостаточности (СН), который характеризуется высокой частотой летальных исходов [1]. При СН в кардиомиоцитах нарушается энергетический обмен, сердце гипертрофируется, развивается фиброз, формируется ремоделирование сердца, падает сократительная активность, снижается фракция выброса, наблюдаются дегенеративные изменения в симпатической и парасимпатической нервных системах, отмечается неадекватная работа ренин-ангиотензин-альдостероновой системы – РААС [2–4]. Важную роль при хронической СН играют ишемия [2] и процесс воспаления, которые участвуют в повреждении и гибели клеток сердца, а также в падении сократительной активности миокарда [3–5]. Важным компонентом воспаления служат фагоциты крови, прежде всего нейтрофилы (микрофаги) и моноциты (предшественники тканевых макрофагов), специализирующиеся на образовании и секреции супероксид анионов (О2-) и провоспалительных цитокинов, которые инициируют хроническую СН (ХСН) и ответственны за последующее развитие этого патофизиологического состояния [6–10]. Более того, по мнению ряда авторов, дисбаланс образования противоположно действующих цитокинов воспаления является одним из главных условий возникновения СН [3]. Фагоциты крови продуцируют большое количество О2- в процессе «дыхательного взрыва» с помощью НАДФН (никотинамидадениндинуклеотидфосфата)-оксидазного ферментативного комплекса. Супероксид анион радикалы являются родоначальником других видов радикалов кислорода, повреждающих во время оксидативного стресса при взаимодействии с фагоцитами кардиомиоциты и эндотелиальные клетки коронарных сосудов [6, 11].
Поиск новых подходов и препаратов, эффективно подавляющих воспалительный процесс и его неотъемлемый компонент – оксидативный стресс, позволит избирательно влиять на такой полиэтиологический синдром, как ХСН. Очевидно, что с этой целью целесообразно использовать комбинации разных фармакологических агентов, имеющих разные точки приложения и механизмы действия, или исходно применять поликомпонентные препараты. К препаратам последнего ряда относится Актовегин – безбелковый ультрафильтрат крови телят, который широко применяется в клинической практике в качестве лекарственного препарата, оказывающего инсулиноподобное действие на транспорт глюкозы в клетки, усиливающего энергетический обмен клеток при нарушениях кровообращения и питания центральной нервной системы (ишемические инсульты, черепно-мозговые травмы), периферического кровотока (ангиопатии и трофические язвы голеней); при лечении ран (вялотекущие раны и пролежни), ожогов и лучевых поражений [12–14]. Этот препарат характеризуется низкой токсичностью и отсутствием побочных эффектов. В состав Актовегина входят разнообразные соединения – аминокислоты, пептиды, части нуклеиновых кислот, инозитол фосфоолигосахариды, жирные кислоты и другие компоненты с молекулярной массой менее 5 кДа.
Целью работы было изучить влияние Актовегина на спонтанный и индуцированный стандартным агентом уровень радикалов кислорода в образцах крови пациентов с II–III функциональными классами (ФК) по NYHA (New York Heart Association), а также исследовать его эффекты на генерацию радикалов кислорода в бесклеточной системе.
Материал и методы
Исследование проведено с участием 17 пациентов с СН II–III ФК по NYHA, проходивших лечение в условиях кардиологического отделения московской ГКБ № 59.
В соответствии с рекомендациями по ведению пациентов с СН [15] все пациенты получали ингибиторы ангиотензинпревращающего фермента, β-адреноблокаторы, петлевые диуретики. Восемь из этих пациентов получали антагонисты альдостерона.
Пациенты, участвовавшие в исследовании, находились в стабильном состоянии (отсутствие изменения в состоянии или терапии в течение 7 дней, предшествовавших исследованию), подписали информированное согласие на проведение терапии и взятие крови для анализов.
В исследование включены пациенты, имевшие следующие нарушения:
- клинические или лабораторные признаки острого воспаления или признаки хронических воспалительных заболеваний (хронического бронхита, пиелонефрита, артрита, системных заболеваний соединительной ткани);
- значимые изменения функционального состояния печени и почек;
- уровни аспартат- или аланинаминотрансферазы, превышающие в два раза уровень верхней границы нормального значения (для женщин – 97 мкмоль/л, для мужчин – 115 мкмоль/л);
- привычные интоксикации (наркомании, алкоголизм).
В работе использованы реактивы фирмы Sigma: люцигенин, люминол, формил пептид (FMLP – Formyl-Methionyl-Leucyl-Phenylalanine), диметил сульфоксид, гемоглобин, пероксид водорода, тролокс, Актовегин (Тakeda).
Влияние Актовегина на уровень радикалов кислорода было изучено на образцах цельной крови и в бесклеточной системе, генерирующей такие радикалы. Эффекты оценены по степени снижения (в %) уровня радикалов кислорода по сравнению с максимальным уровнем при действии стандартного стимулятора FMLP. Кровь забирали из локтевой вены утром натощак до очередного приема лекарственных препаратов в пластиковые пробирки Eppendorf, содержвшие гепарин (30 МЕ/мл). К исследуемым образцам добавляли люцигенин (конечная концентрация – 30 мкМ) [16, 17]. Измерение хемилюминесценции проведено на пробах цельной крови объемом 100 мкл.
Спонтанное и индуцированное FMLP-(3 мкМ)-образование радикалов кислорода (супероксид анионов и гидроксил радикалов) зарегистрировано при 25 °С на хемилюминометре «Биотокс-7» (Россия) в непрерывном режиме. Хемилюминесценцию измеряли в единицах импульсы в секунду (имп/с) и оценивали по интегральным значениям светосуммы за 5 минут.
Каждое воздействие изучалось не менее чем в 4–6 отдельных опытах.
При проведении опытов в бесклеточной системе радикалы кислорода образуются в результате действия пероксида водорода на ионы железа с переменной валентностью, локализованные в гемоглобине. В качестве среды инкубации использован 150 мМ-раствор NaCl, содержащий фосфатный буфер (рН 7,4), к которой добавляли люминол (30 мкМ) и гемоглобин (Hb – 0,3%). Реакцию запускали с помощью пероксида водорода (100 мкМ).
Статистическая обработка результатов проведена с использованием программы SigmaPlot. Данные представлены в виде среднего арифметического значения ± стандартное отклонение. Достоверными считали различия при р < 0,05
Результаты
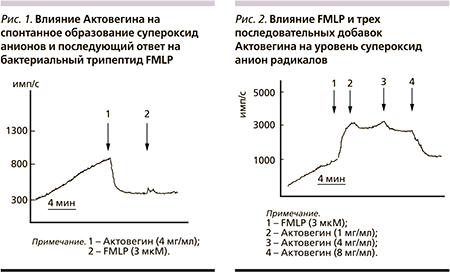
При изучении хемилюминесценции образцов цельной крови пациентов с СН было зарегистрировано спонтанное монотонное увеличение уровня радикалов кислорода во времени, которое возникает в результате взаимодействия клеток со стенками кюветы (рис. 1, 2). Относительное увеличение этого показателя варьировалось с 1,5 до 2,4. В состоянии покоя фагоциты крови не могут в выраженной степени подвергаться стимуляции, которая сопровождается секрецией протеолитических ферментов, других высокобиологически активных соединений и массы радикалов кислорода.
В результате воздействия Актовегина на фагоциты крови пациентов с СН происходит снижение уровня супероксид анионов. Ингибиторный эффект Актовегина зависит от его концентрации.
У некоторых пациентов такой эффект наблюдался при использовании Актовегина в дозе меньше 1 мг/мл, у большинства – при применении более высоких доз. Последующая обработка проб крови на фоне ингибиторного действия Актовегина стандартным стимулятором – бактериальным трипептидом FMLP (1–3 мкМ), не увеличивала уровня радикалов кислорода (рис. 1). В этих условиях Актовегин полностью блокировал последующую продукцию супероксид анионов, вызываемую FMLP.
На рис. 2 показаны результаты стимулирующего действия FMLP на предактивированные фагоциты крови при СН. Видно, что FMLP увеличивал образование супероксид анионов и этот эффект достигал максимума примерно через 1,5–2,0 минуты. Добавление FMLP сопровождалось выраженным увеличением уровня супероксид анионов в среднем в 3,2 ± 1,4 раза. Последующее добавление Актовегина в трех дозах (1, 4 и 8 мг/мл) сопровождалось снижением уровня О2-. Эти результаты свидетельствуют: Актовегин эффективно снижал уровень радикалов кислорода на максимуме ответа на формил пептид.
Ингибиторный эффект разных доз Актовегина на фоне действия FMLP показан на рис. 3. Формил пептид (3 мкМ) увеличивал образование супероксид анионов в среднем на 2051 ± 115 имп/с. В дозе 1 мг/мл Актовегин снижал действие FMLP до 1930 ± 141 имп/с, однако этот эффект был недостоверным в отличие от эффекта при использовании более высоких доз Актовегина (4 мг/мл – до 1480 ± 62 имп/с; 8 мг/мл – до 125 ± 13 имп/с).
Полученные результаты свидетельствуют, что Актовегин понижает «спонтанное» образование радикалов кислорода, ингибирует последующий ответ на воздействие одного из наиболее сильных стимуляторов фагоцитов – формил пептида и эффективно подавляет ответ на действие этого пептида на максимуме его действия.
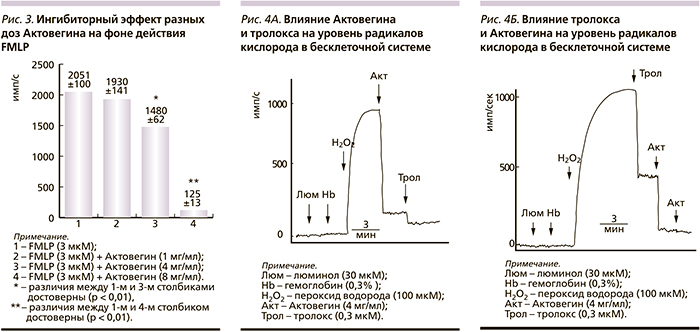
Ингибиторный эффект Актовегина может быть обусловлен двумя причинами: либо этот препарат обладает антиоксидантными свойствами, т.е. нейтрализует уже образовавшиеся радикалы кислорода; либо воздействует на НАДФН-оксидазный ферментативный комплекс фагоцитов и препятствует образованию радикалов кислорода. Чтобы ответить на эти вопросы, были проведены эксперименты в бесклеточной системе. На рис. 4 А показаны результаты действия Актовегина (4 мг/мл) на максимуме образования радикалов кислорода, запускаемого при добавлении пероксида водорода. Видно, что Актовегин в этой дозе эффективно снижает уровень радикалов кислорода и нейтрализует последующее действие стандартного антиоксиданта – тролокса [18, 19]. Напротив, добавление первым тролокса на фоне действия пероксида водорода сопровождалось снижением уровня радикалов кислорода и уменьшением последующего ингибиторного эффекта Актовегина (рис. 4 Б). С увеличением используемой дозы тролокса усиливался его ингибиторный эффект и в более выраженной степени подавлялось действие Актовегина.
Отсутствие аддитивности при совместном действии Актовегина и тролокса, когда с увеличением дозы одного препарата снижается или полностью блокируется действие другого, позволяет предположить, что Актовегин, подобно тролоксу, оказывает антиоксидантное действие.
Обсуждение
Исходно фагоциты крови могут находиться в одном из трех состояний: покоя, предактивации и стимуляции. В состоянии покоя энергетический обмен и все виды метаболизма находятся на самом низком уровне, при этом не наблюдается секреции цитокинов, протеолитических ферментов и радикалов кислорода, которые в совокупности могут повреждать окружающие клетки крови и эндотелиальные клетки сосудов. Смысл такого запрета, очевидно, обусловлен предупреждением цитотоксического воздействия фагоцитов на микроокружение в крови. При развитии воспаления в какой-либо ткани фагоциты крови получают химические сигналы, активирующие метаболизм и экспрессию белков на поверхности клеток.
В результате происходит адгезия фагоцитов на эндотелии сосудов. В это время развивается переход фагоцитов из состояния покоя в состояние предактивации (праймирования), когда образования радикалов кислорода еще не происходит. Процесс праймирования носит комплексный характер, который зависит от исходного состояния клеток и связан с активацией внутриклеточных сигнальных каскадов, взаимодействующих сложным образом между собой. Праймирующий эффект часто оказывают различные стимуляторы фагоцитов, однако они действуют в концентрациях примерно на два-три порядка более низких по сравнению с концентрациями, индуцирующими «дыхательный взрыв», характеризующийся образованием массы радикалов кислорода и формированием оксидативного стресса. В результате праймирования активированные клетки отвечают на действие стимулятора фагоцитов синергистически, т.е. наблюдается выраженный эффект потенцирования.
В качестве праймирующих агентов часто выступают провоспалительные цитокины, например интерлейкин-8 [20] и фактор некроза опухолей-α [21], радикалы кислорода [22], эндоток-сины [23].
В результате стимуляции, наступающей при адгезии фагоцитов крови пациентов с СН на поверхности кюветы, наблюдается «спонтанное» увеличение уровня радикалов кислорода (рис. 1 и 2), что позволяет предположить наличие в такой крови исходно предактивированных (праймированных) клеток. В пользу этого предположения говорит выраженная ответная реакция на последующее добавление бактериального стимулятора фагоцитов – формил пептида (FMLP) (рис. 2).
Очевидно, причиной такой предактивации является развитие хронического воспаления при СН, которое сопровождается секрецией цитокинов воспаления, оказывающих праймирующий эффект. Следует отметить, что подобное «спонтанное» образование О2- наблюдалось у всех проверенных пациентов с СН в отличие от контрольных проб крови здоровых доноров.
Актовегин, по-видимому, обладает антиоксидантными свойствами, поскольку он снижал уровень радикалов кислорода, продуцируемых фагоцитами крови (рис. 1–3), а также в бесклеточной системе в отсутствие НАДФН-оксидазного ферментативного комплекса (рис. 4А и 4Б). Более того, Актовегин и тролокс в насыщающих концентрациях в бесклеточной системе полностью подавляли действие друг друга, что позволяет предположить одинаковый механизм их действия. Ранее в ряде работ было показано, что тролокс (водорастворимый аналог витамина Е) является антиоксидантом, который удаляет уже образовавшиеся радикалы кислорода [18, 19].
Таким образом, очевидно, что Актовегин снижает уровень радикалов кислорода, продуцируемых фагоцитами крови пациентов с ХСН, вследствие прямого антиоксидантного действия. Эти результаты хорошо согласуются с нейропротективным эффектом Актовегина, полученным на изолированных первичных нейронах крыс in vitro, стимулированных β-амилоидным пептидом Аβ25–35 [12]. Защитный эффект Актовегина в этой системе наблюдался при его использовании в тех же дозах, что и в нашей работе.
На основании полученных результатов можно заключить, что Актовегин способен тормозить развитие хронического воспаления, обусловленного СН и системной гипоксией, эффективно снижать уровень радикалов кислорода при оксидативном стрессе.



