Сахарный диабет 2 типа (СД2) является хроническим прогрессирующим заболеванием. Постоянный рост числа больных СД позволяет отнести заболевание к “неинфекционной пандемии”. Число больных СД в мире достигло 285 млн человек, при этом 85–90 % из них составляют пациенты с СД2, которым болеют люди трудоспособного возраста – от 40 до 60 лет. Увеличивается распространенность ожирения и метаболического синдрома, предшествующих развитию диабета.
Медико-социальную значимость СД обусловливают его тяжелые сосудистые и неврологические осложнения. Наличие СД2 повышает риск развития инсульта в 2–3 раза, хронической почечной недостаточности – в 15–20, ишемической болезни сердца – в 2–5, хронической сердечной недостаточности – в 2,5 раза. Особенностью СД являются длительное малосимптомное течение и связанная с этим поздняя диагностика заболевания, тогда как уже на ранних этапах болезни гипергликемия приводит к развитию микро- и макрососудистых поражений. Многочисленные исследования свидетельствуют о том, что эффективный контроль СД позволяет снизить риск развития связанных с заболеванием осложнений.
У здорового человека инсулин стимулирует мембранный транспорт глюкозы и синтез гликогена в мышцах и жировой ткани, ингибирует липолиз в жировой ткани и глюконеогенез в печени. Базальная секреция инсулина осуществляется постоянно и обеспечивает снижение продукции глюкозы печенью и уровня свободных жирных кислот, а также повышение продукции гликогена. В ответ на прием пищи происходит двуфазное выделение инсулина. В последние годы показан значительный вклад инкретинов – гормонов желудочно-кишечного тракта – в регуляцию обмена глюкозы. Наиболее изученным является глюкагоноподобный пептид 1 (ГПП-1), обладающий глюкозозависимой инсулинотропной активностью.
Доказано, что больные с СД2 имеют генетическую предрасположенность к этому заболеванию. Другими факторами риска развития СД2 являются малоподвижный образ жизни, высококалорийное питание, пожилой возраст, женский пол. Патогенез СД2 обусловлен наличием двух дефектов: инсулинорезистентности (ИР) и дисфункции β-клеток поджелудочной железы. Вопрос о том, какой из дефектов первичен, обсуждается. ИР – это недостаточный биологический ответ клеток на действие инсулина при его достаточной концентрации в крови. Предполагается, что резистентность на уровне мышечной ткани генетически обусловлена и появляется намного раньше, чем развивается гипергликемия. ИР приводит к уменьшению поступления глюкозы в мышечную ткань и снижению образования гликогена. Синтез гликогена в мышцах играет основную роль в инсулинозависимом усвоении глюкозы, нарушение этого процесса приводит к постпрандиальной гипергликемии. Гидролиз триглицеридов и высвобождение большого количества свободных жирных кислот являются следствием резистентности жировой ткани к антилиполитическому действию инсулина. В печени свободные жирные кислоты становятся субстратом для синтеза атерогенных липопротеидов низкой (ЛПНП) и очень низкой плотности (ЛПОНП). При ИР на уровне печени наблюдается отсутствие ингибирующего действия инсулина на глюконеогенез, снижение синтеза гликогена в печени, активация гликогенолиза и как следствие – повышение продукции глюкозы печенью.
Для поддержания нормогликемии в условиях ИР функциональная активность β-клеток повышается. ИР и гиперинсулинемия способствуют развитию, а также прогрессированию атеросклероза. В дальнейшем секреторная активность β-клеток снижается, нарушаются ранняя фаза и пульсовой характер секреции инсулина, повышается соотношение проинсулин/инсулин как натощак, так и после приема пищи. Развивается нарушение гликемии натощак и нарушение толерантности к глюкозе. Снижение функциональной активности β-клеток и усугубление ИР ведут к манифестации СД.
Цели лечения СД2 должны быть индивидуальными для каждого больного в зависимости от возраста, ожидаемой продолжительности жизни, способности пациента к самоконтролю гликемии и распознаванию гипогликемического состояния. Для пациентов с СД легкого и среднетяжелого течения с высокой ожидаемой продолжительностью жизни целевые значения гликемии могут быть достаточно жесткими – уровень гликированного гемоглобина (HbA1c) < 6,5 %, глюкозы плазмы натощак ≤ 6,0 ммоль/л, глюкозы плазмы после еды ≤ 7,5 ммоль/л. Для основной группы пациентов показателями компенсации углеводного обмена являются уровни HbA1c < 7,0 %, глюкозы плазмы натощак < 6,5 ммоль/л, глюкозы плазмы после еды < 8,0 ммоль/л. У пожилых пациентов с ожидаемой продолжительностью жизни менее 5 лет, имеющих тяжелые сопутствующие заболевания, возможны менее строгие цели по гликемии – HbA1c < 8,0 %.
Таблица 1. Показатели контроля липидного обмена.
В исследованиях UKPDS, Steno-2, DCCT убедительно доказано, что достижение целевых значений гликемии снижает риск развития микрои макрососудистых осложнений. По данным ADA (American Diabetes Association), достижение значений HbA1c менее 7 %, систолического артериального давления (АД) менее 130 мм рт. ст., ЛПНП менее 100 мг % позволяет снизить риск развития микро- и макрососудистых осложнений на 75 %. Таким образом, помимо гликемического контроля у больных СД необходимо поддерживать оптимальные показатели липидного обмена (табл. 1) и АД (табл. 2).
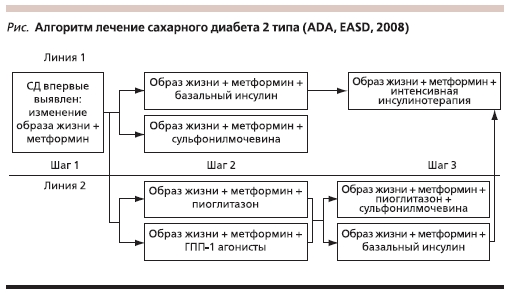
В настоящее время подходы к лечению СД2 определяет алгоритм, принятый EASD (European Association for the Study of Diabetes) и ADA в 2008 г. (см. рисунок). Общепринятая схема лечения на первом этапе рекомендует изменение образа жизни и назначение метформина, при неэффективности
(уровне HbA1c более 7 %) показана комбинация метформина с препаратами сульфонилмочевины или базальным инсулином. Следующим шагом является интенсивная инсулинотерапия.
При выявлении СД2 больному рекомендуются низкокалорийное питание с исключением легкоусвояемых углеводов, ограничение продуктов, содержащих животные жиры, регулярные физические нагрузки. Доказано, что регулярные физические нагрузки способствуют повышению чувствительности к инсулину, снижая риск развития осложнений СД. Однако только у 5–10 % больных СД2 в течение года после установления диагноза нефармакологические методы лечения обеспечивают достижение целевых показателей гликемии. Не вызывает сомнения, что воздействие на основные звенья патогенеза СД2, инсулинорезистентность и дисфункцию β-клеток поджелудочной железы будут способствовать эффективному контролю гликемии.
Алгоритм лечения СД2 уже на первом этапе рекомендует не только изменение образа жизни, но и применение метформина, который относится к группе бигуанидов и применяется в клинической практике более 50 лет. Монотерапия метформином приводит к снижению гликемии плазмы на 3,3–3,9 ммоль/л, HbA1c – на 1,0–2,0 %. Метформин не оказывает прямого действия на β-клетки поджелудочной железы, его сахароснижающий эффект обусловлен улучшением тканевой чувствительности к инсулину и повышением захвата глюкозы клетками печени и мышц. Экстрапанкреатические эффекты метформина заключаются в подавлении печеночной продукции глюкозы посредством угнетения глюконеогенеза и гликогенолиза, замедления всасывания глюкозы в желудочно-кишечном тракте. Метформин оказывает положительное влияние на липидный спектр и коагуляцию крови. Его применение способствует снижению уровней триглицеридов, холестерина и ЛПНП, уменьшению концентрации тканевого активатора плазминогена 1-го типа и активности VIII фактора свертывания крови. По сравнению с большинством применяемых сахароснижающих препаратов метформин имеет два важных преимущества: отсутствие повышения массы тела и низкий риск развития гипогликемических состояний.
В исследовании UKPDS (United Kingdom Prospective Diabetes Study) показано положительное влияние метформина на клинические исходы у пациентов с СД2 и ишемической болезнью сердца. К побочным эффектам метформина относят диспепсические явления. Правильное применение препарата с постепенным титрованием дозы и приемом во время еды позволяет снижать риск развития побочных эффектов. Частота развития лактатацидоза на фоне приема метформина минимальна и не превышает 8,4 случая на 100 тыс. больных в год. Развитие лактатацидоза обусловлено аккумуляцией метформина при несоблюдении противопоказаний и взаимодействий препарата. Метформин не рекомендуется назначать при почечной недостаточности, заболеваниях, ассоциированных с гипоксией, нарушениях функции печени, алкогольной интоксикации, беременности и лактации.
При неэффективности монотерапии метформином показана его комбинация с препаратами сульфонилмочевины или инсулином. Производные сульфонилмочевины усиливают эндогенную продукцию инсулина. Среди препаратов сульфонилмочевины наиболее выраженным гипогликемическим эффектом обладает глибенкламид. Его применение приводит к снижению уровня глюкозы плазмы на 2,8–3,3 ммоль/л, HbA1c – на 1,0–2,0 %. К преимуществам препаратов этой группы можно отнести быстрое достижение эффекта, положительное воздействие на синхронизацию инсули-
нового ответа. Недостатками являются риск развития гипогликемического состояния, прибавка массы тела. На рынке представлено две формы глибенкламида – немикронизированная и микронизированная. При применении меньшей дозы микронизированная форма глибенкламида обеспечивает большую биодоступность и эффективность. Микронизированная форма препарата способствует быстрому всасыванию, что делает возможным прием препарата непосредственно перед приемом пищи.
Комбинация двух препаратов (метформина и глибенкламида) в одной таблетированной форме удобна для пациента и повышает приверженность лечению. Примером такого комбинированного препарата является Глюкованс, в состав которого входят метформин и глибенкламид. Глюкованс показан при неэффективности монотерапии метформином или в том случае, когда при диагностировании СД значения HbA1c > 8,5–9,0 %. Глюкованс является единственным комбинированным препаратом, содержащим микронизированную форму глибенкламида, что позволяет снижать риск развития гипогликемических состояний и повышать биодоступность. Препарат имеет сбалансированную комбинацию метформина (500 мг) и глибенкламида (2,5 или 5 мг) в одной таблетке, удобен для титрации дозы.
Таким образом, возможность одновременного воздействия на оба звена патогенеза СД – инсулинорезистентность и дисфункцию β-клеток поджелудочной железы, обеспечивает высокую эффективность при использовании препарата Глюкованс, а удобство его применения повышает приверженность пациентов этому лечению.


