Сахарный диабет (CД) относится к категории социально значимых заболеваний и характеризуется высокой распространенностью, хроническим течением, высокой частотой развития осложнений и инвалидизации.
В соответствии с определением ВОЗ CД – это группа метаболических (обменных) заболеваний, характеризующихся гипергликемией, которая является результатом дефектов секреции инсулина, действия инсулина или обоих этих факторов.
В России, как и в других странах мира, число больных СД ежегодно увеличивается. В настоящее время в мире насчитывается 284 млн больных диабетом, что составляет приблизительно 6,4 % от населения планеты. К 2030 г. ожидается 439 млн больных, что составит 7,7 % [12]. В общей структуре диабета на долю СД 1 типа (СД1) приходится 3–6 %.
Известно, что при СД риск развития микро- и макрососудистых осложнений ассоциируется с возрастом пациента, длительностью заболевания и степенью компенсации углеводного обмена. Достижение оптимального контроля углеводного обмена на протяжении всей жизни пациента является важнейшим фактором профилактики поздних осложнений СД. Применяемые в настоящее время в России терапевтические цели контроля заболевания у взрослых пациентов с СД1 (см. таблицу) были одобрены ведущими российскими эндокринологами [1].
Обеспечение таких показателей углеводного обмена реально достижимо у обученных пациентов с высоким уровнем мотивации при постоянном мониторинге гликемии и адекватной коррекции доз вводимого инсулина, т. е. у больных, уделяющих больше внимания своему заболеванию.
Необходимость поддержания показателей гликемии у пациентов с СД1, особенно молодого возраста, близких к физиологическим значениям, подтверждена данными фундаментального клинического исследования DCCT. В этой работе рассматривалось влияние различных режимов лечения СД1 на частоту развития и степень тяжести поздних осложнений диабета. Оценка конечных результатов осуществлялась в двух группах пациентов. Первая группа включила 726 человек без признаков осложнений, характерных для СД, в частности без ретинопатии (группа первичной профилактики). Вторая группа включила 715 пациентов с проявлениями ретинопатии (группа вторичной профилактики). В каждой группе одним пациентам назначалась традиционная терапия, другим – интенсивная. Средняя продолжительность наблюдения за больными составила 6,5 лет.
У пациентов без диабетической ретинопатии интенсивная терапия при частом измерении содержания глюкозы в крови снижала риск развития данного осложнения минимум на 34 %, максимум – на 76 % .
Интенсивная терапия также оказала благоприятное воздействие на пациентов с признаками ретинопатии. На начальном этапе наблюдения у пациентов, находившихся на интенсивной терапии, прогрессирование ретинопатии выявлялось на 54 % реже, чем у больных, получавших традиционную терапию.
У пациентов, находившихся на интенсивной терапии, на 35 % снизилась частота поражения почек, которое оценивалось по уровню микроальбуминурии. Использование интенсивной терапии диабета привело к уменьшению клинически значимой микроальбуминурию в целом по группе на 56 %. В целом интенсивное лечение снижало риск развития клинически значимой нейропатии на 60 %. В группе первичной профилактики этот риск уменьшился на 70 % [4, 11].
Поскольку в основе патогенеза СД1 лежит абсолютный дефицит инсулина в результате аутоиммунного поражения β-клеток поджелудочной железы, единственным способом его лечения является заместительная терапия в виде интенсифицированной инсулинотерапии.
Цель заместительной инсулинотерапии больных СД1 – имитация нормальной физиологической секреции инсулина. В соответствии с рекомендациями ВОЗ и Международной диабетической федерации для лечения больных СД предпочтительно использовать генно-инженерный инсулин человека и его аналоги.
В физиологических условиях секреция инсулина складывается из его базального (постоянного) высвобождения для поддержания основного обмена и болюсной (пиковой) секреции в ответ на прием пищи или гипергликемию, вызванную выбросом контринсулярных гормонов в ответ на стрессовую ситуацию (рис. 1).
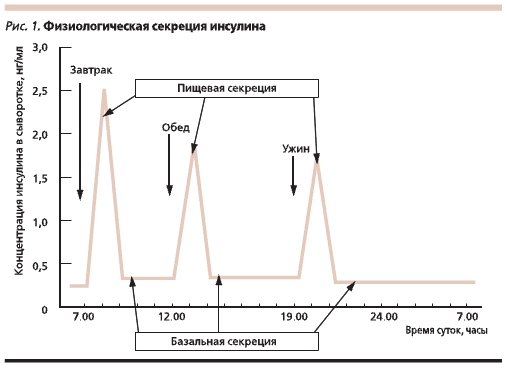
При проведении заместительной терапии инсулином схемы его введения должны быть максимально приближенными к режиму физиологической секреции β-клетками поджелудочной железы. Исторически введение инсулина начало проводиться с помощью специальных шприцов. Первый
в мире шприц для введения инсулина был выпущен в 1924 г. В настоящее время для введения инсулина все чаще используют многоразовые шприцручки со сменными картриджами или заправленные инсулином одноразовые шприц-ручки. С помощью шприцов и шприц-ручек введение инсулина осуществляется в основном в базисболюсном режиме: инсулин короткого или ультракороткого действия вводится перед основными приемами пищи 3 раза в день (имитация болюсной секреции), а инсулин продленного действия – 2 раза в день (имитация базальной секреции). При таком режиме введения инсулинов наблюдается флюктуация гликемии. Влияние на гликемию оказывают такие факторы, как уровень инсулина в крови в данный момент времени, физическая нагрузка, энергетические потребности организма, прием пищи. При использовании интенсифицированной инсулинотерапии, когда одновременно используются два типа инсулина, а введение осуществляется с помощью многократных ежедневных инъекций, учесть влияние всех факторов и полностью воспроизвести нормальную секрецию данного гормона не всегда удается.
Таблица. Целевые показатели углеводного обмена при СД1.
Вследствие этого остаются нерешенными многие проблемы. У части больных возникают ночные гипогликемии, когда уровень базального инсулина в организме человека в промежутке между 0 и 3 часами ночи выше, чем обычная потребность в гормоне. Управлять таким состоянием крайне сложно. При уменьшении дозы пролонгированного инсулина, вводимого перед сном, снижается вероятность возникновения ночной гипогликемии, однако часто наблюдается утренняя гипергликемия. Это связано с тем, что в ранние утренние часы потребность в инсулине возрастает (“феномен утренней зари”) и одновременно уменьшается концентрация гормона. Нивелировать повышение гликемии в утренние часы можно за счет дополнительного введения короткого или ультракороткого инсулина в 4–5 часов утра. Это ведет к неудобству в повседневной жизни, нарушению ночного сна, необходимости ежедневно делать до 6–7 инъекций инсулина. При введении инсулина, особенно продленного действия, в подкожно-жировой клетчатке формируется его “депо”. Это приводит к неравномерному всасыванию и непредсказуемым колебаниям в действии введенного инсулина. Следовательно, с учетом вышеизложенного повседневная жизнь больного диабетом на инсулинотерапии должна находиться в достаточно строгих рамках: физическая активность, спорт, секс, посещение кафе, ресторанов, прием алкоголя должны быть тщательно спланированными.
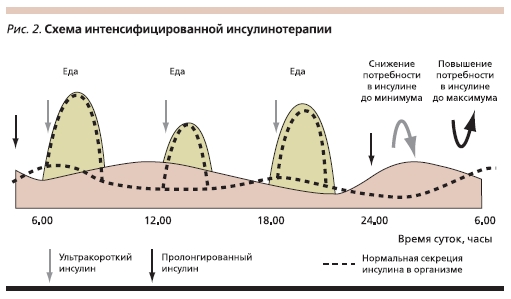
Интенсифицированная терапия инсулином с использованием в виде болюсного инсулина быстродействующих аналогов позволила повысить соответствие этого режима физиологическим потребностям (рис. 2). Внедрение в практику беспиковых аналогов базального инсулина также
обеспечило ряд клинических преимуществ по сравнению с традиционными пролонгированными препаратами. Поэтому интенсифицированная терапия инсулином в настоящее время остается наиболее доступным методом, позволяющим стабилизировать клинико-метаболические показатели, снижать риск осложнений, повышать качество жизни и улучшать прогноз диабета.
Манифестация заболевания в раннем возрасте, угроза развития острых и хронических осложнений уже в молодом возрасте в условиях плохой компенсации СД1 способствовали не только появлению новых препаратов инсулина, но и поиску наиболее оптимальных методов его введения, обеспечивавших лучший контроль углеводного обмена.
Инновационным методом, позволившим решить проблему более полной имитации физиологической инсулинемии, стала постоянная подкожная инфузия инсулина (ППИИ) с помощью портативной инсулинового помпы (ИП). В основе работы ИП также лежит базисно-болюсный принцип подачи инсулина. Это единственное на сегодняшний день устройство, обеспечивающее постоянное подкожное введение инсулина малыми дозами. Схема и принцип введения инсулина при применении ИП максимально соответствуют ритму работы здоровой поджелудочной железы, что обеспечивает оптимальный контроль уровня сахара в течение 24 часов. В ИП используется только один вид инсулина – аналог инсулина ультракороткого или инсулин короткого действия. Использование аналогов инсулина при ППИИ позволяет вводить их непосредственно перед едой в отличие от обычных инсулинов короткого действия, которые вводят за 30 минут до еды. Использование ППИИ дает возможность отказываться от введения продленного инсулина и оптимизировать базальную инсулинемию за счет введения малых доз ультракороткого инсулина (0,1 ЕД или более) каждый час, которые точно соответствуют индивидуальным особенностям организма больного СД1. Базальный уровень инсулина программируют в зависимости от уровня гликемии в ночные часы, вне приема пищи и физической нагрузки. Он может быть изменен в зависимости от индивидуальных особенностей углеводного обмена и режима дня. ИП позволяет программировать сразу несколько режимов введения базального инсулина, что снижает риск развития гипогликемии в ночные часы или между приемами пищи, а также позволяет избегать резкого повышения гликемии в ранние утренние часы. В любое время в зависимости от потребности организма в инсулине пациент самостоятельно может уменьшать или увеличивать базальный режим введения гормона, например в период занятия физическими упражнениями, или при необходимости отключать ИП на короткий период времени (до 30 минут). Создание физиологической потребности в базальном инсулине в течение суток позволяет избегать развития гипогликемических состояний, прибавки массы тела, отпадает необходимость в дополнительных приемах пищи.
Во время приема пищи потребность организма в инсулине повышается. В связи с этим необходимо дополнительное введение инсулина. Он дополнительно подается путем нажатия соответствующей кнопки на ИП, что соответствует болюсному введению. Таким образом, помповое введение инсулина осуществляется в двух режимах: непрерывной подачи инсулина в микродозах с шагом 0,1 ЕД (базальный режим) и введения инсулина на прием пищи или при высоком уровне гликемии (болюсный режим).
На фоне ППИИ необходимо стремиться к достижению таких же показателей гликемии, как у здорового человека:
• натощак – 4,4–6,0 ммоль/л;
• через 2 часа после еды < 8,0 ммоль/л;
• перед сном – 6,0–7,0 ммоль/л;
• в 3 часа ночи > 5,0 ммоль/л.
Для достижения этих показателей гликемии крайне важно правильно проводить подбор дозы инсулина в течение суток на начальных этапах помповой терапии с целью повышения приверженности пациента новому способу введения инсулина.
При переходе с режима многократных ежедневных инъекций на введение инсулина с помощью ИП следует учитывать:
• общую суточную дозу инсулина при ранее использованном режиме;
• уровень гликемического контроля (HbA1c);
• частоту и степень тяжести гипогликемий;
• новый целевой уровень глюкозы крови.
Адекватно подобранный базальный режим введения инсулина играет существенную роль в поддержании оптимального профиля суточной гликемии. Данный режим влияет на продукцию глюкозы печенью, глюконеогенез. Расчет часовой скорости введения инсулина в базальном режиме зависит от многих факторов, в первую очередь от возраста пациента, уровня секреции контринсулярных гормонов, физической активности.
В настоящее время существует несколько методов расчета базальной суточной дозы инсулина.
У пациентов c СД1 доля инсулина, приходящаяся на базальный режим, от общей помповой дозы может быть разной. Так, например, она может составлять 40 % для физически тренированных взрослых и при приеме пищи богатой углеводами у пациентов с остаточной секрецией инсулина и 60 % – для подростков, пациентов с резистентностью к инсулину, при приеме пищи с низким содержанием углеводов. Для большинства же пациентов эта доля составляет 50 %. Кроме того, возможно использование в базальном режиме более низких доз, например 20 % от общей суточной дозы, у физически активных пациентов.
Доза инсулина, поступающего в базальном режиме, делится на 24 часа для определения количества гормона, вводимого за 1 час (ЕД/ч).
При инициации терапии выбирается одна постоянная скорость введения инсулина в базальном режиме (используется только один режим введения; рис. 3.).
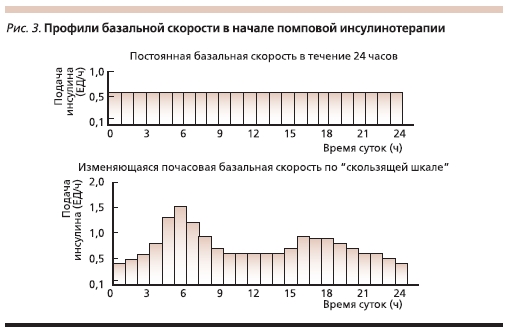
При наличии у больного феномена “утренней зари” в ранние утренние часы к базисной дозе добавляется 0,1 ЕД/ч; при наличии гипогликемий в ночное время базисная доза уменьшается на 0,1 ЕД/ч во временном интервале, когда фиксировались эпизоды гипогликемии. При гипергликемии
в ночное время или более чем через 3 часа после приема пищи к базисной дозе добавляется 0,1 ЕД/ч.
Оптимальная базальная скорость не дает уровню глюкозы крови подниматься или опускаться более чем на 1,7 ммоль/л в период сна или на протяжении 5 часов при голодании.
Не менее существенное значение при расчете помповых доз инсулина имеет правильный подбор болюсной дозы. Необходимую дозу болюсного инсулина определяет сам пользователь в зависимости от количества принимаемых углеводов. Чаще всего потребность в инсулине на 1 ХЕ (10 г углеводов) остается такой же, как и при методе многократных инъекций. Существует следующий расчет ориентировочной дозы болюсного инсулина на 1 ХЕ. В утренние часы (завтрак) на 1 ХЕ требуется 1,5–3,0 ЕД, днем (обед) – 0,5–1,5 ЕД, вечером (ужин) – 1,0–2,0 ЕД, на промежуточные приемы пищи в течение дня (перекусы) – 0,5–1,0 ЕД.
В настоящее время используются и другие схемы расчета дозы болюсного инсулина. От общей суточной помповой дозы на него может приходиться 50–70 %. При этом 40 % от расчетной дозы приходится на завтрак, 35 % – на обед и 25 % – на ужин. Учитываются ХЕ и осуществляется расчет потребности в инсулине на 1 ХЕ на каждый прием пищи.
В некоторых случаях учитывается суточное потребление ХЕ, которое равномерно распределяется на три приема пищи. Общая суточная болюсная доза делится на количество ХЕ за сутки, рассчитывается потребность в инсулине на 1 ХЕ.
При правильной дозировке болюса естественные колебания сахара в крови остаются приблизительно одинаковыми:
• через 1–2 часа после еды на 1,7–2,2 ммоль/л больше исходного значения;
• через 2–4 часа после еды на уровне исходных показателей.
Расчет болюсной дозы инсулина зависит от ряда факторов: показателя гликемии перед едой, количества планируемых к употреблению углеводов, чувствительности к инсулину, потребности в инсулине на 1 ХЕ, уровня действующего на данный момент инсулина. Неправильный учет всех
этих факторов приводит к введению неадекватной дозы инсулина и развитию гипо- или гипергликемии.
В отличие от инъекций инсулина шприцами или шприц-ручками при применении ИП существует уникальная возможность использовать различные варианты болюсного введения, например “растянутый” или “многопериодный” болюсы. “Стандартный” болюс вводится на прием пищи или при гипергликемии. “Пролонгированный” болюс вводится в заданный период времени – от 15 минут до 12 часов. “Многоволновой” болюс состоит из “стандартного” и “пролонгированного” болюсов. Он применяется при приеме пищи, богатой белком, жиром и при гастропарезе. “Многоволновой” болюс удобен при продолжительном приеме пищи – во время длительных обедов, встреч или при приеме пищи, которая медленно усваивается.
Использование разных типов болюса обеспечивает пациенту большую свободу в повседневной жизни и способствует снижению постпрандиальной гликемии.
При снижении или повышении гликемии необходимо проводить коррекцию дозы инсулина. Для этого необходимо рассчитать дозу с учетом фактора чувствительности, который показывает, насколько снижает гликемию 1 ЕД вводимого инсулина.
Таким образом, болюсное введение инсулина может осуществляться на прием пищи и при необходимости коррекции показателей гликемии. Преимущества помповой инсулинотерапии становятся очевидными при правильно подобранной дозе инсулина и желании пациента добиться хорошей компенсации диабета.
В настоящее время в помощь больным СД разработаны специальные компьютерные программы, оптимизирующие расчет дозы на прием пищи и постпрандиальную гликемию.
Клиническую эффективность помповой терапии оценивают по следующим критериям:
• динамика метаболических параметров (устранение феномена “утренней зари”, изменение суточной вариабельности глюкозы крови, уровня HbA1c, потребности в инсулине, частоты развития гипогликемий и кетоацидоза);
• влияние на массу тела;
• частота возникновения технических проблем с оборудованием;
• количество эпизодов инфицирования в местах постановки катетера;
• изменение качества жизни пациента.
Впервые метод ППИИ с помощью ИП у больных СД1 был описан Джоном Пикапом в 1978 г. [8]. Наблюдения последующих лет показали эффективность данного способа введения инсулина в плане достижения компенсации углеводного обмена и профилактики развития поздних осложнений СД. Совершенствование ИП повлекло за собой более активное их использование пациентами с СД1. В США и Германии ИП используют до 22 % подростков [6]. Наблюдение за когортой пациентов на помповой терапии (1567 детей и 128 подростков) в течение 5 лет продемонстрировало значительное снижение числа тяжелых гипогликемических состояний (на 20 %; р < 0,001), случаев феномена “утренней зари” (на 27 %), уменьшение частоты гипергликемических состояний (на 18 %; р <0,001). В то же время до 18 % пациентов, инициирующих введение инсулина с помощью ИП, в последующем переходят на многократные инъекции инсулина [14]. Среди отказавшихся от помпы пациентов большинство составили подростки, которые были в состоянии хронической декомпенсации диабета с очень высокими показателями гликемии, а также не имели мотивации на достижение компенсации заболевания. Эффективность помповой терапии оценили I. Rabbone и соавт. (2009), показавшие, что на фоне помповой терапии произошло достоверное снижение уровня HbA1c на 0,82 % (с 8,12 до 7,3 %; р < 0,05) с уменьшением потребности в инсулине без изменения массы тела. Потребность в базальном инсулине составила 50 % от общей суточной дозы. При этом развития случаев кетоацидоза отмечено не было. Зарегистрировано 10 эпизодов тяжелой гипогликемии на 100 пациенто-лет [9].
D. Bruttomesso и соавт. (2008) показали в группе пациентов с СД1 (n = 38; длительность заболевания – 16,6 ± 8,2 года; уровень НbА1с – 7,6 ± 0,8 %), что вариабельность уровня глюкозы в группе ППИИ была на 5–12 % ниже, чем в группе многократных инъекций инсулина (МИИ). С помощью постоянного мониторинга гликемии установлено, что при использовании ППИИ пациенты большее количество времени имеют нормальные и субнормальные показатели гликемии по сравнению с МИИ при равных значениях НbА1с [3].
B.W. Bode и соавт. оценивали эффективность ППИИ по динамике НbА1с и частоте развития тяжелых гипогликемий в перекрестном двугодичном исследовании у 225 пациентов с СД1. В группе ППИИ зарегистрировано 22 тяжелые гипогликемии на 100 пациенто-лет, в группе МИИ – 138, при этом достоверной динамики уровня НbА1с в обеих группах не наблюдалось. Однако в подгруппе пациентов с исходным уровнем НbА1с ≥ 8,0 % наблюдалось значительное снижение данного показателя – с 8,9 ± 0,8 до 8,1 ± 1,0 %, (р = 0,0004) [2].
Мета-анализ 21 исследования показал значительное снижение гликемии – с 9,79 ± 0,5 до 6,54 ± 0,2 ммоль/л (р < 0,001) при использовании ИП [13].
Изменение потребности в инсулине на фоне помповой инсулинотерапии оценивалось в 22 клинических исследованиях. В 10 публикациях учтена динамика изменения суточной дозы инсулина, а в 12 сообщениях регистрировалось изменение доза инсулина в расчете на килограмм массы тела. На фоне помповой терапии наблюдалось снижение как средней суточной дозы инсулина с 53,69 ± 0,1 до 44,19 ± 0,1 ЕД (р < 0,001), так и количества единиц инсулина на килограмм массы тела с 0,74 ± 0,04 до 0,62 ± 0,02 (р < 0,001) [13].
Изменение массы тела на фоне ППИИ оценивалось по результатам 10 исследований. Большинство авторов (7 публикаций) отметили увеличение массы тела в среднем с 68,24 ± 0,27 до 71,21 ± 0,31 кг (р < 0,001), однако ряд исследователей выявили снижение массы тела [13]. По данным метаанализа 29 исследований, показано отсутствие повышения риска развития гипогликемии на фоне помповой терапии. Причем в четырех исследованиях отмечено снижение числа гипогликемий средней степени тяжести, а в семи – тяжелых гипогликемий. В 4 исследованиях динамики по частоте средних выявлено не было, а в 10 – тяжелых эпизодов гипогликемии [13].
В одном из исследований при переводе на ППИИ отмечено снижение количества гипогликемий с 1,23 случая на одного пациента в год до 0,29 [5]. Большинство пациентов на фоне ППИИ отметили увеличение свободы в плане питания и физической нагрузки с уменьшением чувства психологической ограниченности [13].
В 2009 г. были опубликованы резуль-таты исследования RealTrend, показавшие значимость постоянного контроля гликемии при инициации помповой терапии. В исследовании участвовали 115 пациентов, переведенных c МИИ на ППИИ. Больные рандомизировались в две группы: с постоянным мониторингом гликемии (1-я группа) и со стандартной частотой контроля (2-я группа). В обеих группах наблюдалось достоверное снижение уровня НbA1c: в 1-й группе – на 0,81 ± 1,09 % (р < 0,001); во 2-й – на 0,57 ± 0,94 % (р < 0,001). При этом достоверных различий по уровню НbA1c между группами не наблюдалось. Из 1-й группы была выделена подгруппа пациентов, осуществлявшая контроль гликемии в течение более 70 % времени периода наблюдения. В этой подгруппе наблюдалось более существенное
снижение НbA1c – на 0,96 ± 0,93 % (р < 0,001) [11].
Сегодня в России зарегистрированы следующие инсулиновые дозаторы: Accu-Chek D-TRONplus, Accu-Chek Spirit (Рош, Германия), Medtronic Paradigm 722 (Медтроник, США) и Sooil Dana Diabecare II (SOOIL Development Сompany Ltd, Южная Кoрея).
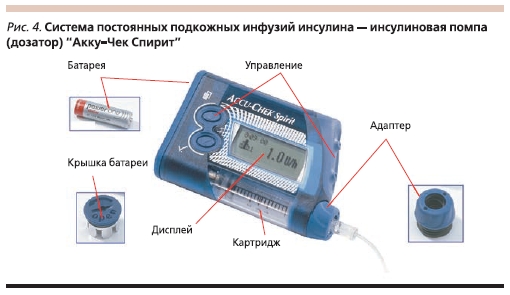
В данной статье мы хотели бы подробнее остановиться на ИП “Акку-Чек”, представляющих собой компактные электронные устройства, в герметичном корпусе которых располагается картридж с инсулином короткого/аналогом ультракороткого действия (рис. 4). Бесшумный мотор,управляемый двумя микропроцессорами, каждые три минуты двигает поршень внутри этого картриджа. В свою очередь инсулин через инфузионный комплект, состоящий из длинного гибкого катетера и канюли, находящейся под кожей, поступает в организм. Введение инсулина осуществляется в двух режимах: постоянная подача в малых дозах (базальный уровень с шагом введения 0,005 ЕД, т. е. в течение минуты введение инсулина осуществляется 20 раз) и болюсный режим при приеме пищи или при высоком уровне гликемии (скорость подачи болюсного инсулина – 1 ЕД за 5 секунд).
ИП “Акку-Чек” собирается вручную и на каждом этапе сборки многократно тестируется. В помпе есть функция поворота экрана на 180 градусов для удобства считывания информации. В ИП возможно программирование сразу 5 базальных уровней. Прибор может работать как от аккумулятора, так и от батареек. Дозатор совместим с глюкометрами “Акку-Чек”. Два микропроцессора контролируют работу друг друга. Этот двухпроцессорный комплекс совершает более 9 млн проверок в сутки и своевременно сообщает пользователю всю необходимую информацию. Высококачественный, полностью герметичный корпус защищает ИП от повреждений, попадания пыли и влаги. Помпы имеют блокировку кнопок, исключающую случайное нажатие, а также аудио/вибро поддержку сигналов предупреждения. Отключить вибросигнал невозможно. Если в резервуаре ИП остается от 0 до 20 ЕД инсулина, подается сигнал предупреждения “инсулин в картридже заканчивается”.
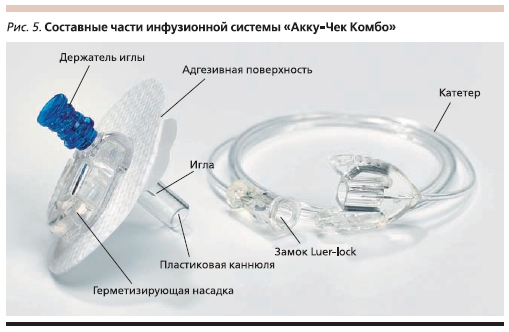
Установка дозатора на теле больного диабетом осуществляется в строго определенных местах. Маленькая канюля фиксируется клейкой лентой, а мягкая гибкая трубочка вводится под кожу с помощью иглы проводника (рис. 5). Инфузионную систему необходимо менять 1 раз в 3 дня.
В настоящее время для более успешного осуществления лечения СД применяют новые комбинированные системы, содержащие инсулиновую помпу и глюкометр, который одновременно выполняет функцию болюсного калькулятора. Необходимо выбрать вид пищи, уровень физической активности, и система даст рекомендации по дозе и типу болюсного инсулина, который требуется ввести с учетом уровня гликемии. Для такого расчета необходима всего 1 минута. Система способна рассчитывать дозы корректирующего болюса. В системе “Акку-Чек Комбо” (рис. 6) экран глюкометра полностью повторяет информацию дисплея помпы. Имеются звуковой, визуальный и вибрационный сигналы, предупреждающие пользователя о высокой или низкой гликемии, а также о необходимости смены инфузионного набора. В системе “Акку-Чек Комбо” заложена функция анализа суточной гликемии с указанием периода времени нахождения пациента в разном диапазоне сахаров. С помощью специального устройства всю информацию можно вывести на персональный компьютер. Такая система позволяет оперативно реагировать на все колебания гликемии, улучшать компенсацию углеводного обмена, повышать мотивацию пациентов, вести более активный образ жизни без боязни развития гипогликемии.
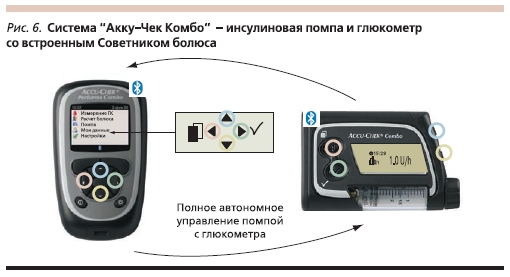
Создание системы “Акку-Чек Комбо” – путь к созданию искусственной поджелудочной железы. Она позволяет добиваться компенсации СД с использованием самых современных аналогов инсулина. Необходим постоянный контакт между пользователем ИП и высококвалифицированным врачом-эндокринологом, помогающим пациенту в решении сложных проблем, возникающих при применении новой системы.
Эффективность помповой терапии напрямую зависит от действий врача. Правильно запрограммированные режимы введения инсулина обеспечивают хорошую компенсацию заболевания, минимизируют риски гипо- и гипергликемии при любом уровне физической активности, обеспечивают высокое качество жизни больного СД1.


