Введение
S-аденозил-L-метионин (SAM) – эндогенное химическое соединение, встречающееся во всех живых организмах. Он синтезируется в клетках печени из метионина и аденозина с участием фермента S-аденозилметионинсинтазы (до 8 г/сут) и содержится во всех тканях организма человека. Благодаря своей уникальной структуре и физиологическим свойствам адеметионин служит субстратом многих биологических реакций, являясь донором метильных групп, активатором ферментов и предшественником таких значимых для организма соединений, как цистеин, таурин, глутатион и коэнзим А. По разнообразию реакций адеметионин уступает только АТФ, участвуя в трех важнейших метаболических путях – трансметилировании, транссульфурировании и аминополипропилировании [1].
Естественно, что такой физиологически активный эндогенный клеточный компонент вызывает не только научный, но и прикладной интерес, поскольку на его основе могут быть созданы фармакологически активные и безопасные для клетки лекарственные средства. Поскольку препараты, содержащие в качестве активного ингредиента адеметионин, уже показали свою эффективность в медицине (убедительным примером служит использование Гептрала®), цель данного обзора – заострить внимание на уникальных свойствах адеметионина, позволяющих ему модулировать метаболизм клетки, особенно в стрессовых условиях (окислительный стресс, развитие пролиферации и канцерогенез), а также взаимодействовать с биомаркерами, являющимися предикторами патологических изменений в организме, что в конечном итоге может способствовать разработке новых высокоэффективных лекарств.
Адеметионин отличается высокой химической активностью и в силу этого нестабильностью. Его активная роль в биологических реакциях обусловлена наличием положительного заряда на атоме серы (рис. 1), благодаря чему происходит разрыв серо-углеродных связей.
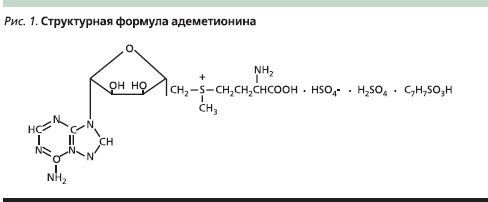
Проблему нестабильности адеметионина решили путем присоединения к активному веществу аниона бутандисульфоновой кислоты (SD4) и создания безопасного и эффективного лекарственного препарата Гептрал®, применяемого в гастроэнтерологии для лечения внутрипеченочного холестаза и в психиатрии для лечения различных видов депрессии. Химическое название Гептрала® – S-аденозил-L-метионин-1,4 бутан-дисульфонат. Для повышения стабильности препарата возможно использование и других соединений, например солей или эфиров паратолуолсульфокислоты, но бутандисульфонаты считаются более стабильными и внутривенные формы на их основе менее болезненны при введении. Форма Гептрала® для инъекций состоит из одного флакона с лиофилизированной солью адеметионина и одной ампулы растворителя. Состав буфера-растворителя делает среду смешанных компонентов перед инъекцией почти нейтральной (рН – 7,35–7,45). При интенсивной терапии в первые 2–3 недели лечения препарат назначают по 400–800 мг/сут внутривенно (очень медленно) или внутримышечно, порошок растворяют только в специальном прилагаемом растворителе (раствор L-лизина). Форма Гептрала® для перорального применения представляет собой белые таблетки в энтеросолюбильной оболочке, нерастворимой в кислой среде желудка.
С учетом его антидепрессивного и гепатопротекторного действия Гептрал может быть рекомендован в комплексной терапии абстинентного синдрома. Препарат нормализует выработку и поступление желчных кислот из клеток печени в желчевыводящие пути, улучшает моторику желудочно-кишечного тракта. Восстанавливая содержание эндогенного метаболически активного вещества адеметионина в клетках печени, препарат повышает защитные свойства клеток к различным повреждающим факторам (алкоголь, антибиотики, токсические вещества).
Роль адеметионина в метаболизме клетки
Распространенность SAM в клетках млекопитающих и человека связана с универсальностью его биологического действия. Клетки печени играют центральную роль в гомеостазе SAM, поскольку являются основным местом его синтеза и деградации.
Как следует из рис. 2, адеметионин играет ключевую роль практически во всех метаболических процессах организма. Он является донором метильных групп в чрезвычайно важных для клетки реакциях трансметилирования, необходимых для синтеза белков, гормонов, нейромедиаторов, нуклеиновых кислот и фосфалипидов. Метильная группа (CH3), присоединенная в составе S-аденозилметионина к атому серы, является химически активной. Поэтому метильная группа может быть перенесена на молекулу субстрата в реакции трансметилирования. Более сорока метаболических реакций требуют переноса метильной группы от SAM на такие субстраты, как нуклеиновые кислоты, белки и липиды. Синтез фосфатидилхолинов приводит к повышению подвижности клеточных мембран, увеличению их поляризации и оптимизации транспортных систем гепатоцитов.
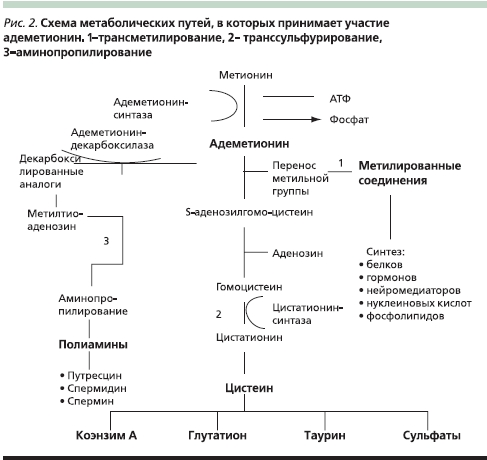
В результате реакции транссульфурирования происходит синтез глутатиона, необходимого для защиты клетки от свободных радикалов, детоксикации эндогенных и экзогенных веществ, а также таурина, необходимого для усиления конъюгации и сульфурирования желчных кислот, а в конечном итоге – их детоксикации.
После декарбоксилирования SAM участвует в процессах аминопропилирования как предшественник полиаминов – путресцина (стимулятор регенерации клеток и пролиферации гепатоцитов), спермидина и спермина, входящих в структуру рибосом. Полиамины являются эндогенными протекторами клетки, защищающими структуру ДНК от действия повреждающих агентов.
Адеметионин является компонентом многих ферментов, коэнзимов, витаминов и других физиологически активных веществ. Недавно выявлено, что он служит эффекторной молекулой рибопереключателей (элементов РНК, контролирующих экспрессию генов благодаря индуцируемому метаболитами изменению своей вторичной структуры). Связываясь с SAM, рибопереключатели образуют терминационную структуру, которая останавливает транскрипцию и ингибирует синтез мРНК. В отсутствие SAM образуется антитерминационная структура и транскрипция продолжается [2, 3]. Таким образом, SAM участвует в контроле регулируемых сетей экспрессии белков на уровне транскрипции, что чрезвычайно важно для нормального метаболизма клетки.
Кроме того, недавно открыто супер-семейство ферментов, действующих по новым химическим механизмам, в которых SAM служит предшественником окисляющих агентов, используемых в репарации ДНК и биосинтезе витаминов, коэнзимов и антибиотиков [4, 5].
Адеметионин и защита от окислительного стресса
S-аденозилметионин защищает клетки от ряда токсических агентов, способствующих развитию окислительного стресса.
Одним из механизмов защитного эффекта SAM может быть его участие в регуляции метаболизма метионина через синтез глутатиона, необходимого для обеспечения энергетического потенциала клетки. На рис. 3 представлена схема образования глутатиона через транссульфурирование гомоцистеина, образуемого из S-аденозилметионина с участием метионинаденозилтрансферазы (МАТ), метионинсинтаз, цитатион-β-синтаз и их кофакторов – витаминов В6 и В12, а также фолатов.
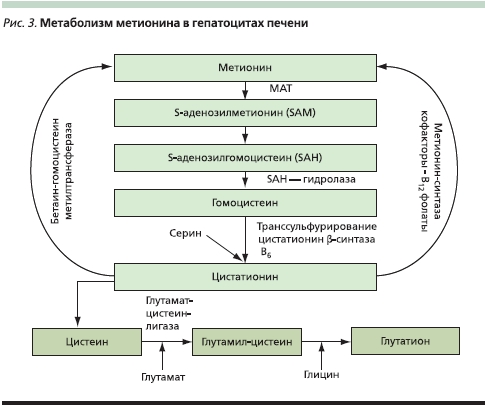
Известно, что высокие концентрации метионина токсичны для организма. S-аденозилметионин синтезируется из метионина и АТФ в реакции, катализируемой МАТ. В клетках идентифицировано большое число метилтрансфераз со сложным механизмом регуляции. Сложность метаболизма метионина в клетках печени увеличивает присутствие дополнительного фермента, глицин-N-метилтрансферазы, участвующего в образовании SАМ. Результаты моделирования регуляции метионина [6] привели к выводу о том, что путем переключения метаболизма метионина на его утилизацию печень и почки могут стабилизировать концентрацию этого вещества в крови при его избыточном поступлении. По-видимому, подобное переключение метионинового метаболизма может происходить не только при повышении концентрации метионина, но и при окислительном стрессе, для противодействия которому клетка увеличивает концентрацию глутатиона.
Глутатион, серосодержащий эндогенный пептид, является одним основных внутриклеточных компонентов системы защиты гепатоцитов от свободных радикалов, а также эндогенных и экзогенных токсических агентов. Синтез и метаболизм глутатиона зависят от транссульфурирования адеметионина через цистеин. Недостаток глутатиона в печени при ее заболеваниях приводит к инактивации адеметионинсинтезаты, что в свою очередь нарушает процесс транссульфурирования, т. е. процесс регулируется положительной обратной связью [7].
В условиях окислительного стресса повышенный выход свободных радикалов приводит к повреждениям тканей, создавая условия, предшествующие воспалению. Как окислительный стресс, так и воспаление способствуют развитию таких заболеваний, как болезнь Альцгеймера, атеросклероз и остеоартрит. В связи с этим многие пищевые добавки, разработанные в последние годы, предназначены для предотвращения заболеваний, вызванных данными факторами. В США SAM обычно применяется именно как пищевая добавка. При добавлении в пищу он оказывают цитозащитное и антиоксидантное действие, поскольку является интермедиатом метаболизма серосодержащих аминокислот и участвует в биосинтезе многочисленных биоактивных соединений, таких как гормоны и нейротрансмиттеры [8]. SAM ингибирует окисление этанола, аэробное окисление Fe2+ и поглощение О2 [9].
Исследование влияния SAM на экспрессию антиоксидантных стрессовых белков гемоксигеназы-1 и ферритина в клетках эндотелия показало, что индукция системы оксигеназы/ферритина ведет к защите тканей от воспалительных факторов. Адеметионин увеличивает уровни мРНК и оксигеназы в клетках эндотелия. Индукция экспрессии гена оксигеназы связана с повышением уровня ферритина и регулируется на транскрипционном уровне через повышение промоторной активности. Активация оксигеназы под влиянием SAM связана с уменьшением НАДФ-опосредованного выхода реактивных видов кислорода. Таким образом, система НО-1/ферритин может являться еще одной мишенью антиоксидантного действия адеметионина [10].
В клетках млекопитающих два гена (MAT1A и MAT2A) кодируют две гомологичные каталитические субъединицы МАТ, тогда как третий ген MAT2β кодирует β-субъединицу, регулирующую MAT2A-кодируемый изофермент. Печень в норме экспрессирует MAT1A, тогда как внепеченочные ткани экспрессируют MAT2A. В клетках гепатоклеточной карциномы (ГКК) индуцируются MAT2A и MAT2β, что облегчает рост раковых клеток. Пациенты с циррозом различного происхождения, включая алкогольный, имеют пониженные уровни активности МАТ печени и биогенезиса SAM. На модели нокаутных мутантов Mat1a мышей, характеризующихся повышенной чувствительностью к окислительному стрессу и спонтанным развитием ГКК, показано, что предрасположенность к ГКК может частично объясняться недостатком SAM. Адеметионин ингибирует митогенный эффект ростовых факторов, в частности ростового фактора гепатоцитов, и после частичной гепатэктомии падение уровня SAM необходимо для регенерации печени, но оно должно носить временный характер, поскольку постоянный недостаток SAM может привести к появлению пролиферирующего фенотипа и развитию ГКК. SAM контролирует не только рост клеток печени, но и апоптоз. Интересно, что в нормальных гепатоцитах SAM является антиапоптическим фактором, а в раковых клетках печени – проапоптическим. В пролиферирующих клетках SAM селективно индуцирует Bcl-xs, альтернативно сплайсируемую изоформу Bcl-xL, способствующую апоптозу. Результаты, полученные в последние годы, свидетельствуют, что SAM является не только донором метильных групп, но и ключевым регулятором роста гепатоцитов, их гибели и дифференциации [11]. Появляется все больше доказательств, что SAM модулирует рост как нормальных, так и пролиферирующих гепатоцитов, но механизм его действия в этих двух случаях различен. SAM может служить как антиапоптическим (в нормальных гепатоцитах), так и проапоптическим (в раковых клетках печени) агентом. Эти уникальные свойства SAM позволяют считать его потенциально привлекательным агентом для химиотерапии и лечения ГКК.
Влияние адеметионина на гомеостаз клетки
К настоящему времени продемонстрирована связь процессов метилирования с модулированием содержания эндогенных веществ, приводящих к психическим нарушениям; в частности, установлена связь дефицита фолатов, цикл которых сопряжен с метаболическими путями SAM, формированием клинической депрессии. Основным результатом этой взаимосвязи является синтез в фолатном цикле метильных групп, утилизируемых SAM как донор данных групп. Существует механизм гомеостаза (рис. 4), допускающий генерирование SAM при реметилировании гомоцистеина.
Другим актуальным аспектом изучения активности адеметионина может являться сопряженность его цикла с метаболизмом гомоцистеина (рис. 3). Гомоцистеин – природная серосодержащая аминокислота, не встречающаяся в белках, являющаяся продуктом метаболизма метионина и предиктором многих патологических изменений в организме человека (сердечно-сосудистых, психических заболеваний, нарушений внутриутробного развития) [12]. Два пути превращения гомоцистеина (реметилирование до метионина, требующее наличия фолата и В12, и превращение в цистатионин, требующее пиродоксаль-фосфата) координируются SAM, действующим как аллостерический ингибитор метилентетрагидрофолатредуктазы и как активатор цистатион-β-синтазы. С учетом роли адеметионина в цикле метилирования и сопряженности с метаболизмом гомоцистеина можно предположить, что SAM может влиять на общее содержание гомоцистеина в крови. Кроме того, SAM – потенциальный активатор фермента цистатионсинтетазы, способствующего удалению гомоцистеина. Влияние SAM на метаболизм гомоцистеина в настоящее время изучается, поскольку оценить последствия применения SAM при гипергомоцистенемии должны специализированные клинические исследования [13]. При наличии гипергомоцистенемии пероральное введение адеметионина может изменить течение заболевания, способствуя удалению избытка гомоцистеина. Некоторые авторы считают, что усиленное метилирование белков, вызванное добавлением SAM, ведет к образованию диметиларгинина – потенциального ингибитора синтетазы окиси азота, играющей важную роль в дисфункции эндотелия при гипергомоцистенемии [14]. Дальнейшее изучение регуляции адеметионином цикла гомоцистеина, по концентрации которого можно судить о формировании патологических изменений в организме, позволит прогнозировать эффективность терапии и оптимизировать ее режим [15].
Из анализа регуляторной роли адеметионина в метаболических процессах, происходящих в гепатоцитах печени и других клетках организма, можно сделать вывод, что он является крайне необходимым соединением для жизнеобеспечения. Отсюда вытекает высокий фармакологический потенциал адеметионина и препаратов, созданных на его основе. В случае если повреждение печени приводит к недостатку эндогенного адеметионина, введение экзогенного адеметионина помогает предотвратить накопление токсических метаболитов в гепатоцитах, поддержать проницаемость и текучесть клеточных мембран, что необходимо для активности ферментов, связанных с мембраной.
Гепатопротекторная роль адеметионина. Влияние на холестаз
При хронических заболеваниях печени различной этиологии (алкогольной, вирусной, медикаментозной, аутоиммунной и др.) часто развивается синдром холестаза, в основе которого лежит нарушение синтеза, секреции или оттока желчи. При гепатоцеллюлярном внутрипеченочном холестазе наблюдается повреждение гепатоцитов, при канальцевом – повреждение желчных канальцев. Внутрипеченочный холестаз затрагивает работу транспортных систем гепатоцитов, АТФ-зависимых Na+/K+-насосов и транспортных белков, что приводит к накоплению желчи в гепатоцитах и желчевыводящих путях, задержке в крови компонентов желчи (желчных кислот, липидов, билирубина). Гидрофобные желчные кислоты и билирубин блокируют дыхательный цикл в митохондриях гепатоцитов и окисление желчных кислот, что ведет к стимуляции перекисного окисления липидов и повреждению клетки. Накопление свободных радикалов и цитозольного кальция может привести к активации каспаз и запуску апоптоза клеток билиарного эпителия. Изменяются липидный состав, проницаемость и текучесть мембран клеток. Поступление желчи в кровь индуцирует кожный зуд, желтуху, ксантомы, потемнение мочи, возможное развитие системных поражений: острой почечной недостаточности, желудочных язв, эрозий и кровотечений, а также повышенный риск эндотоксемии и септических осложнений. Как следствие хронического холестаза может развиться билиарный цирроз печени с развитием асцита, отеков и печеночной энцефалопатии. Алкоголь как при остром, так и при хроническом введении увеличивает продукцию реактивных соединений кислорода, снижая уровень клеточных антиоксидантов во многих тканях, особенно в печени. Окислительный стресс, индуцированный этанолом, играет большую роль в механизмах продуцирования повреждений печени [16].
Следует отметить, что иногда холестаз (например, лекарственный) протекает бессимптомно и установить его наличие можно только путем биохимического исследования.
Сывороточные уровни ферментов (щелочной фосфатазы, γ-глумилтранспептидазы и лейцинаминопетидазы), желчных кислот, холестерина, билирубина являются критериями степени тяжести внутрипеченочного холестаза [17–19].
Снижение тяжести холестаза может достигаться устранением причины заболевания, воздействием на все звенья патогенеза путем восстановления механизмов транспорта желчи, а также инактивацией токсического действия гидрофобных желчных кислот. Адеметионин, играющий ключевую роль во всех метаболических процессах организма, обладает доказанным антихолестатическим действием, которое приводит к нормализации синтеза желчных кислот, детоксикации гидрофобных желчных кислот, восстановлению текучести и полярности клеточных мембран, а также нормализации работы мембранных транспортеров.
Благодаря активности адеметионина усиливается синтез фосфатидилхолинов, увеличивается поляризация и подвижность мембран, следовательно, улучшается функционирование транспортных систем гепатоцита, в частности АТФ-зависимого Na+/K+-насоса.
Усиление синтеза антиоксиданта глутатиона ведет к защите гепатоцитов от свободных радикалов и эндотоксичных веществ, а таурина – к усилению конъюгации, сульфурирования и детоксикации желчных кислот. Сульфаты желчных кислот защищают клеточные мембраны от токсического действия несульфурированных желчных кислот, накапливающихся при холестазе.
Перенос аминопропильных групп к путресцину, спермину и спермидину, входящих в состав рибосом, ведет к стимуляции пролиферации гепатоцитов и регенерации печени.
Установлено, что SAM, используемый при заболеваниях печени, а также при депрессии и остеоартрите, не обладает серьезными побочными эффектами. Лекарственное средство, содержащее в качестве активной субстанции адеметионин с присоединенным анионом бутандисульфоновой кислоты, получившее название “Гептрал®”, является препаратом выбора в большинстве случаев холестаза – при алкогольном, лекарственном и бактериальном поражениях печени, вирусных гепатитах, циррозах, эндотоксемии, сепсисе и т. д.
Результаты клинических испытаний свидетельствуют об успешном применении Гептрала® при поражениях печени различной этиологии: алкогольных заболеваниях (34 пациента; доза Гептрала® 800 мг/сут в течение 14 дней, результат – улучшение биохимических показателей, снятие депрессии); холестазе при хроническом гепатите С (23 пациента; результат – купирование проявлений холестаза и возможность проведения полноценной терапии интерфероном α2); хронических диффузных заболеваниях печени (32 пациента, в т. ч. 16 с первичным билиарным циррозом, доза Гептрала® – 800 мг/сут в течение 16 дней, далее по 1600 мг/сут в течение 16 дней; результат – устранение кожного зуда, желтухи, нормализация биохимических показателей).
Во всех клинических исследованиях отмечали удовлетворительную переносимость Гептрала® и отсутствие резистентности к его положительному действию при повторных курсах [20].
Следует особо отметить безопасность и высокую клиническую эффективность адеметионина в купировании симптомов внутрипеченочного холестаза у беременных без признаков отрицательного влияния на плод, показанную в массе рандомизированных клинических исследований [21–24]. Адеметионин не обладает эмбриофетотоксичностью, не оказывает какого-либо отрицательного воздействия на репродуктивную функцию, не вызывает каких-либо аномалий развития [25]. Он не только устраняет симптомы холестаза у матери и предотвращает возможные осложнения беременности, но и снижает частоту преждевременных родов у пациенток с холестазом, нейтрализует токсические эмбриопатические эффекты ксенобиотиков и поддерживает нормальное функционирование плаценты.
Антидепрессивный эффект адеметионина
Нарушения процессов SAM-зависимого метилирования могут вызывать метаболические и структурные изменения, имеющие серьезные функциональные последствия для ЦНС. Адеметионин, с одной стороны, напрямую участвует в синтезе катехоламинов (например, адреналина), с другой – влияет на метилирование мембранных фосфолипидов, регулирующих текучесть мембран и функционирование рецепторов. Важная антинейротоксическая роль адеметионина в ЦНС осуществляется через цистеин – предшественник двух антитоксических агентов: таурина и глутатиона.
Антидепрессивная эффективность адеметионина известна уже на протяжении двух десятилетий, при этом установлено, что его действие сильно отличается от такового известных антидепрессантных препаратов, таких как ингибиторы обратного захвата норадреналина и серотонина или ингибиторы монооксигеназы. Адеметионин относят к атипичным антидепрессантам, а его нейрофармакологическое действие принято связывать со стимуляцией образования нейромедиаторов.
Результаты нескольких рандомизированных клинических испытаний с участием 498 больных депрессиями разной степени тяжести показали достоверное (на 38–60 %) превышение антидепрессивной активности Гептрала® над активностью плацебо, при этом его эффективность была равноценна действию стандартных три- и гетероциклических антидепрессантов – имипрамина, дезипрамина, амитриптилина и других при практически полном отсутствии свойственных им побочных эффектов [26–27].
Данные, полученные при изучении психотропной активности Гептрала® при терапии затяжных и устойчивых к воздействию традиционных тимоаналептиков депрессивных расстройств, а также оценки его переносимости и безопасности, позволили авторам сделать вывод, что данный препарат можно использовать при терапии широкого круга непсихотических депрессий, в частности астенических [28]. Причем если при лечении депрессивных приступов и эпизодов рекуррентного депрессивного расстройства особых преимуществ Гептрала® перед традиционно используемыми антидепрессантами отмечено не было, то в отношении к соматизированной дистимии этот препарат проявил эффективность, позволяющую считать его средством, предпочтительным для использования в медицинской практике. Он обладает совокупностью свойств, оказывающих влияние и на депрессивный эффект и соматопсихические нарушения.
Применение адеметионина оказывает положительное регуляторное воздействие на баланс нейромедиаторов. Кроме того, эффективность адеметионина высока при лечении депрессивных расстройств и патологического влечения к алкоголю (при алкогольном абстинентном синдроме, сопровождающемся обычными для него соматовегетативными и психопатологическими расстройствами). При лечении Гептралом® (2 флакона парентерально – 800 мг в течение 2 недель, затем по 1 таблетке – 200 мг 4 раза в день в течение последующих 2 недель в сочетании с приемом витаминов и при необходимости антигипертензивных препаратов) терапевтический эффект отмечен на 2–4-й дни лечения. К концу недели выравнивалось настроение, восстанавливался сон, на 60–70 % снижалась депрессивная симптоматика, уменьшалось артериальное давление, и через 4 недели депрессивные расстройства полностью купировались. Влечение к алкоголю снижалось в среднем к 10-му дню. Препарат хорошо переносился, отсутствовали побочные явления и осложнения, не наблюдался феномен привыкания [20].
Другие фармакологические аспекты адеметионина
Избыточное употребление алкоголя при беременности является наиболее частой причиной аномалий развития человеческого плода (микроцефалии, умственной отсталости, неврологических нарушений и задержек развития). Адеметионин способен предотвращать токсическое действие ксенобиотиков в различных тканях. Показано, что его применение улучшало рост эмбрионов животных, уменьшая эмбриотическое действие этанола [29].
Еще одним аспектом применения адеметионина может служить его анальгетический эффект. Использование нестероидных противовоспалительных средств дает кратковременное облегчение боли, при этом велика возможность тяжелых побочных эффектов (например, желудочных кровотечений или потери хрящевой ткани). Назначение Гептрала® при остеоартритах уменьшает выраженность болевого синдрома при полном отсутствии побочных эффектов, повышает синтез протеогликанов и приводит к частичной регенерации хрящевой ткани.
Дополнительное поступление адеметионина в гепатоциты оказывает противовоспалительное действие путем изменения концентрации интерлейкинов: уменьшается содержание фактора некроза опухоли (ФНО) α и активизируется синтез интерлейкина-10 (ИЛ-10). Кроме того, изменяется соотношение SAM к SAH (S-аденозилгомоцистеину) [30].
Фармакокинетика адеметионина
Исследования на здоровых волонтерах показали 5 % биодоступность SAM после перорального приема, частично объясняемую показанным ранее на животных быстрым пресистемным метаболизмом адеметионина в печени [1]. После однократного введения таблеток, покрытых специальной оболочкой, растворяющейся только в кишечнике, благодаря чему всасывание происходило в двенадцатиперстной кишке, пик концентрации в плазме достигался через 3–5 часов и составлял 0,5–1,0 мкг/мл в зависимости от дозы. Для адеметионина характерно быстрое распределение в тканях. Он проникает через гематоэнцефалический барьер, накапливаясь в цереброспинальной жидкости. Спинномозговая жидкость циркулирует в полостях желудочков головного мозга, спинномозгового канала и субарахноидальном пространстве головного мозга и спинного мозга. Спинномозговая жидкость обеспечивает постоянство внутренней среды; посредством спинномозговой жидкости осуществляется тканевой обмен в центральной нервной системе.
Адеметионин, присутствуя в высокой концентрации в спинномозговой жидкости, оказывает антидепрессивный эффект, активно участвуя в метаболизме клеток нервной ткани.
Объем распределения после внутривенного введения в дозах 100 и 500 мг составлял соответственно 0,41 и 0,44 л/кг. Связывание с белками плазмы – 5 % и менее.
Экскреция осуществляется через почки (30–40 % дозы введенного вещества обнаруживается в моче через 24 часа) и желудочно-кишечный тракт (содержание в фекалиях через 72 часа – 23,5 %). Период полувыведения у здоровых людей – 1,5 часа, у группы пациентов с хроническим заболеванием печени – 2,0 часа.
Выводы
Анализ роли адеметионина в комплексе метаболических процессов свидетельствует о его важном значении для клетки как донора метильных групп, как предшественника антиоксидантов, участвующих в обезвреживании экзо- и эндотоксинов, как модулятора активности ферментов и как регулятора таких важнейших клеточных процессов, как транскрипция и экспрессия генов.
В приведенной итоговой схеме отражены пути воздействия адеметионина на энергетический потенциал клетки, апоптоз и воспалительные процессы, приводящие к положительному терапевтическому эффекту (рис. 5). Препараты, созданные на его основе и обладающие гепатопротектным, антидепрессивным, дезинтоксикационным, антиоксидантным и регенерирующим действиями, успешно применяются в медицине, особенно в гастроэнтерологии и психиатрии. К таким средствам, проявляющим одновременно тимоаналептический и соматотропный эффект, относится Гептрал®, хорошо зарекомендовавший себя при лечении внутрипеченочного холестаза различной этиологии, различных видов депрессии, а также в случаях сочетания депрессии с заболеваниями печени (например, хронический алкоголизм или гепатотоксические побочные эффекты трициклических антидепрессантов).
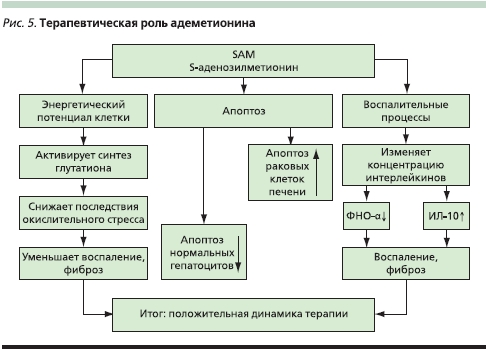
Фармакологический потенциал соединений адеметинина далеко не исчерпан, о чем свидетельствуют результаты последних исследований, демонстрирующие возможность модулирования апоптоза нормальных и пролиферирующих гепатоцитов, что делает его потенциальным агентом химиотерапии и лечения ГКК. Противовоспалительные и регенерирующие свойства адеметионина, возможно, найдут применение в реаниматологии и противоожоговых центрах.
Несомненно, что адеметионин перспективен и для разработки новых лекарственных препаратов с антиоксидантным и иммуномодулирующим действиями, влияющих на метаболизм клетки, что особенно важно в условиях ухудшающейся экологической обстановки. Поскольку к настоящему времени доказана связь почти всех заболеваний с нарушением экспрессии генов, потенциальная роль в фармакотерапии такого активного модулятора гомеостаза клетки, активности ее генов и ферментов очень велика. Очевидно, что в сочетании с разработанными биомаркерами применение адеметионина может внести значительный вклад в оптимизацию терапии.



