На протяжении 40 лет фторурацил (5-ФУ) был единственным препаратом, демонстрирующим эффективность в лечении метастатических гастроинтестинальных карцином. Объективный ответ в монотерапии составлял 12 %, а медиана общей выживаемости (ОВ) – 11 месяцев [2]. Применение комбинации 5-ФУ с лейковорином увеличивает уровень объективного ответа до 21 % против 11 % в группе без лейковорина (кальция фолината) [3].
Короткое время полужизни 5-ФУ привело исследователей к мысли об использовании пролонгированных инфузий препарата. Поскольку 5-ФУ действует только на клетки, находящиеся в S-фазе клеточного цикла, предполагали, что при его более длительном воздействии на опухоль большее число опухолевых клеток будет чувствительным к препарату. С другой стороны, длительные инфузии сопряжены с более низкими пиковыми концентрациями препарата в плазме крови и площадью под кривой концентрации, чем при болюсном введении. Это позволяет снижать токсичность лечения [1, 4].
Мета-анализ данных 6 рандомизированных исследований показал, что длительные инфузии 5-ФУ по сравнению с болюсным введением препарата ассоциировались с более высоким уровнем объективного ответа (22 против 14 %; р = 0,0002) и статистически значимым увеличением ОВ (12,1 и 11,3 месяца соответственно; р = 0,04) [5]. Кроме того, изменился и токсический профиль – снизилась частота развития миелотоксических реакций (4 против 31 %), но увеличивалась частота кожной токсичности (ладонно-подошвенный синдром (ЛПС) – 34 против 13 %).
Длительные инфузии 5-ФУ требуют постоянного венозного доступа в виде центрального венозного катетера или подкожно имплантированного порта. Кроме того, необходимо использование помп или инфузоматов. Все это приводит к существенному удорожанию лечения. Поэтому следующим этапом на пути оптимизации лечения 5-ФУ стало создание пероральных форм фторпиримидинов.
Интересно, что первое исследование по применению пероральной формы 5-ФУ провалилось [1]. Фармакокинетическое исследование продемонстрировало непредсказуемость абсорбции препарата в желудочно-кишечном тракте в связи с вариабельностью активности дигидропиримидин дегидрогиназы (ДПД) – фермента, расщепляющего 5-ФУ, в эпителии тонкой кишки [6]. Для преодоления проблемы используются следующие подходы: применение пролекарств (в таком случае образование активного метаболита происходит только после абсорбции препарата в кишке) либо использование препарата, содержащего 5-ФУ и вещества, снижающего активность ДПД. На сегодняшний день в мире используются четыре пероральных фторпиримидина: фторафур, УФТ (тегафур/урацил), препарат S-1 и капецитабин. Фторафур был некогда популярен в СССР, а UFT и S-1 применяются главным образом в азиатских странах и не зарегистрированы в России. Наибольшее распространение в мире получил капецитабин, что обусловлено широкой доказательной базой его эффективности, основанной на большом числе рандомизированных исследований.
К началу XXI в. в терапию гастроинтестинальных опухолей уже прочно вошли различные комбинации, основанные на струйных или инфузионных режимах применения 5-ФУ. Данный обзор посвящен анализу места капецитабина в лечении колоректального рака (КРР) и рака желудка (РЖ).
Капецитабин – 5-дезокси-5-фторN-[(пентилокси)карбонил]-цитидин (Кселода®; F. Hoffmann-La Roche, Швейцария). Капецитабин является пролекарственной формой 5-ФУ. В активный препарат капецитабин превращается в три этапа под действием ферментов (карбоксилэстераза и цитидиндеаминаза в печени, тимидинфосфорилаза (ТФ) в опухолевых клетках). Активность ТФ в опухоли в несколько раз выше, чем в нормальных тканях. Это и определяет в среднем трехкратное превышение концентрации 5-ФУ в опухоли по сравнению с другими тканями [1] и как следствие – большую эффективность и меньшую токсичность капецитабина по сравнению с внутривенным 5-ФУ.
По результатам I фазы клинических исследований для дальнейшего изучения было выбрано два режима применения капецитабина: постоянный прием в суточной дозе 1657 мг/м2 и интермиттирующая схема приема в суточной дозе 1331 мг/м2. В рандомизированном исследовании II фазы, выполненном Van Cutsem и соавт. проводилось сравнение режимов: постоянный прием капецитабина 1331 мг/м2 в сутки, группа пациентов, получавшая капецитабин в интермиттирующем режиме 2510 мг/м2 , кроме того, дополнительно была набрана третья группа пациентов, получавших капецитабин в дозе 1657 мг/м2 в сочетании с лейковорином. Объективный эффект составил 21 % при постоянном приеме, 24 % – при интермитирующем режиме и 23 % при схеме с лейковорином. Однако в группе пациентов, получавших лейковорин, чаще развивались такие побочные явления, как диарея и ЛПС [7, 8]. Интермитирующий режим приема был несколько токсичнее постоянного, но значимо увеличивал время до прогрессирования (ВДП). Поэтому схема приема капецитабина 1250 мг/м2 2 раза в сутки 1–14-й дни каждые 3 недели была принята как стандарт.
Колоректальный рак
Капецитабин и струйное введения 5-ФУ
Сравнение капецитабина с болюсным применением 5-ФУ с лейковорином было проведено в двух исследованиях III фазы [9, 10]. Хотя медиана ВДП и ОВ в группах не различались, объективный ответ был статистически значимо выше в группе больных, принимавших капецитабин (24,8 против 15,5 %; р = 0,005). При этом удалось значительно снизить выраженность побочных эффектов, особенно стоматита и нейтропении 3–4 степени. Реже при применении капецитабина было и число госпитализаций в связи с непереносимой токсичностью. Выросла лишь частота ЛПС.
Известны результаты применения капецитабина в адъювантной терапии у больных III стадей КРР. В исследовании X-ACT больные были рандомизированы в две группы: в первой группе проводилать терапия капецитабином 2500 мг/м2/сут 1–14-й дни, пациенты второй группы получали болюсно 5-ФУ с лейковорином (схема клиники Мейо) [16]. При медиане наблюдения 3,8 года показатели выживаемости без признаков болезни не различались (5-летняя выживаемость без признаков болезни составила: 63,2 и 60,8 % соответственно; р = 0,12). Однако отмечена тенденция к повышению общей выживаемости в группе капецитабина (5-летняя выживаемость 71,4 и 68,4 % соответственно; р = 0,06). На основании этих данных можно сделать вывод, что капецитабин не уступает по эффективности и лучше переносится, чем струйные режимы введения 5-ФУ.
Сравнение капецитабина и инфузионных режимов введения 5-ФУ
Лучшая переносимость длительных инфузий 5-ФУ при схожей эффективности по сравнению со струйными режимами стала в последние годы приводить к постепенному вытеснению последних из клинической практики. Прямого сравнения эффективности и токсичности капецитабина с инфузиями 5-ФУ не проводилось. Об этом можно лишь косвенно судить при сопоставлении и сравнении переносимости схем с использованием капецитабина или 5-ФУ и других химиотерапевтических препаратов (оксалиплатин и иринотекан).
Эквивалентность эффективности капецитабина и 5-ФУ при опухолях ЖКТ была оценена в пяти рандомизированных исследованиях III фазы.
В 2007 г. было опубликовано рандомизированное исследование по сравнению режимов FUFOX (инфузия 5-ФУ 2000 мг/м2 в/в 22 часа и оксалиплатин 50 мг/м2 в/в в 1-й, 8-й, 15-й и 22-й день, каждые 36 дней) и CAPOX (оксалиплатин 70 мг/м2 внутривенно 1-й, 8-й день каждые 22 дня и капецитабин 2000 мг/м2 внутрь в сутки 1–14-й дни) в 1-й линии терапии пациентов с метастатическим КРР. Рандомизировано 338 больных. Время до прогрессирования (7,1 против 8,0 месяцев; р = 0,117), общая выживаемость (16,8 против 18,8 месяца; р = 0,26) не различались и была отмечена тенденция к преимуществу инфузионной схемы [14].
В 2000 г. представлены были результаты сравнения эффективности схем с оксалиплатином в 1-й (NO16966) [17] и 2-й линиях (NO16967) [18] терапии пациентов с метастатическим КРР: XELOX (капецитабин + оксалиплатин) и FOLFOX (оксалиплатин + лейковорин + инфузии 5-ФУ). В первом исследовании дизайн был изменен на 2 : 2 в связи с дальнейшим добавлением бевацизумаба/плацебо к химиотерапии на основе оксалиплатина [19]. При этом дозу капецитабина уменьшили с 2000 до 1700 мг/м2/ сут. В первом исследовании лечение получили 147 пациентов, во втором – 213. В целом не было отмечено существенных различий в эффективности режимов с капецитабином и инфузиями 5-ФУ.
ОВ в исследовании TREE-1 составила 19,2, 17,9 и 17,2 месяца соответственно в группах с инфузией 5-ФУ, его болюсным введением и в группе капецитабина (различия статистически не значимы). При добавлении бевацизумаба ОВ составила – 26,1, 20,4 и 24,6 месяца соответственно.
Другим активным препаратом в лечении КРР является иринотекан, применяемый как в монотерапии, так и в комбинированных режимах с 5-ФУ. Еще несколько лет назад в США чаще использовался режим со струйным применением 5-ФУ (IFL), тогда как в Европе набирала популярность комбинация FOLFIRI (иринотекан + лейковарин + 5-ФУ). Настало время проведения прямого сравнения данных режимов, а также комбинации с капецитабином (CapeIRI). В 2007 г. на ASCO были представлены результаты американского рандомизированного исследования BICC-С, в котором применялись все указанные режимы [11]. Лечение в последней группе было досрочно прекращено по причине неприемлемой токсичности. Отметим, что применение режима CapeIRI было ассоциировано с более высокой частотой диареи. Медиана ВДП при сравнении FOLFIRI, IFL и CapeIRI составила 7,6, 5,9 и 5,8 месяца (р = 0,004), ОВ – 23,1, 18,9 и 17,6 месяцев соответственно (р = 0,09). Исследование подтвердило большую эффективность инфузионной схемы над болюсной. Более высокую токсичность режима CapeIRI, по-видимому, можно объяснить применением высоких доз препаратов (иринотекан 250 мг/м2 1 раз в 3 недели и капецитабин 2000 мг/м2 в сутки 1–14-й дни). Рандомизированное исследование II фазы по сравнению режимов FOLFIRI и XELIRI в тех же дозах показало одинаковую частоту диареи при применении обеих схем (3–4-я степени – 6 %) [28].
Результаты ключевых исследований III фазы по сравнению эффективности капецитабина и инфузий 5-ФУ в схемах с оксалиплатином и иринотеканом больным метастатическим КРР представлены в табл. 1
Таблица 1. Результаты исследований по сравнению эффективности капецитабина и инфузий 5-ФУ в сочетании соксалиплатином и иринотеканом у больных метастатическим КРР.
Токсичность и переносимость
В исследовании MO66001 (сравнение адъювантных режимов: капецитабин против болюсного введения лейковорина и 5-ФУ) развитие токсических реакций 3–4-й степени в процессе терапии капецитабином было достоверно более редким, чем в группе с 5-ФУ. Из табл. 2 следует, что для капецитабина характерно такое осложнение, как ЛПС. В то же время нейтропения, диарея, тошнота/рвота, стоматит и алопеция развивались значительно реже. Отметим, что при сравнении качества жизни в процессе терапии и после ее завершения различий между группами обнаружено не было [16].
Таблица 2. Сравнение токсичности в исследованиях химиотерапии на основе капецитабина и 5-ФУ у больных КРР, %.
По данным исследования NO16966, общая частота токсических реакций 3–4-й степеней была одинаковой в группах с капецитабином и 5-ФУ. Однако 4-я степень токсических реакций чаще наблюдалась в группе с FOLFOX (22 против 11 %). В первую очередь это различие было обусловлено нейтропенией 4-й степени. Частота нейтропении 3–4-й степеней в группе FOLFOX составила 44 против 7 % в группе с капецитабином, венозные тромбоэмболические события также были ассоциированы с режимом FOLFOX (6,3 против 3,8 %). Среди побочных явлений 3-й степени у пациентов, получавших XELOX, чаще, чем в группе FOLFOX, встречались диарея (19 против 11 %), ЛПС (6 против 1 %) [17].
В исследовании NO16967 (2-я линия терапии) побочные явления 3–4-й степени чаще наблюдались при режиме с инфузией 5-ФУ (65 против 50 %); эти различия, как и в исследовании NO16966, были обусловлены в основном нейтропенией. В отличие от применения капецитабина в адъювантном режиме и в составе схем 1-й линии у пациентов, получавших режим XELOX во 2-й линии, чаще наблюдались побочные явления 3–4-й степеней со стороны желудочно-кишечного тракта (33 против 20 %). Так, диарея 3–4-й степеней была отмечена у 19 % больных в сравнении с 5 % пациентов, получавших FOLFOX. Применение капецитабина не увеличивало частоту периферических сенсорных невропатий на фоне применения оксалиплатина ни в 1-й, ни во 2-й линиях химиотерапии (табл. 2) [18].
Рак желудка
В отличие от метастатического КРР, при котором эффективность химиотерапии была показана достаточно давно, среди многих специалистов до последнего времени оставался скептицизм по поводу необходимости проведения лекарственной терапии при метастатическом РЖ. В мета-анализе было продемонстрировано достоверное увеличение продолжительности жизни при назначении химиотерапии по сравнению с симптоматической терапией (отношение рисков [ОР] – 0,39; 95 % доверительный интервал [ДИ] – 0,28–0,52), а также преимущество комбинированной терапии перед монотерапией (ОР – 0,83; 95 % ДИ – 0,74–0,93) [29]. Основой терапии РЖ стали цисплатин и 5-ФУ. Их комбинация с применением 5-суточной инфузии 5-ФУ (режим PF) стала стандартом лечения в США и некоторых странах Западной Европы. В то же время в Великобритании использовалась другая комбинация: эпирубицина, цисплатина и непрерывной инфузии 5-ФУ (ECF), показавшая свое превосходство над некогда популярным бесплатиновым режимом FAMTX (медиана ОВ – 8,9 и 5,7 месяца соответственно; р = 0,0009) [30]. Успешный опыт применения капецитабина при КРР естественным образом подвел к необходимости проведения сравнительных исследований эффективности 5-ФУ и капецитабина при распространенном раке желудка.
Эффективность 5-ФУ и капецитабина
В крупном рандомизированном исследовании REAL-2, с включением 964 больных с метастатической аденокарценомой желудка и нижней трети пищевода кроме сравнения двух фторпиримидинов изучалась и возможность замены цисплатина на оксалиплатин [31]. В качестве основного режима был избран уже ставший стандартным ECF (эпирубицин, цисплатин, болюсно 5-ФУ), а в трех других экспериментальных группах последовательно заменялись цисплатин на оксалиплатин, а 5-ФУ – на капецитабин режимы EOX (эпирубицин, оксалиплатин, капецитабин), EOF (эпирубицин, оксалиплатин, болюсно 5-ФУ) и ECX (эпирубицин, цисплатин, капецитабин). Предполагалось, что данное исследование позволит продемонстрировать эффективность новых режимов терапии, не уступающую стандартному ECF по показателям выживаемости (noninferiority дизайн).
В группе EOX отмечена достоверно более высокая продолжительность жизни, тогда как в трех других группах результаты оказались схожими (табл. 3). Дальнейший анализ выявил увеличение выживаемости без прогрессии при режимах, в которых капецитабин использовался вместо 5-ФУ (ОР – 0,85; 95 % ДИ – 0,64–1,13), тогда как при сравнении цисплатина с оксалиплатином наблюдалась лишь тенденция к улучшению результатов в пользу последнего (ОР – 0,92; 95 % ДИ – 0,80–1,10).
Таблица 3. Результаты рандомизированных исследований по сравнению капецитабина с 5-ФУ при метастатическом РЖ.
В другом исследовании III фазы, ML17032 больные с распространеным раком желудка (316 пациентов) были рандомизированы в две группы, получавшие лечение по схемам FP и XР в качестве первой линии терапии [32]. Как и в предыдущем исследовании, основной задачей было продемонстрировать не меньшую эффективность режима с капецитабином, что и было сделано. Медиана выживаемости без прогрессии в группах FP и XP составили 5,0 и 5,6 месяца (ОР – 0,81; 95 % ДИ – 0,63–1,04; p > 0,001), а ОВ – 9,3 и 10,5 месяца (ОР – 0,85; 95 % ДИ – 0,64–1,13; p = 0,008) соответственно. Частота объективного ответа оказалась достоверно выше в группе капецитабина и составила 46 % в сравненн с 32 % в группе 5-ФУ.
Таким образом, в обоих исследованиях было четко показано, что режимы с капецитабином по эффективности не уступают комбинациям с 5-ФУ. При этом было отмечено преимущество режимов с капецитабином. Поскольку статистическая сила каждого из исследований не позволяла достоверно подтвердить это превосходство, было решено провести совместный анализ результатов двух этих работ [33]. С увеличением числа пациентов удалось зарегистрировать достоверное увеличение ОВ в режимах с капецитабином (10,7 месяца) по сравнению с группами, получавшими 5-ФУ (9,5 месяца; ОР – 0,87; 95 % ДИ – 0,77–0,98; p = 0,027). Эти различия остались достоверными и по результатам проведенного многофакторного анализа. Преимущества от добавления капецитабина не завило от возраста и общего состояния больных. Кроме того, для режимов с капецитабином отмечена тенденция к увеличению ВДП (6,6 против 6,0 мес; ОР – 0,91; 95 % ДИ – 0,81–1,02; р = 0,093) и достоверному повышению частоты объективного ответа (45,6 против 38,4 %; р = 0,006).
Токсичность и переносимость
В исследовании REAL-2 токсический профиль всех четырех комбинаций был схожим, и различия не носили принципиального характера. Однако нейтропения 3–4-й степени чаще встречалась в группе ECX (51 %) и достоверно реже – в EOF (30 %) и EOX (28 %). В то же время в двух последних группах чаще развивались диарея 3–4-й степеней (11–12 %), что, вероятнее всего, обусловлено использованием оксалиплатина вместо цисплатина. Частым осложнением терапии капецитабином является ЛПС, который в 10 % случаев был зафиксирован в группе ECX (3–4 степени), тогда как в остальных трех группах его частота не превышала 4 %.
В исследовании ML17032 токсичность обоих режимов была ниже, что, по-видимому, было обусловлено отсутствием эпирубицина. Замена инфузий 5-ФУ на капецитабин не привела к росту частоты и выраженности каких-либо осложнений, за исключением ЛПС (3-й степени – 4 %).
Фармакоэкономический анализ
С учетом схожих эффективности и токсичности капецитабина и инфузионного 5-ФУ большое значение приобретает такой параметр, как стоимость лечения. С одной стороны, сам капецитабин существенно дороже, чем 5-ФУ. С другой стороны, при использовании перорального приема препарата нет необходимости в частых посещениях клиники, применения центральных катетеров, венозных портов и инфузионных помп. Фармакоэкономический анализ, смоделированный по данным исследований REAL-2 и ML17032, учитывающий дополнительные затраты, возникающие при использовании 5-ФУ, показал, что в итоге терапия с капецитабином требует меньших денежных затрат. несмотря на более высокую стоимость препарата (табл. 4) [34].
Таблица 4. Сравнительная стоимость терапии различными режимами с включением цисплатина, капецитабина или 5-ФУ при метастатическом РЖ (фунты стерлингов) [34].
Мета-анализ данных рандомизированных исследований III фазы при РЖ и КРР
Следует отметить, что в ряде рассмотренных выше работ статистическая гипотеза не была рассчитана на то, чтобы доказать эквивалентность режимов в отношении показателей общей выживаемости. Принимая это во внимание, в 2011 г. были представлены результаты мета-анализа шести исследований, цель которого была доказать эквивалентность режимов с капецитабином режимам с 5-ФУ в плане достижения одинаковых показателей общей выживаемости [21]. В данный мета-анализ были включены данные по 6171 пациенту: с III стадией КРР – 1987 больных; 3868 больных с метастатическим КРР (исследование SO14695, SO14796, NO16966, NO16967), с распространенным РЖ – 316 пациентов (исследование ML17032). Из их числа 3097 больным проведена терапия на основе капецитабина, 3074 – на основе 5-ФУ с лейковорином. Анализ выполнялся для всей группы пациентов и отдельно в зависимости от локализации и распространенности опухолевого процесса. Результаты проведенного мета-анализа демонстрируют статически значимую эквивалентность схем на основе капецитабина режимам на основе 5-ФУ в отношении ОВ (ОР – 0,94, 95 % ДИ – 0,89–1,00; P = 0,0489). Учитывая факт, что 95 %, включенных в анализ имели рак толстой кишки, полученные данные в большей степени распространяются на данную нозологию (см. рисунок).
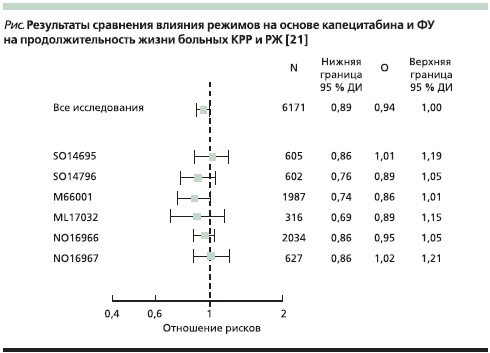
Помимо этого опубликованы данные двух мета-анализов, целью проведения которых являлось доказательство эквивалентности капецитабина и 5-ФУ преимущественно среди больных КРР. Cassidy и соавт. объединили данные 7 исследований II и III фаз (2826 пациентов), в которых проводилось сравнение режимов капецитабин +оксалиплатин и 5-ФУ/лейковорин + оксалиплатин для больных метастатическим КРР. Авторы показали, что ОР в отношении общей выживаемости составил 1,02 (95 % ДИ – 0,95–1,12) [24]. Второй мета-анализ был выполнен Arkenau и соавт.; в нем были получены аналогичные результаты по данных 6 рандомизированных исследований (3494 больных): ОР – 1,04 (95% ДИ – 0,95–1,12) [25].
Заключение
Основываясь на анализе результатов многочисленных рандомизированных исследований, можно утверждать, что для больных КРР режимы с капецитабином равноэффективны таковым на основе инфузионного ФУ по показателям общей выживаемости. В то же время при метастатическом РЖ капецитабин, вероятнее всего, является даже более эффективной альтернативой ФУ.
Однако при схожей эффективности эти фторпиримидины все же имеют определенные различия. Капецитабин необходимо с осторожностью применять при нарушении функции почек, а отдельных больных с выраженной диареей или ЛПС приходится переводить на режимы с инфузиями 5-ФУ.
Все это нисколько не умаляет значение капецитабина, а лишь дает возможность врачу и пациенту выбрать оптимальный режим терапии.
Информация об авторах:
Федянин Михаил Юрьевич – кандидат медицинских наук, врач-онколог отделения клинической
фармакологии и химиотерапии РОНЦ им. Н.Н. Блохина.
E-mail: fedianinmu@mail.ru;
Трякин Алексей Александрович – кандидат медицинских наук, старший научный сотрудник
отделения клинической фармакологии и химиотерапии РОНЦ им. Н.Н. Блохина



