S-1 (Taiho Pharmaceutical Co, Ltd, Tokyo, Japan) представляет собой пероральный лекарственный препарат, в котором соединены тегафур и два модулятора метаболизма 5-фторурацила (5-ФУ), а именно препараты гимерацил и отерацил (оксонат калия). S-1 предназначен для пероральной доставки 5-ФУ, одновременного снижения скорости его распада и трансформации в желудочно-кишечном тракте в токсический фосфорилированный метаболит. Комбинация препаратов тегафур, гимерацил и отерацил была установлена в молярном соотношении 1 : 0,4 : 1, обеспечивающем экспозицию действующего вещества 5-ФУ, получение оптимальной противоопухолевой активности и снижение токсичности по сравнению с применением собственно 5-ФУ.
Тегафур, хорошо известный как фторафур, является пролекарством 5-ФУ. Гимерацил задерживает катаболизм 5-ФУ путем обратимого подавления активности фермента дигидропиримидиндегидрогеназа (DPD). Гимерацил способствует поддержанию эффективной концентрации 5-ФУ в опухоли, что обеспечивает такой же терапевтический эффект, как и при продолжительном капельном вливании 5-ФУ. Отерацил блокирует фосфорилирование 5-ФУ, снижая его токсический эффект на слизистую оболочку желудочно-кишечного тракта.
Начиная с 1992 г. в различных странах в программу клинических исследований S-1 были включены около 10 тыс. пациентов, которые получали лечение S-1 как в монотерапии, так и в комбинации с цисплатином или другими противоопухолевыми средствами при различных локализациях новообразований.
S-1 одобрен в Японии и других азиатских странах под торговым названием TS-1 для лечения больных раком желудка (РЖ), головы и шеи, толстой и прямой кишки, немелкоклеточным раком легкого, раком молочной железы, поджелудочной железы и желчевыводящих путей. В Европе S-1 зарегистрирован в марте 2011 г. под торговым названием teysuno® для лечения метастатического РЖ (мРЖ) в комбинации с цисплатином по результатам исследования III фазы FLAGS, проведенного в странах Восточной и Западной Европы.
Эффективность и токсичность S-1 в монотерапии и в комбинации с другими препаратами при РЖ изучались как в азиатской, так и в европейской популяции. Следует отметить, что по результатам исследований зафиксированы отличия, касающиеся токсичности препарата в отношении пациентов в различных географических регионах, причины которых полностью не установлены. Показано, что максимальная переносимая доза S-1 в европейской популяции ниже, чем в азиатской, в связи с чем для снижения токсичности в первой группе применялся менее интенсивный режим.
Режим дозирования, принятый в азиатских странах: S-1, в монотерапии используется в режиме 40–60 м в зависимости от площади поверхности тела (ППТ; ≤ 1,25 м2 – 40 мг; 1,25–1,5 м2 – 50 мг; > 1,5 м2 – 60 мг) 2 раза в день после завтрака и ужина в течение 28 дней каждые 6 недель. В комбинации с цисплатином применяется в следующем режиме: S-1 40–60 мг (в зависимости от ППТ) также 2 раза в день в течение 21 дня и цисплатин 60 мг/м2 в 8-й день с последующим восстановительным периодом продолжительностью 14 дней.
Режим дозирования, принятый в США и Европе: S-1 25 мг/м2 каждые 12 часов в дни 1–21 в комбинации с цисплатином, который вводится в 1-й день цикла в дозе 75 мг/м2 с повторением курса каждые 4 недели.
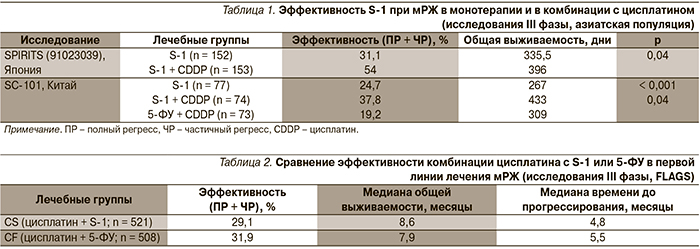
Эффективность этих комбинаций для больных мРЖ, не получавших ранее химиотерапии, сравнивалась в нескольких крупных исследованиях III фазы, результаты которых представлены в табл. 1.
Таким образом, как в японском исследовании SPIRITS (1), так и в китайском исследовании SC-101 (2) показано, что комбинированная терапия S-1 + CDDP является эффективной схемой лечения мРЖ и может рассматриваться в качестве стандартной схемы терапии для пациентов этой категории.
В обоих исследованиях оценивалась безопасность препарата. В исследовании SPIRITS в обеих лечебных группах были отмечены следующие побочные эффекты 3–4-й степеней: лейкопения, нейтропения, анемия, тошнота и анорексия. Частота возникновения этих нежелательных клинических явлений была выше в лечебной группе S-1 + CDDP, что соответствует ранее полученным данным.
В исследовании SC-101 с частотой ≥ 5 % наблюдались следующие побочные явления 3–4 степеней: в группе монотерапии S-1 – анемия (6,3 %) и лимфопения (8,8 %); в группе S-1 + CDDP – анемия (10,5 %), лимфопения (5,3 %), нейтропения (17,1 %), тромбоцитопения (6,6 %), лейкопения (13,2 %), диарея (6,6 %) и рвота (6,6 %); в группе 5-ФУ + CDDP – анемия (5,4 %), лимфопения (6,8 %), нейтропения (16,2 %), тромбоцитопения (12,2 %), лейкопения (9,5 %), тошнота (5,4 %) и рвота (12,2 %).
Эффективность S-1 для больных РЖ изучалась и в адъювантном режиме. Так, в исследовании III фазы № 91023038 (ACTS-GC; n = 1059) [3] проведено сравнение монотерапии этим препаратом (лечебная группа) с одним лишь оперативным вмешательством (контрольная группа) в отношении пациентов, страдающих РЖ II- (исключая T1), IIIA- или IIIB-стадий, после радикальной гастрэктомии с лимфодиссекцией в объеме D2. Пациенты, включенные в лечебную группу, получали S-1 в дозе 40–60 мг в зависимости от ППТ дважды в день в течение 28 дней с повторением цикла каждые 6 недель в течение первого года после операции.
Запланированный промежуточный анализ показал значительно более высокую общую выживаемость в лечебной группе S-1 (n = 529), чем в контрольной (n = 530; см).
При первом промежуточном анализе были получены убедительные данные об эффективности S-1 в адъювантном режиме, в связи с чем набор в контрольную группу был завершен. Согласно анализу, проведенному через 3 года после операции, общая выживаемость составила 80,5 % в лечебной группе и 70,1 % в контрольной (р = 0,002), а трехлетняя безрецидивная выживаемость – 72,2 и 60,1 % соответственно (р < 0,0001).
Основываясь на результатах исследования II фазы № S1101 (США и Германия), сравнительная оценка эффективности и безопасности S-1 проведена в многоцентровом международном исследовании III фазы FLAGS (First-Line Advanced Gastric Cancer Study; № S1301): лечебные схемы S-1 + цисплатин (CS) и 5-ФУ + цисплатин (CF) у пациентов, страдающих мРЖ [4-6]. Больные, включенные в исследование, были стратифицированы по следующим критериям: местнораспространенный процесс или наличие отдаленных метастазов, количество зон метастазирования, предыдущая адъювантная химиотерапия, наличие измеряемых проявлений болезни. Результаты исследования представлены в табл. 2.
При оценке безопасности следующие побочные явления, связанные с лечением, имели частоту возникновения как минимум на 5 % ниже в группе CS по сравнению с группой CF: нейтропения (28,0 и 46,5 %), лейкопения (17,1 и 22,6 %), фебрильная нейтропения (1,7 и 6,9 %), тошнота (56,0 и 63,0 %), рвота (40,3 и 50,4 %), диарея (22,8 и 32,3 %), стоматит (6,1 и 29,3 %), гипокалиемия (4,0 и 10,2 %) и алопеция (6,0 и 19,7 %).
Частота возникновения нежелательных явлений 3-й степени в группе CS (53,2 %) была ниже, чем в группе CF (75,0 %). Различие ≥ 5 % в пользу группы CS отмечено для следующих осложнений 3-й степени: нейтропения (18,4 против 39,2 %), лейкопения (7,1 против 13,4 %), фебрильная нейтропения (1,7 против 6,9 %), стоматит (1,3 против 13,2 %) и воспаление слизистых оболочек (0,8 против 7,7 %).
Таким образом, показано, что режим CS не является статистически более эффективным, чем режим CF, хотя в группе CS была значительно ниже частота нежелательных явлений, что указывает на оптимальное соотношение «польза–риск» для этого режима при мРЖ.
По результатам анализа эффективности и безопасности в исследовании № S1301 (FLAGS) в настоящее время проводится исследование III фазы, в котором сравниваются эффективность и безопасность схем лечения CS и CF для пациентов, страдающих мРЖ диффузного типа, потеря массы тела которых до начала лечения составляла < 10 %.
Большой интерес представляет изучение эффективности комбинаций S-1 не только с производными платины, но и с препаратами других групп (например, доцетакселом и иринотеканом).
В 2014 г. представлены результаты крупного исследования III фазы START (n = 635) [7], в котором сравнивалась эффективность S-1 в монотерапии и в комбинации с доцетакселом.
В группах монотерапии S-1 (n = 321; S-1 80–120 мг в день в зависимости от ППТ в 2 приема, дни 1–28 каждые 42 дня) и комбинированной терапии (n = 314; доцетаксел 40 мг/м2 внутривенно, день 1; S-1 80–120 мг в день в зависимости от ППТ в 2 приема, дни 1–14 каждые 3 недели) медиана общей выживаемости составила 10,8 и 12,5 месяцев соответственно (р = 0,032), а медиана времени до прогрессирования – 4,2 и 5,3 (p = 0,001).
При добавлении к S-1 иринотекана (n = 164) по сравнению с группой монотерапии S-1 (n = 162) в исследовании III фазы TOP-002 trial [8] при мРЖ не получено статистически значимого увеличения эффективности: медиана общей выживаемости составила 12,8 и 10,5 месяцев (р = 0,233), а частота полных и частичных регрессов – 41,5 и 26,9 % соответственно (р = 0,04).
Интерес представляет изучение не только двойных, но и тройных комбинаций с S-1. На сегодняшний день в различных исследованиях III фазы больных РЖ изучается эффективность следующих режимов: доцетаксел + S-1 + оксалиплатин (исследование DOS), эпирубицин + S-1 + оксалиплатин (исследование EOS), цетуксимаб + цисплатин + S-1, трастузумаб + цисплатин + S-1. Эффективность вышеуказанных режимов изучается и в неоадъювантной, и в адъювантной целях (например, S-1 + оксалиплатин).
Таким образом, S-1 продемонстрировал высокую эффективность в отсутствие значимой токсичности для такой тяжелой категории больных, как пациенты с диссеминированным РЖ. Использование S-1 в комбинации с цисплатином позволяет значительно увеличить общую выживаемость. При использовании S-1 в монотерапии с адъювантной целью получено значительное увеличение трехлетней безрецидивной выживаемости больных РЖ (72,2 и 60,1 % соответственно; р < 0,0001). По результатам проведенных исследований, требуется дополнительное изучение S-1 в тройных комбинациях или в комбинации с таргетными препаратами.
Клинический случай 1.
Больной П. 1949 г. р.
Клинический диагноз: Рак желудка рT4рN2M0, состояние после гастрэктомии с лимфодиссекцией D2 от 02.06.05. Метастазы в печень и забрюшинные лимфатические узлы.
Гистологическое заключение (гастрэктомия): умеренно-дифферен-цированная аденокарцинома.
В июне 2005 г. по поводу РЖ T4N2M0 выполнена гастрэктомия с лимфодиссекцией D2.
Август 2005 г. — прогрессирование заболевания: множественные метастазы в забрюшинные лимфатические узлы (безрецидивный период – 2 месяца). Компьютерная томография (КТ) органов грудной клетки и брюшной полости с внутривенным контрастированием от 11.08.05. – по ходу магистральных сосудов определяются множественные, сливающиеся в конгломераты узлы: парааортальный слева 3,5 × 3,0 см, в чревной области слева 2,0 см, между нижней полой веной и аортой 1,8 × 1,5 см.
С сентября 2005 по октябрь 2007 г. проведено 23 цикла химиотерапии: с сентября 2005 по март 2006 г. выполнено 6 циклов в режиме: S-1 25 мг/м2 – 45 мг 2 раза в день в течение 21 дня (с 3-го курса по 40 мг из-за снижения массы тела), цисплатин 75 мг/м2 – 132 мг, день 1, с повторением курса каждые 28 дней. С марта 2006 по октябрь 2007 г. проведено 7–23 цикла в режиме: S-1 25 мг/м2 – 40 мг 2 раза в сутки ежедневно длительно.
Максимальный эффект лечения при оценке каждые 8 недель по критериям RECIST – частичный регресс, достигнутый после 2 курсов: КТ органов грудной клетки и брюшной полости с внутривенным контрастированием от 14.11.2005 – по ходу магистральных сосудов определяются множественные, сливающиеся в конгломераты узлы: парааортальный слева 1,6 × 0,7 см, в чревной области слева 0,6 × 0,4 см, между нижней полой веной и аортой 0,5 × 0,3 см. Достигнутый эффект сохранялся в течение всего периода лечения.
Октябрь 2007 г. — прогрессирование заболевания: появление опухолевого конгломерата в области чревного ствола и множественных метастазов в печени.
Таким образом, длительность химиотерапии первой линии с включением S-1 составила 26 месяцев.
С октября 2007 по январь 2008 г. проведено 4 курса химиотерапии в режиме XELOX: оксалиплатин 130 мг/м2 в 1-й день, капецитабин 2000 мг/м2 2 раза в сутки, дни 1–14, каждые 3 недели.
При контрольном обследовании (февраль 2008 г.) прогрессирование заболевания. Далее лечения не получал.
Пациент умер 02.04.2008. от прогрессирования основного заболевания. Общая длительность заболевания составила 34 месяца.
Клинический случай 2.
Больной С. 1937 г. р.
Клинический диагноз: Рак желудка TХNХM1, IV стадия, метастазы в печени и забрюшинных лимфатических узлах.
Гистологическое заключение (ЭГДС): низкодифференцированная аденокарцинома.
С октября 2006 г. по настоящее время по поводу РЖ TХNХM1 с метастазами в печени и забрюшинных лимфатических узлах проведено 84 цикла химиотерапии: с октября 2006 по апрель 2007 г. выполнено 6 циклов в режиме: S-1 25 мг/м2 – 50 мг 2 раза в день в течение 21 дня, цисплатин 75 мг/м2 – 144 мг, день 1, с повторением курса каждые 28 дней. С апреля 2007 г. по настоящее время проведено 7–84 цикла в режиме: S-1 20 мг/м2 – 50 мг 2 раза в сутки ежедневно длительно.
При обследовании до начала лечения: КТ органов грудной клетки и брюшной полости с внутривенным контрастированием (сентябрь 2006 г.) – печень увеличена, в паренхиме определяются метастазы до 3,9 см в диаметре, в брюшной полости и забрюшинном пространстве определяются увеличенные лимфатические узлы до 5,8 см в диаметре. Максимальный эффект лечения при оценке каждые 8 недель по критериям RECIST – частичный регресс опухоли.
При КТ органов грудной клетки и брюшной полости с внутривенным контрастированием: печень увеличена, в паренхиме определяются метастазы до 0,3 см в диаметре, в брюшной полости и забрюшинном пространстве определяются увеличенные лимфатические узлы до 1,0 см в диаметре. Достигнутый эффект сохранялся в течение всего периода лечения.
Таким образом, длительность химиотерапии первой линии с включением S-1 составила 91 месяц.



