Полинейропатия (ПНП) – одно из самых часто встречающихся осложнений сахарного диабета (СД). Так, среди пациентов с СД типа 1 (СД1), находящихся на лечении в стационаре, распространенность диабетической ПНП (ДПНП) составляет 13–23 %, а среди пациентов с СД типа 2 (СД2), также находящихся на лечении в стационаре, – 19–50 %. Если же рассматривать популяцию пациентов с СД в целом, то среди больных СД1 ДПНП отмечается в 8–54 % случаев, а среди больных СД2 – в 13–46 %. Столь высокий разброс показателей распространенности ДПНП зависит прежде всего от чувствительности методов выявления полинейропатического синдрома.
Было показано, что при рутинном клиническом осмотре ДПНП можно выявить у 13 % пациентов с СД, однако использование скрининговых клинических методов (ТИП-ТЕРМ, Нейротипс) позволяет обнаружить ДПНП у 19 % больных той же популяции. Таким образом, раннее выявление ДПНП является одной из основных задач практикующего врача, занимающегося ведением пациентов с СД. В одном из исследований было показано, что даже среди лиц со снижением толерантности к глюкозе без развернутой картины СД распространенность ПНП достоверно выше (44 %) по сравнению с общей популяцией (4 %). Риск развития ДПНП возрастает в зависимости от продолжительности СД. Так, в исследовании Pirart J. [7] изучалась популяция пациентов с ДПНП в дебюте заболевания, тех же пациентов повторно осматривали через 25 лет. Было показано, что в начале заболевания ДПНП отмечена у 8 % пациентов, тогда как через 25 лет – уже у 50 %.
Заболеваемость ПНП среди пациентов с СД составляет 6,1 на 100 человек за 5 лет [10]. И несмотря на то что сама ДПНП в целом характеризуется относительно стабильным течением (за 2 года наблюдения у 81 % больных существенной динамики не происходит, у 10 % отмечается ухудшение, у 9 % – улучшение [5]), основную угрозу для пациента представляют развитие синдрома диабетической стопы (СДС) и ампутация конечности, основным фактором риска которых и является ДПНП.
Кроме этого у пациентов с СД часто развивается и другая форма нейропатии – вегетативная, тоже требующая ранней диагностики и лечения. В частности, кардиоваскулярная диабетическая нейропатия является независимым фактором риска развития инсульта в последующие 10 лет, а также причиной развития безболевых инфарктов миокарда. СД2 менее благоприятен в отношении развития вегетативной нейропатии. Так, если при СД1 достоверная вегетативная нейропатия выявляется у 8,5 %, а вероятная – у 16,8 % больных, то при СД2 достоверная вегетативная нейропатия имеет место у 12,2 %, а вероятная – у 22,1 % пациентов.
Другой частой формой вегетативной нейропатии у пациентов с СД является эректильная дисфункция (ЭД). Особенно это касается пациентов молодого возраста: так, распространенность ЭД среди пациентов с СД в возрасте 25 лет составляет 20 %, в возрасте 40 лет – 42 % [6]. Факторами риска развития ЭД являются: длительность течения СД, плохой контроль сахара крови, наличие иных осложнений СД, курение. Другие формы диабетической нейропатии встречаются реже.
Классификация диабетической нейропатии (Dyck P.J.):
1. Гипергликемическая нейропатия.
2. Генерализованная:
- хроническая дистальная сенсомоторная ПНП;
- острая болевая сенсорная нейропатия;
- вегетативная нейропатия;
- острая двигательная нейропатия.
3. Фокальная и мультифокальная:
- краниальная нейропатия;
- тораколюмбальная радикулонейропатия;
- проксимальная диабетическая нейропатия.
4. Фокальная нейропатия в конечностях (в т. ч. Компрессионно-ишемическая).
5. Сочетанная хроническая воспалительная демиелинизирующая нейропатия.
6. Гипогликемическая нейропатия.
Клиническая диагностика диабетической нейропатии
Хроническая дистальная сенсомоторная ПНП – самая частая форма диабетической нейропатии, характеризующаяся постепенным началом и прогрессирующим течением. Как правило, пациенты предъявляют жалобы на умеренную жгучую боль, онемение, парестезии в стопах, кистях. Чувствительные нарушения являются причиной микротравм стоп, а в дальнейшем – развития СДС. Объективно выявляется снижение чувствительности по типу перчаток и носок, выпадение ахиллова рефлекса, может развиться мышечная слабость в дистальных отделах. Часто отмечаются другие осложнения СД – диабетическая нефропатия, диабетическая ретинопатия.
Критерии дистальной ДПНП [5]:
- наличие СД;
- длительная хроническая гипергликемия;
- дистальная симметричная, преимущественно сенсорная, ПНП, более выраженная в ногах;
- отсутствие других причин ПНП.
Ранняя диагностика диабетической нейропатии на этапе первичного звена медицинской помощи чрезвычайно важна, т. к. своевременно начатое патогенетическое лечение позволяет избежать развития СДС. Выделяют три стадии диабетической нейропатии (см. таблицу).
Таблица.Диагностические критерии диабетической нейропатии.
Ранними клиническими маркерами ДПНП являются:
- онемение, парестезии, боли в дистальных отделах ног;
- двустороннее снижение или выпадение ахилловых рефлексов;
- снижение болевой, температурной, тактильной чувствительности в стопах и кистях (по типу носков и перчаток);
- снижение вибрационной чувствительности на ногах;
- слабость мышц стопы, особенно разгибателей пальцев;
- признаки вегетативной недостаточности;
- трофические язвы на стопах.
Патогенез диабетической нейропатии
В развитии ДПНП обсуждается несколько ключевых механизмов: нарушение эндоневрального метаболизма, ухудшение трофики нервных волокон и снижение кровотока по vasa neurorum, что приводит к развитию оксидантного стресса, являющегося результатом дисбаланса между свободными радикалами (супероксиданионом, пероксинитритом и т. д.) и антиоксидантной системой (супероксиддисмутазой, каталазой, глутатионом, витаминами С и Е). При СД имеет место как повышение образования свободных радикалов, так и дефицит компонентов антиоксидантной системы, что в конечном итоге приводит к повреждению нервной ткани.
Развитие оксидантного стресса при гипергликемии происходит по нескольким путям (рис. 1):
- Самоокисление глюкозы.
- Неферментное гликозилирование белков и накопление в клетках токсичных конечных продуктов гликозилирования, приводящих к необратимому повреждению как периферических нервов, так и стенок сосудов. Кроме того, происходит гликозилирование ферментов антиоксидантной системы, что приводит к значительному снижению ее активности.
- Активация полиольного пути окисления. Повышение образования фруктозы, являющейся продуктом полиольного процесса окисления, приводит к накоплению предшественников конечных продуктов гликозилирования. Кроме этого активация полиольного пути приводит к накоплению в ткани периферических нервов сорбитола и истощению эндоневрального миоинозитола, дефекту систем NADP+/NADPH и NAD+/NADH, снижению уровня глутатиона.

Ишемия нервной ткани и накопление конечных продуктов гликозилирования приводят к снижению активности фермента Na/K-АТФазы, перекисному окислению липидов, нарушению функции митохондрий и гибели клетки.
Механизм антиоксидантного действия тиоктовой кислоты
Тиоктовая кислота (ТК; α-липоевая кислота) – естественный антиоксидант организма человека, была впервые выделена в 1948 г., а ее свойства открыты в 1951 г. [8]. Было показано, что ТК является неотъемлемым компонентом, необходимым для окисления пирувата и α-кетоглутарата. Последующие фундаментальные работы также были посвящены изучению механизма действия ТК. Так, в исследовании in vitro показано, что ТК снижает уровень перекисного окисления липидов, вызванного глюкозой. Экспериментально доказано, что ТК активирует антиоксидантную систему, прежде всего за счет повышения синтеза глутатиона, при этом клиническими и электрофизиологическими коррелятами действия ТК были улучшение микроциркуляции и улучшение проведения импульса по межпальцевым нервам. Stevens M.J. и соавт. выявили также значительное улучшение эндоневрального метаболизма и функции митохондрий под влиянием ТК. В сочетании с γ-линоленовой кислотой ТК потенцирует активность фактора роста нерва.
Биохимические эффекты ТК детально изучены в работе Kishi Y. и соавт., в которой показано, что ТК корригирует потребление нервом деоксиглюкозы, а также эндоневральные уровни фруктозы, глюкозы и сорбитола. Таким образом, ТК не оказывает прямой антиоксидантный эффект на нервную ткань, а реализует свое влияние за счет нормализации метаболизма глюкозы. Кроме этого ТК нормализует метаболизм не только нервной, но и других тканей, в т. ч. эндотелия. Таким образом, терапевтический эффект ТК обусловлен как ее нейротропным действием, так и улучшением микроциркуляции.
Тиогамма – препарат тиоктовой кислоты, обладающий рядом существенных преимуществ: высокое качество, наиболее эффективная дозировка тиоктовой кислоты – 600 мг, единственные на рынке флаконы с раствором, не требующим разведения и полностью готовым для инфузии; наличие как инфузионных, так и пероральных лекарственных форм для курсового лечения; использование в растворах меглюминовой соли и тиоктовой кислоты, которая обеспечивает наиболее комфортное введение; безопасность препарата, доказанная многолетним клиническим опытом применения.
Тиогамма в лечении ДПНП
ТК доказала свою эффективность в ряде крупных двойных слепых плацебо-контролируемых исследований. Существует несколько форм ТК, одной из которых является ее меглуминовая соль, содержащаяся в препарате Тиогамма.
Основной целью патогенетической антиоксидантной терапии диабетической нейропатии с использованием ТК являются профилактика и лечение нейропатического синдрома, а также профилактика развития СДС. ТК доказала свою эффективность в ряде крупных двойных слепых плацебо-контролируемых исследований. В исследовании Бегма А.Н. и соавт. [2] показано, что терапия Тиогаммой снижает риск ампутации у пациентов с СДС. Так, в группе пациентов, получавших Тиогамму, не было показаний к операции в 65,8 % случаев, тогда как в группе больных, не получавших лечения Тиогаммой, операцию не проводили лишь у 38,7 % пациентов. В группе, получавшей лечение Тиогаммой, происходило уменьшение нейропатического синдрома на 4,5 балла, а в группе, не получавшей специфического лечения, – лишь на 1,5 %. Кроме того, у пациентов с СДС, лечившихся Тиогаммой, очищение раны происходило на 9–15-е сутки, а в группе без терапии – лишь на 22–27-е.
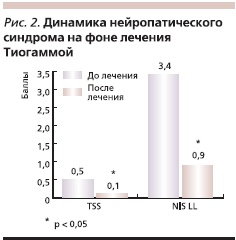 Немаловажное значение имеет высокая безопасность Тиогаммы. Препарат эффективен и безопасен при лечении детей и подростков. В исследовании Сивоус Г.И. [3] показано, что Тиогамма уменьшает выраженность нейропатического синдрома (по шкалам TSS – Total Symptom Score и NIS LL – Neuropathy Impairment Score Low Limbs) у детей и подростков с ДПНП (рис. 2). На фоне лечения Тиогаммой автором отмечено достоверное увеличение амплитуды М-ответа (4,1 ± 0,34 против 3,0 ± 0,22 мВ; p < 0,05) [3]. Отмечено также, что в изучаемой группе не было значимых изменений потребности в инсулине и колебаний гликемии на фоне приема таблетированной формы Тиогаммы, что свидетельствует о безопасности данного способа лечения.
Немаловажное значение имеет высокая безопасность Тиогаммы. Препарат эффективен и безопасен при лечении детей и подростков. В исследовании Сивоус Г.И. [3] показано, что Тиогамма уменьшает выраженность нейропатического синдрома (по шкалам TSS – Total Symptom Score и NIS LL – Neuropathy Impairment Score Low Limbs) у детей и подростков с ДПНП (рис. 2). На фоне лечения Тиогаммой автором отмечено достоверное увеличение амплитуды М-ответа (4,1 ± 0,34 против 3,0 ± 0,22 мВ; p < 0,05) [3]. Отмечено также, что в изучаемой группе не было значимых изменений потребности в инсулине и колебаний гликемии на фоне приема таблетированной формы Тиогаммы, что свидетельствует о безопасности данного способа лечения.
ТК эффективна не только в лечении ДПНП, но и при других формах диабетической нейропатии: вегетативной (кардиоваскулярной, ЭД), мононейропатиях. В исследовании Афониной Ж.А. и соавт. [1] показано, что в лечении тоннельных нейропатий у пациентов с СД Тиогамма (600 мг/сут 10 дней) имеет значительное преимущество перед местным лечением аппликациями диметилсульфоксида и прокаина, а также перед внутриканальными блокадами дексаметазоном и прокаином. Основным преимуществом терапии Тиогаммой был регресс нейропатического синдрома, особенно уменьшение жгучей боли. Тиогамма оказалась более эффективной в отношении не только чувствительных симптомов, но и двигательных нарушений.
Врачи предлагают комплексный подход к терапии ДПН – схему “Три шага к успеху” (авторы G. Sache, K. Reiners, в модификации И.А. Строкова, А.Н. Баринова) (2009):
1-я ступень. При легких неврологических нарушениях рекомендуется курс из 10 внутримышечных инъекций препарата Мильгамма (100 мг тиамина, 100 мг пиридоксина, 1000 мкг цианокобаламина, 20 мг лидокаина). За счет лидокаина и малого объема вводимого раствора инъекции совершенно безболезненны и усиливают приверженность пациента лечению. Далее пациент переходит на пероральный прием препарата Мильгамма композитум по 1 драже 3 раза в день в течение 2 месяцев. Повторные курсы следует проводить 2 раза в год.
2-я ступень – это курс терапии препаратом Тиогамма – по 1 флакону в день внутривенно капельно в течение 2–4 недель. Далее по 1 таблетке Тиогамма натощак в течение 1–2 месяцев.
3-я ступень – при тяжелых неврологических нарушениях – комбинированная терапия – по 1 флакону Тиогаммы внутривенно капельно ежедневно совместно с приемом препарата Мильгамма композитум (по 1 драже 3 раза в день). Длительность курса 4–6 недель.
При выраженном болевом синдроме авторы рекомендуют препарат Габагамма в дозе до 3600 мг в сутки (индивидуальное титрование дозы).
Заключение
Таким образом, контроль уровня глюкозы и метаболическая терапия ТК являются основными патогенетически оправданными методами лечения СД. Тиогамма (меглуминовая соль ТК) является эффективной, безопасной и удобной в использовании формой ТК, которую можно применять в лечении различных групп больных СД, в т. ч. детей при различных клинических формах диабетической нейропатии.
Информация об авторах:
Табеева Гюзель Рафкатовна – доктор медицинских наук, профессор, заведующая отделом неврологии
и клинической нейрофизиологии НИЦ ММА им. И.М. Сеченова.
Тел. 8 (499) 248-69-44;
Азимова Юлия Эдвардовна – кандидат медицинский наук, научный сотрудник отдела неврологии
и клинической нейрофизиологии НИЦ ММА им. И.М. Сеченова.
Тел. 8 (499) 248-69-44, e-mail: julia_azimova@mtu-net.ru


