Гастроинтестинальные стромальные опухоли (ГИСО) – это мезенхимальные новообразования желудочно-кишечного тракта (ЖКТ) веретеноклеточного, эпителиоидноклеточного или смешанного строения, экспрессирующие маркер CD117 (KIT), а также CD34, антигены гладкомышечной и нейрогенной дифференцировки с различной частотой [1–4].
Они являются самыми частыми мезенхимальными опухолями ЖКТ, на их долю приходится 0,1–3,0 % всех злокачественных новообразований ЖКТ и примерно 5,0 % сарком мягких тканей. Заболеваемость ГИСО в мире равна 10–20 случаям на 1 млн населения в год. За последние десять лет число диагностированных ГИСО увеличилось. Наиболее часто опухоль развивается в возрасте 40–60 лет [5–7]. В зависимости от типа клеток стромальные опухоли подразделяются на веретеноклеточные (70 %), эпителиоидноклеточные (20 %) и смешанные (10 %) [1–4].
Ключевой особенностью ГИСО является экспрессия тирозинкиназного рецептора KIT, наблюдаемая более чем в 95 % случаев [8, 9–14]. Другими менее специфичными для ГИСО антигенами являются СD34 (60–85 %); виментин (до 80 %), гладкомышечные маркеры – гладкомышечный актин (до 40 %), H-калдесмон, колпонин и реже десмин (до 5 %); в меньшей степени экспрессируются нейрогенные специфические маркеры S-100 протеин (до 5 %), хромогранин А, нейронспецифическая энолаза (NSE; 1–5 %), синаптофизин и нейрофиламенты [1–3, 5, 11, 15–18].
Целью настоящего исследования является выявление основных клинико-морфологических факторов, влияющих на прогноз больных ГИСО, с учетом отдаленных результатов лечения.
Материал и методы
Работа основана на анализе данных 74 пациентов с локализованными и местно-распространенными ГИСО, которым проводилось лечение в РОНЦ им Н.Н. Блохина с 2000 по ноябрь 2006 г. Среди них были 43 женщины и 31 мужчина, что составило 55,4 и 44,6 % соответственно. Возраст больных колебался от 33 до 78 лет, составив в среднем 58,2 года. Средний возраст мужчин составил 55, женщин – 60 лет. Из числа включенных в исследование больных 27 умерли, а 47 на момент завершения работы были живы. Всем пациентам по поводу первичной опухоли проводилось хирургическое лечение. Рецидивы заболевания развились у 31 больного.
У 46 (62,2 %) пациентов опухоль располагалась в желудке, у 3 (4,1 %) – в двенадцатиперстной, у 19 (22,5 %) – в тонкой кишках. Размер опухоли колебался от 3 до 52 см. У подавляющего большинства (90,6 %) пациентов максимальный размер опухоли превышал 5 см, у 47,4 % больных он был больше 10 см (табл. 1).
Лечение препаратом иматиниб (Гливек®) проводилось только больным с рецидивом заболевания и после паллиативных операций. У радикально оперированных пациентов пред- и послеоперационная терапия иматинибом не проводилась.
Отдаленные результаты лечения
Отдаленные результаты лечения зависят как от выбора тактики лечения, так и от ряда клинико-морфологических характеристик.
В частности, было установлено, что независимо от типа клеточного строения митотический индекс (МИ) коррелирует с размерами опухоли: у 60 % больных с размером опухоли до 5 см отмечена низкая митотическая активность (до 5 митозов в 50 ПЗБУ), а у 76,9 % пациентов с размером более 10 см определен высокий МИ (более 5 митозов).
В 84,6 % случаев (11 из 13) ГИСО эпителиоидноклеточного типа локализовались в желудке и в 62,2 % случаев (9 из 13) имели низкий МИ. У больных ГИСО тонкой кишки в 96,3 % случаев определены веретеноклеточный и смешанный типы строения, в 80,8 % – высокий МИ.
Был проведен сравнительный анализ отдаленных результатов лечения в зависимости от размеров, локализации, типа клеточного строения опухоли, МИ и уровня экспрессии рецептора KIT (CD117).
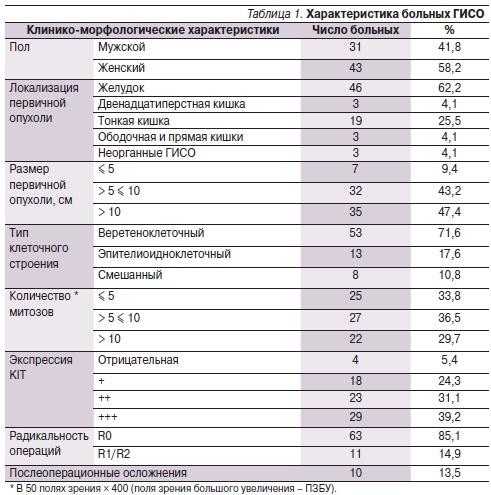
Пятилетняя выживаемость в группе больных с максимальным размером опухоли до 10 см составила 79,5 ± 7,0 % против 38,0 ± 9,8 % в группе с размером более 10 см (рис. 1).
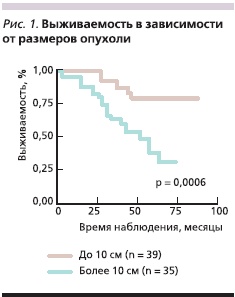
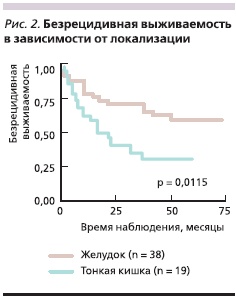
Пятилетняя безрецидивная выживаемость у пациентов с ГИСО желудка составила 59,4 ± 7,9 % против 30,7 ± 10,1 % при ГИСО тонкой кишки (χ2 = 6,394; р = 0,0115; рис. 2). Достоверных различий в общей выживаемости в зависимости от локализации опухоли у больных ГИСО не было выявлено. Это, вероятнее всего, было связано с недостаточной продолжительностью наблюдения за больными. Анализ отдаленных результатов в зависимости от митотической активности опухоли показал, что пятилетняя выживаемость была достоверно выше у больных с низким МИ (до 5 митозов; рис. 3): 79,6 ± 13,6 % против 67,2 ± 9,9 и 22,4 ± 17,4 % при количестве митозов > 5 ≤ 10 и > 10 в 50 ПЗБУ соответственно.
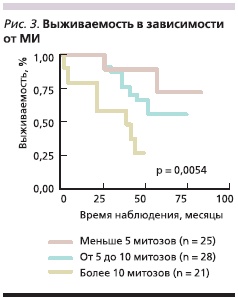
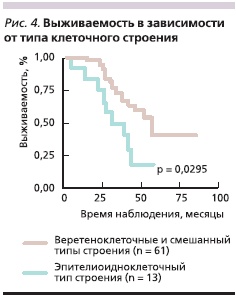
Пятилетняя выживаемость у больных с веретеноклеточным и смешанным типами строения ГИСО составила 58,3 ± 8,8 % против 42,4 ± 13,4 % у пациентов с эпителиоидноклеточным вариантом опухоли (рис. 4). Таким образом, несмотря на то что эпителиоидноклеточные ГИСО ассоциируются с низким МИ, показатели выживаемости при этих опухолях хуже, чем при веретеноклеточном и смешанном типах ГИСО, вероятнее всего, из-за низкого терапевтического ответа на тирозинкиназные ингибиторы.
Окончательный диагноз – “гастроинтестинальная стромальная опухоль” – ставился на основании морфологического и иммуногистохимического исследований. В случаях, подозрительных на ГИСО с отрицательнойэкспрессией CD117, дополнительно проводилось молекулярное исследование мутационного статуса.
У 70 из 74 (94,6 %) больных отмечена экспрессия рецептора KIT (CD117), у 52 (70,3 %) – рецептора CD34, у 48 (64,9 %) – виментина, у 23 (31,1 %) – гладкомышечного актина, еще реже – десмина и NSE. У больных ГИСО веретеноклеточного строения определялась более интенсивная экспрессия KIT, чем при эпителиоидноклеточных опухолях.
Наиболее интенсивная экспрессия KIT в ГИСО веретеноклеточного строения отмечена у пациентов с опухолями тонкой кишки: (++) 22 % и (+++) 71 %, против 33 (++) и 52 % (+++) в опухолях желудка.
При сравнительном анализе не было различий в выживаемости в зависимости от уровня экспрессии KIT (табл. 2).
Таблица 2. Выживаемость больных в зависимости от уровня экспрессии KIT.
Ассоциаций уровней экспрессии других рецепторов с гистологическим типом, локализацией и выживаемостью больных нами также не было выявлено.
Обсуждение
Большинство медицинских центров мира рассматривает все ГИСО как злокачественные опухоли. Предпринимались многочисленные безуспешные попытки отличить доброкачественные ГИСО от злокачественных. Fletcher и соавт. в 2002 г. в качестве факторов, позволяющих прогнозировать злокачественный потенциал ГИСО, предлагали размеры опухоли и МИ, выделив четыре степени риска метастазирования. Считается, что, как правило, метастазируют опухоли размером более 5 см. Однако в 20 % случаев, по данным De Mateo и соавт., метастазы обнаруживаются у больных с ГИСО размером менее 5 см [5, 9–11].
Согласно рекомендациям ESMO (European Society for Medical Oncology) 2005 г., к основным прогностическим факторам ГИСО были отнесены:
- размер первичной опухоли;
- МИ;
- локализация;
- тип мутации;
- пол.
В настоящее время наиболее широко применяется система расчета “риск прогрессирования заболевания” после радикальных операций, основанная на трех параметрах: МИ, размер и локализация ГИСО [16] (табл. 3).
Таблица 3. Риск прогрессирования заболевания (%) в зависимости от размера, МИ и локализации ГИСО.
Факт инвазии слизистой оболочки и разрыв капсулы опухоли являются независимыми неблагоприятными прогностическими признаками.
По нашим данным, основными клинико-морфологическими факторами прогноза у больных ГИСО являются: локализация, размер, МИ и тип клеточного строения опухоли. Эпителиоидноклеточный вариант строения чаще всего ассоциирован со стромальными опухолями желудка (около 90 %), низким МИ (70 %), но с худшей выживаемостью, вероятнее всего из-за низкого ответа на тирозинкиназные ингибиторы [19–23].
Стромальные опухоли тонкой кишки, как правило, имеют веретеноклеточный или смешанный вариант строения (97 %) и ассоциируются с более высоким МИ (80 % опухолей –более 5 митозов в 50 ПЗБУ) по сравнению с ГИСО желудка.
Экспрессия KIT в стромальных опухолях ЖКТ имеет важное диагностическое значение. Однако выживаемость больных не зависела от уровня этого показателя. Веретеноклеточные ГИСО экспрессируют KIT чаще и интенсивнее, чем эпителиоидноклеточные. Наиболее интенсивная экспрессия KIT отмечается в стромальных опухолях тонкой кишки веретеноклеточного строения (гиперэкспрессия ++ и +++ в 93 % случаев). При эпителиоидноклеточных ГИСО отрицательная и слабовыраженная экспрессия KIT обнаруживается в 70,6 % случаев. Уровень экспрессии KIT не зависит от размеров опухоли и митотического индекса.
Взаимосвязи экспрессии других рецепторов с локализацией, МИ и выживаемостью нами не выявлено. Подразделение стромальных опухолей ЖКТ на миогенные и нейрогенные в зависимости от преобладания экспрессии гладкомышечных или нейрогенных маркеров прогностически незначимо. Таким образом, выявление при ГИСО прогностических факторов имеет важное клиническое значение. Однако прогностическая роль отдельных факторов может трактоваться клиницистами по-разному.
В России с 2009 г. препарат иматиниб (Гливек ®) одобрен в качестве средства адъювантной терапии ГИСО, однако четкие показания к его применению по этому признаку до сих пор не разработаны.
У больных ГИСО с высоким МИ и размером более 10 см в 80–90 % случаев предполагается наличие субклинических метастазов (табл. 3), что требует активной терапии.
Большинство экспертов сходятся во мнении, что адъювантная терапия препаратом иматиниб абсолютно показана больным ГИСО с высоким риском развития рецидива и должна рассматриваться в каждом конкретном случае у пациентов со средним риском рецидива.
Оценка риска прогрессирования ГИСО, по нашему мнению, доступна большинству медицинских центров и может широко применяться в клинической практике.
Информация об авторах:
Стилиди Иван Сократович – член-корр. РАМН, профессор, заведующий хирургическим отделением
абдоминальной онкологии ГУ РОНЦ им. Н.Н. Блохина РАМН.
Тел. 8 (495) 324-26-70, e-mail: istilidi@front.ru;
Архири Петр Петрович – аспирант хирургического отделения абдоминальной онкологии
ГУ РОНЦ им. Н.Н. Блохина РАМН.
E-mail: arhiri@mail.ru;
Никулин Максим Петрович – кандидат медицинских наук, в.н.с. хирургического отделения
абдоминальной онкологии ГУ РОНЦ им. Н.Н. Блохина РАМН.
E-mail: maximpetrovich@mail.ru;
Мазуренко Наталья Николаевна – доктор медицинских наук, заведующая лабораторией
онкогеномных вирусов ГУ РОНЦ им. Н.Н. Блохина РАМН.
Тел. 8 (495) 324-78-17, e-mail: nnmazurenko@mail.ru;
Анурова Ольга Александровна – кандидат медицинских наук, в.н.с. патологоанатомического
отделения ГУ РОНЦ им. Н.Н. Блохина РАМН.
Тел. 8 (495) 324-60-38, e-mail: 19627777@mail.ru;
Медведева Бэлла Михайловна – кандидат медицинских наук, с.н.с. отделения лучевых
методов диагностики ГУ РОНЦ им. Н.Н. Блохина РАМН.
Тел. 8 (495) 324-18-31, e-mail: m-diagnostica@yandex.ru


