Главную роль в патогенезе острого инфаркта миокарда (ОИМ), т. е. в развитии ишемического некроза мышцы сердца, играет полное прекращение кровоснабжения участка миокарда в результате острой окклюзии коронарной артерии (КА). Первые деградационные изменения кардиомиоцитов начинаются через 1/3–2/3 часа после прекращения кровотока в КА [1], что проявляется постепенным уменьшением запасов гликогена, набуханием митохондрий, разрушением саркоплазматического ретикулума и деструкцией митохондрий. Отмечается резкое ослабление окислительного фосфорилирования и одновременное накопление в мышце продуктов анаэробного гликолиза, в частности лактата [7]. Одновременно происходит накопление неэстерифицированных жирных кислот, отмечается постепенный выход из клеток ионов калия (К+), в поврежденных митохондриях и цитоплазме миофибрилл накапливаются ионы кальция (Са++) вследствие резкого снижения запасов энергетических субстратов в кардиомиоците [1]. В результате накопления лактата, неэстерифицированных жирных кислот, ионов Са++ запускается порочный круг, который усугубляет
ишемию и увеличивает зону некроза. Таким образом, в первые часы прекращения кровотока по КА из микроскопических некротических изменений миокарда формируются (спустя 10–12 часов) макроскопические очаги некроза мышцы сердца, указывая на расширение и углубление некротического процесса [4, 8]. Вышесказанное определяет необходимость поиска быстрого и эффективного восстановления кровотока в КА с целью прекращения коагуляционного некротического процесса и миоцитолиза в сердечной мышце.
На сегодняшний день имеется три способа восстановления кровотока в окклюзированной КА. Первый, наиболее распространенный медикаментозный, – системный или внутрикоронарный тромболизис, в результате которого за счет разрушения тромба происходит частичное восстановление кровотока в КА. Второй, значительно более травматичный, – хирургическая реваскуляризация миокарда, позволяющая восстанавливать кровоток в инфарктответственной артерии путем обходного шунтирования окклюзированного участка артерии. Третий – первичная ангиопластика и стентирование инфарктответственной коронарной артерии (ИОКА), что позволяет наиболее полно
восстанавливать проходимость КА [3]. Однако существует точка зрения, что после восстановления кровотока по ИОКА, т. е. при реперфузии миокарда, может продолжаться его повреждение вследствие недостатка эндогенных энергетических субстратов и вхождения ионов Са++ и продуктов анаэробного гликолиза в поврежденные клетки [2, 6]. В результате развивается стойкая контрактура мышечных волокон [3]. При этом повышается концентрация в крови биохимических маркеров повреждения миокарда – креатинфосфокиназы и лактатдегидрогеназы, а также белкамаркера повреждения кардиомиоцитов тропонина I [5].
Стандартная медикаментозная терапия ишемической болезни сердца (ИБС) направлена на уменьшение потребности миокарда в кислороде или на увеличение его доставки посредством вазодилатации. Наибольший интерес представляет группа препаратов, действие которых направлено на улучшение эффективности утилизации кислорода миокардом в условиях ишемии, – метаболическая терапия. Эффективное медикаментозное воздействие возможно двумя путями (или их сочетанием): 1) использование метаболической терапии на догоспитальном этапе вместе с основными классами антиангинальных препаратов; 2) введение этого вещества непосредственно в реканализированную ИОАК, что позволяет, по всей вероятности, более эффективно воздействовать на пораженный миокард.
Задачей исследования был выбор оптимального препарата, который бы обладал высокой биодоступностью, по механизму действия являлся бы энергетическим субстратом, легко поступающим в кардиомиоцит, и был бы достаточно долгоживущим. Исходя из этих требований, наиболее перспективным представляется отечественный препарат Мексикор. В литературе имеются доказательства эффективности данного средства у пациентов, страдающих хроническими формами ИБС, острым коронарным синдром без подъема сегмента ST, однако нет данных об эффективности Мексикора у пациентов с ОИМ на догоспитальном этапе, а также в сочетании с интервенционными процедурами, системной тромболитической терапией. Представляет интерес изучение влияния препарата на реперфузионное повреждение миокарда.
Цель настоящего исследования – изучение эффективности догоспитальной терапии цитопротектором Мексикором с последующим его внутрикоронарным введением в первые часы ОИМ.
Материал и методы
В исследование включены 82 пациента с ОИМ, госпитализированных не позднее 4 часов от начала заболевания. Больные разделены на три группы. Первую составили 29 пациентов, которым на догоспитальном этапе осуществлена системная тромболитическая терапия в сочетании с внутривенным введением Мексикора в дозе 200 мг. В стационаре этим пациентам выполнена механическая реканализация и ангиопластика ИОКА с внутрикоронарным введением 200 мг Мексикора. Вторая группа – 31 пациент, которым Мексикор в дозе 200 мг первично внутрикоронарно ввели
во время проведения эндоваскулярной процедуры. Пациентам третьей группы (22 человека) выполнили ангиопластику ИОКА.
Селективная коронароангиография (КАГ), левая вентрикулография, процедура реканализации и ангиопластики ИОКА всем пациентам были выполнены в пределах первых 6 часов от начала заболевания. В исследование включили больных с полной окклюзией КА в проксимальной или средней ее трети с антеградным кровотоком TIMI 0. В 1-ю группу были включены пациенты с обязательным эффективным системным тромболизисом. Формирование 2-й и 3-й групп производилось в стационаре путем рандомизации пациентов. Внутривенное введение Мексикора в 1-й группе начинали на догоспитальном этапе после введения тромболитика в дозе 200 мг на 150 мл физиологического раствора (ФР). Пациентам 1-й и 2-й групп осуществлено внутрикоронарное введение Мексикора после первой дилатации ИОКА (200 мг препарата развели в 40 мл ФР и вводили в течение 10 минут). После окончания процедуры осуществлено внутривенное (3 раза в день в течение 5 суток), а затем внутримышечное (3 раза в день в течение 9 дней) введение препарата с последующим переходом на его пероральную форму по разработанной схеме.
Забор крови (5 мл из кубитальной вены) на маркеры повреждения кардиомиоцитов (тропонин I, миоглобин) в соответствии с существующими рекомендациями проведен в момент реканализации, через 12 и 24 часов после выполнения процедуры [11]. После 15-минутной инкубации кровь центрифугировали (4000 об./мин) в течение 10 минут. Сыворотку замораживали при -20 °С. Количественное определение тропонина I и миоглобина в сыворотке крови проведено методом иммуноферментного анализа с использованием моноклональных антител к миоглобину и кардиальной изоформе тропонина I (диагностические наборы “Myoglobin ELISA”, “Troponin I ELISA”, DRG Instruments GmbH, Германия) на микропланшетном фотометре E-Liza Mat-3000 (DRG International Inc., США) при длине волны 450 нм. Чувствительность используемых диагностических наборов для определения миоглобина и тропонина I составила 5 и 1 нг/мл соответственно. Диагностически значимыми при повреждении миокарда считались концентрации тропонина I более 1,5 и миоглобина более 90 нг/мл. Эффективность введения препарата на догоспитальном этапе (27 пациентов) определена с помощью заполнения стандартных опросных карт врачами бригад скорой помощи.
В дальнейшем все больные проходили динамическое наблюдение в отделении реанимации и интенсивной терапии (ОРИТ) для терапевтических больных, из которого на 3-и сутки от начала заболевания их переводили в кардиологическое отделение. В отсутствие противопоказаний проводили холтеровское мониторирование, ЭХО-кардиографию (ЭхоКГ), велоэргометрию.
Особенностью исследования явилось то, что всем пациентам на 10-е сутки течения заболевания выполнили вентрикулографию c последующим сравнительным анализом глобальной и сегментарной сократимости, в т. ч. для изучения влияния препарата на гибернирующий и оглушенный миокард. Вычисления произведены с помощью прикладной компьютерной программы. Средний срок пребывания пациентов в стационаре составил 12,5 ± 1,8 суток.
Результаты и обсуждение
В табл. 1 представлены исходные клинико-лабораторные данные пациентов изученных групп.
Большинство больных курили, страдали артериальной гипертензией и нарушениями липидного обмена.
В подавляющем большинстве это были мужчины; ОИМ в анамнезе не было ни у одного из них.
Таблица 1. Исходные клинико-анамнестические и лабораторные данные обследованных (x ± m).
В 1-й группе пациенты поступили в стационар в среднем спустя 4,6 часа от начала ангинозного приступа, во 2-й – через 4,4, в 3-й – через 4,5 часа (различия статистически недостоверны). Больным регистрировалось ЭКГ, отмечено формирование зубца Q в отведениях, соответствующих зоне ОИМ, в сочетании с элевацией сегмента ST в тех же отведениях. У 3 (10,3 %) пациентов в 1-й, 4 (12,9 %) во 2-й и 3 (13,6 %) в 3-й группах на момент поступления наблюдали частую экстрасистолию, носившую характер единичных или парных желудочковых экстрасистол. У 4 (13,7 %) больных в 1-й и у 4 (12,9 %) – во 2-й группах отмечено нарушение внутрижелудочковой проводимости (неполная блокада левой ножки пучка Гиса). Недостаточность кровообращения проявилась в виде небольшого количества хрипов в нижних отделах легких, одышки в покое и тахикардии.
По данным контрастной вентрикулографии фракция выброса (ФВ) левого желудочка (ЛЖ) составила в среднем 44 ± 8 %. Среднее значение глобальной и сегментарной сократимости ЛЖ в исследуемых группах представлено на рис 1. Чаще отмечался выраженный акинез переднелатерального и верхушечного сегментов ЛЖ (от 42 до 51 %).
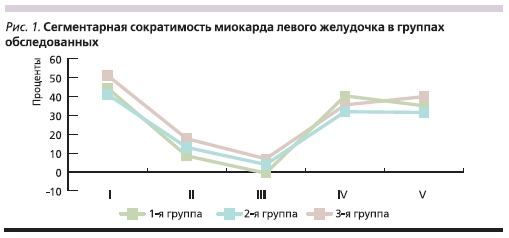
Вместе с тем в неповрежденных сегментах ЛЖ наблюдали компенсаторный гиперкинез, который по данным ЭХО-кардиографии снижался и возвращался к норме через 1–2 недели. Непосредственно после диагностической процедуры селективной КАГ следовало выполнение интервенционной эндоваскулярной процедуры (баллонной ангиопластики и/или стентирования ИОКА). Некоторые клинико-ангиографические характеристики в изученных группах больных представлены в табл. 2.
Таблица 2. Исходные клинико-ангиографические данные (x ± m).
В 95 % случаев внутри- и межсистемный коллатеральный кровоток у обследуемых пациентов отсутствовал. Лишь у одного больного в первой группе отмечено наличие 1-й степени коллатерального заполнения дистального русла окклюзированной артерии по межсистемным коллатералям. Процедуру ангиопластики выполняли в среднем через 5,3 ± 0,5 часа от начала ангинозного приступа в первой группе, через 4,9 ± 0,4 часа во второй и через 4,8 ± 0,4 часа в третьей (различия статистически недостоверны). Во всех случаях процедура была успешной: отсутствовали угрожающая диссекция, эмболизация дистального русла; замедления антеградного кровотока не наблюдалось. Средний расход контрастного вещества в группах был примерно одинаков. Реканализация КА выполнена гидрофильными проводниками. Для адекватной оценки ангиометрических характеристик окклюзии проведена предилатация баллоном диаметром 1,5–2,0 мм. После этого осуществлен анализ пораженного участка с помощью цифровой компьютерной ангиографии с последующим выбором баллона необходимого диаметра и достижением адекватного ангиографического результата. После выполнения процедуры больных в течение 1–2 суток наблюдали в ОРИТ (осложнений процедур и летальности не зарегистрировано), затем их переводили в кардиологическое отделение.
У всех пациентов течение заболевания на госпитальном этапе было гладким, серьезных осложнений не отмечено.
Пациенты получали принятую в центре медикаментозную терапию. Различий в исследуемых группах по антиангинальной терапии в госпитальном периоде ОИМ не было (табл. 3).
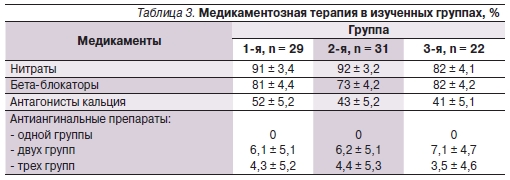
Дезагрегантная терапия после выполненной эндоваскулярной процедуры была стандартной: тиклопидин в дозировке 500 мг/сут в течение месяца и постоянно аспирин по 100 мг/сут. Через неделю после эндоваскулярной процедуры всем больным проведено повторное ЭхоКГ-обследование, а спустя 10 дней в отсутствие противопоказаний оценивали толерантность к физической нагрузке. Пациентам, течение заболевания которых осложнилось развитием аневризмы передней стенки ЛЖ, пробу с физической нагрузкой не проводили. Результаты ЭхоКГ представлены в табл. 4.

Таким образом, в 1-й и 2-й группах какой-либо динамики показателей ФВ ЛЖ по сравнению с исходными (по данным ЭхоКГ) не наблюдалось, тогда как во 3-й группе отмечено снижение ФВ в среднем на 12 % (различия достоверны, р < 0,05). Аневризму ЛЖ наблюдали у 3 больных в 1-й, у 2 – во 2-й и у 5 – в 3-й группах (различия недостоверны).
Изучение толерантности к физической нагрузке проведено 9 пациентам в 1-й, по 7 больным – во 2-й и 3-й группах. Более высокую толерантность к физической нагрузке наблюдали в первых двух группах (89 ± 19 и 81 ± 17 против 51 ± 26 Вт). Однако различия между группами из-за малого количества наблюдений были недостоверными.
Исследование компонентов крови может дать важную информацию как о качественных, так и о количественных характеристиках ишемического повреждения миокарда [13]. Наиболее важными из них являются тропонины – белки, локализующиеся на тонких миофиламентах сократительного аппарата кардиомиоцитов. Тропониновый комплекс состоит из трех компонентов – тропонинов С, Т и I. Кардиальные тропонины Т и I являются специфичными белками повреждения кардиомиоцитов, имеющими приблизительно одинаковую чувствительность и специфичность [10, 12]. Минимальное время повышения уровня тропонина после окклюзии ИОКА составляет 4–6 часов [9, 10].
Первый забор крови на маркеры повреждения проведен в момент реканализации ИОКА. Диапазон значений концентраций тропонина I в крови колебался в изученных группах от 0 до 20 нг/мл, в среднем составляя 8,9 ± 5 нг/мл в 1-й группе против 13,2 ± 6 нг/мл в группе контроля (различия статистически недостоверны). Вторая контрольная точка забора крови определена через 12 часов на максимуме повышения концентрации тропонина после реперфузии ИОКА [9, 11]. В первой группе пациентов первая точка забора осуществлена сразу в стационаре, а вторая – через 12 часов с момента клинических проявлений реперфузии, возникших в машине скорой помощи. Третий контрольный забор крови для определения ферментов осуществлен спустя 24 часа. Концентрация тропонина I в группах достоверно различалась.
Максимальные различия в уровне тропонина I через 12 часов наблюдались между 2-й и 3-й группами (р < 0,05), что объективно может свидетельствовать о меньшем повреждении кардиомиоцитов во 2-й группе, тогда как в 1-й по сравнению с 3-й группой отмечена тенденция (р = 0,07) к снижению уровня кардиоспецифичных ферментов, что свидетельствовало о более эффективном восстановлении кровотока в ИОКА.
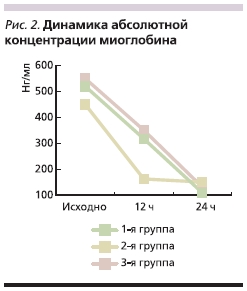
Чувствительным маркером неспецифического повреждения миокарда служит также миоглобин. Динамика изменения концентрации миоглобина как биохимического маркера, наиболее рано повышающегося при развитии ОИМ, представлена на рис. 2. Исходный уровень миоглобина был приблизительно равен в трех группах (достоверных различий не отмечено; p > 0,05), тогда как на второй контрольной точке наблюдали тенденцию к снижению концентрации маркера во 2-й группе по сравнению с 3-й (p > 0,05).
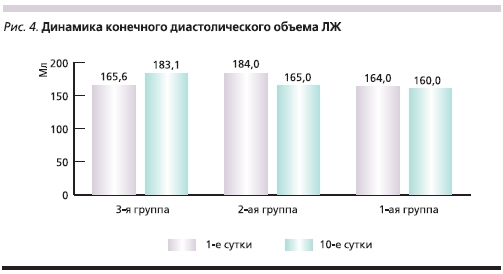
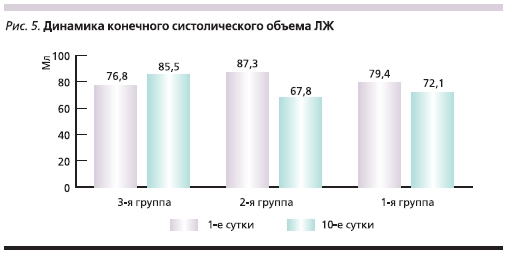
На 10-е сутки течения заболевания всем пациентам была выполнена контрольная вентрикулография для оценки динамики глобальной и сегментарной сократимости миокарда ЛЖ. Динамика ФВ ЛЖ, а также конечного диастолического объема (КДО) и конечного систолического объема (КСО) ЛЖ в исследуемых группах представлена на рис. 3–5. Из них следует, что в группах больных, которым в составе лечения вводился цитопротектор Мексикор, отмечены достоверно более высокие показатели.
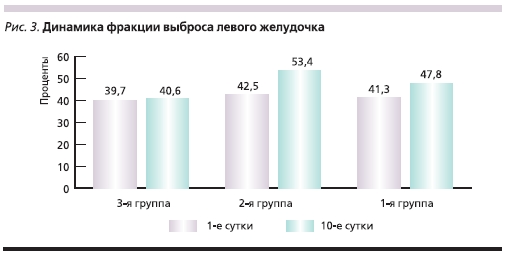
Как видно из представленных диаграмм, в группе с использованием цитопротектора Мексикора отмечена достоверно более высокая ФВ ЛЖ, а также достоверная положительная динамика КДО и КСО ЛЖ на 10-е сутки течения заболевания по сравнению с контрольной группой.
Основным итогом проделанной работеы являются два ее аспекта: первый – введение цитопротектора Мексикора на догоспитальном этапе, второй – ограничение реперфузионного повреждения кардиомиоцитов путем введения этого препарата непосредственно в ИОКА после ее реканализации и ангиопластики. Важно отметить и то, что применение Мексикора на госпитальном этапе благоприятно влияло на гибернирующий миокард, что было подтверждено при сравнении глобальной и сегментарной сократимости миокарда ЛЖ исходно и на 10-е сутки течения заболевания.
Ранняя реканализация способствует ограничению зоны ИМ только в случае своевременной (до 4 часов) доставки пациента бригадой скорой помощи в стационар. Интервал времени от получения диспетчером первичной информации о больном до госпитализации в ОРИТ в нашем исследовании в среднем составил 112 ± 38 минут и был значительно меньше, чем в большинстве отечественных исследований. Кроме того, некоторым больным наряду с тромболитической терапией назначен цитопротектор. Эти пациенты чувствовали себя лучше, и ко времени поступления в ОРИТ у них
отмечены более стабильные показатели артериального давления, менее остро протекал реперфузионный синдром (уменьшилось количество экстрасистол, отмечено не столь значительное падение артериального давления, реже наблюдались диспепсические явления).
Результаты экспериментальных работ свидетельствуют, что чем раньше начата метаболическая терапия, тем менее выражено реперфузионное повреждение кардиомиоцитов. Низкая эффективность такого лечения может быть обусловленной недостаточной дозой и/или неадекватным воздействием вводимого препарата. Отечественный цитопротектор Мексикор является одним из первых метаболических препаратов, обладающим принципиально иным механизмом действия. Он достаточно быстро накапливается в мышце сердца и имеет долгий период полувыведения, что делает его более эффективным. При внутривенном введении Мексикор способствовал ограничению зоны повреждения как при острой ишемии, так и при ОИМ, что связано с выраженным кардиопротективным действием препарата в результате улучшения митохондриального транспорта, энергетики оглушенного и гибернирующего миокарда в условиях острой и хронической ишемии.
Нами сделано предположение, что введение Мексикора непосредственно в ИОКА окажется более эффективным по сравнению с внутривенным введением препарата с точки зрения профилактики реперфузионного повреждения кардиомиоцитов. Эта гипотеза была подтверждена данными биохимического исследования кардиоспецифичных ферментов: отмечено двукратное достоверное снижение концентрации специфического маркера некроза кардиомиоцитов тропонина I в группе с внутрикоронарным введением Месикора по сравнению контролем.
Выводы
Патогенетическим методом лечения ОИМ является восстановление коронарного кровотока в первые 4 часа от момента его развития, что во многом определяет дальнейшее течение заболевания и его прогноз.
Первичная ангиопластика и стентирование ИОКА являются наиболее эффективными и радикальными методами восстановления коронарного кровообращения у больных ОИМ.
После успешной ангиопластики ИОКА внутрикоронарное введение кардиопротектора Мексикора способствует значительному повышению клинической эффективности восстановления коронарного кровообращения и является средством профилактики реперфузионного повреждения миокарда.


