Гипергликемия на фоне острого коронарного синдрома (ОКС) является предиктором высокого риска сердечно-сосудистых событий и может рассматриваться как неблагоприятный прогностический признак в отношении госпитальной и постгоспитальной летальности [1–6]. Гипергликемия выявляется у 25–60 % пациентов с осложненным течением инфаркта миокарда (ИМ) [7, 8]. От 25 до 70 % пациентов с гипергликемией, впервые выявленной на фоне ОКС, имеют различные нарушения углеводного обмена: сахарный диабет (СД), нарушенную толерантность к глюкозе, повышенную гликемию натощак [9, 10]. Среди лиц с нарушенной толерантностью к углеводам ежегодный процент ее трансформации в СД составляет 1,5–7,3 %. Уровень глюкозы крови натощак более 5,6 ммоль/л повышает этот риск в 3,3 раза [11].
При наличии ИМ и впервые выявленной гликемии (ВВГ) менее 11,1 ммоль/л СД выявляют у 31–34 % пациентов, а у 34–40 % – нарушенную толерантность к глюкозе. Через 3 месяца после выписки из стационара диагноз СД устанавливают у 25–30 % пациентов, нарушенную толерантность к глюкозе – у 37–41 % [12, 13]. Среди пациентов с гипергликемией на фоне ОКС (без установленного СД в анамнезе) преобладают лица женского пола старшей возрастной группы с отягощенной наследственностью по СД, наличием ИМ или сердечной недостаточности в анамнезе [14].
Целью исследования явилась верификация класса нарушений углеводного обмена у пациентов с ВВГ на фоне ОКС.
Материал и методы
Исследование проводилось на базе городской клинической больницы № 81 Москвы. Были обследованы 90 пациентов с ВВГ на фоне ОКС, госпитализированных в отделение интенсивной кардиологии не позднее 6 часов от момента развития ОКС. В исследование не включали пациентов с гликемией (по плазме венозной крови) при поступлении менее 6,0 ммоль/л натощак и менее 7,5 ммоль/л в течение дня, а также пациентов, которым на догоспитальном этапе проводилась терапия глюкокортикоидными препаратами.
У всех пациентов в первые часы пребывания в отделении кардиореанимации исследовали уровень глюкозы крови, а также уровень гликозилированного гемоглобина (НbА1c) для выявления хронической декомпенсации углеводного обмена. Диагноз впервые выявленного СД или нарушенной толерантности к глюкозе установлен в соответствии с критериями ВОЗ (1999) [15].
Пациентам, у которых СД был выявлен впервые, в период госпитализации внутривенно вводили инсулин короткого типа действия с целью коррекции и поддержания уровня глюкозы крови в пределах 6 ммоль/л. Пациентам, уровень глюкозы крови которых в первые сутки пребывания в отделении интенсивной терапии был в пределах более 6,0 ммоль/л натощак и менее 10,9 ммоль/л в течение дня, а также больным, у которых наблюдалась нормализация гликемии через 6–8 часов с момента госпитализации, перед выпиской из стационара проведен оральный глюкозотолерантный тест (ОГТТ). Пациентам с нормальными показателями глюкозы крови по результатам проведения ОГТТ, свидетельствующими об отсутствии нарушений углеводного обмена на госпитальном этапе, проведено повторное исследование через 6 месяцев после выписки
из стационара.
Оральный глюкозотолерантный тест осуществлен в соответствии с рекомендациями ВОЗ: забор крови сделан из кубитальной вены утром натощак, спустя 12 часов после приема пищи. Пациенту предлагали выпить 75 г глюкозы (сухой порошок глюкозы предварительно растворяли в 250 мл теплой кипяченой воды). Повторный забор крови осуществлен через 120 минут с момента приема раствора глюкозы. Плазму крови, отделенную методом центрифугирования, немедленно отправляли в лабораторию для исследования.
Уровень глюкозы крови исследован в плазме венозной крови с помощью глюкозооксидазного метода на фотоэлектрокалориметре КФК-3 (Россия). О степени компенсации углеводного обмена судили по уровню НbА1c, который исследовали с помощью прибора “DCA 2000” (Bayer, Германия). Диагноз ИМ верифицирован на основании клинической картины, данных электрокардиографии, активности кардиоспецифических ферментов (креатинфосфокиназы – КФК, МВ-КФК), уровня тропонина-Т в плазме крови (Roche, Германия). Степень нарушения кровообращения при ИМ определена в соответствии с классификацией Killip T. (1967).
Статистическая обработка данных проведена с помощью системы статистического анализа (SPSS 11.5 for Windows). Описываемые данные представлены в процентах, в виде средних значений и стандартного отклонения среднего (М ± σ). Для анализа зависимостей исследуемых признаков использован коэффициент корреляции Пирсона (r). Достоверными считались различия при р < 0,05.
Результаты и обсуждение
Возраст обследуемых пациентов варьировался от 43 до 75 лет (в среднем – 64,9 ± 10,8 года), 62,2 % (56 из 90) пациентов были старше 60 лет. Среди 90 больных преобладали лица женского пола (50 человек). Инфаркт миокарда наблюдался у 85 пациентов, нестабильная стенокардия – у 5. У большинства пациентов были выявлены факторы риска развития СД и ишемической болезни сердца (ИБС). Клиническая характеристика пациентов представлена в таблице.
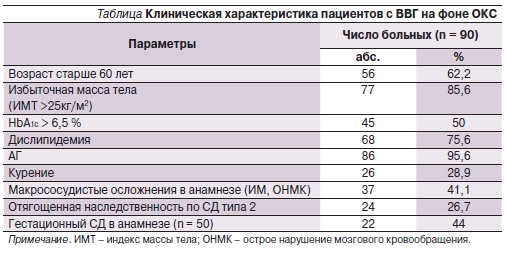
Средний показатель объема талии превышал норму у 93,3 % (84 из 90) пациентов (в среднем 101 ± 11,4 см у мужчин и 98 ± 13,8 см у женщин). Отягощенная наследственность по СД2 отмечена у 26,7 % (24 из 90) пациентов, рождение ребенка весом более 4 кг в анамнезе – у 44 % (22 из 50) обследуемых женщин данной группы. Артериальная гипертензия (АГ) встречалась у 95,6 % (86 из 90) пациентов, у 67,7 % (61 из 90) АГ соответствовала III степени (более 180/110 мм рт. ст.) и у 28,8 % (26 из 90) пациентов наблюдалась более 20 лет. Доля лиц с ИМ в анамнезе составила 27,7 % (25 из 90), с ОНМК – 13,3 % (12 из 90). Уровень триглицеридов в среднем составил 2,8 ± 1,5 ммоль/л и был выше 1,7 ммоль/л у 75,6 % (68 из 90) пациентов. Уровень общего холестерина в среднем составил 6,2 ± 1,3 ммоль/л, у 66,7 % (60 из 90) пациентов был выше 4,8 ммоль/л.
Средний уровень глюкозы крови на момент госпитализации составил 12,9 ± 5,5 ммоль/л. У 55,5 % (50 из 90) пациентов уровень глюкозы крови при поступлении превышал 11 ммоль/л (в среднем – 16,3 ± 5,6 ммоль/л). У 44,4 % (40 из 90) пациентов уровень гликемии колебался в пределах от 6,3 до 10,9 ммоль/л. Уровень НbА1c у 50 % (45 из 90) пациентов был выше 6,5 % (в среднем – 8,8 ± 1,5 %), что свидетельствовало об имевшихся нарушениях углеводного обмена до госпитализации, которые не были своевременно диагностированы.
Уровень глюкозы крови при поступлении коррелировал с обширностью поражения миокарда (r = 0,33, р < 0,001), развитием осложнений ИМ (r = 0,370, р < 0,001), степенью выраженности недостаточности кровообращения (r = 0,357, р < 0,001) и не коррелировал со степенью нарушения углеводного обмена, выявленного в ходе исследования (r = 0,12, р = 0,244).
Детальный анализ данных 90 пациентов с ВВГ на фоне ОКС позволил верифицировать различные нарушения углеводного обмена на госпитальном и постгоспитальном этапах. У 36,7 % (33 из 90) пациентов уровень глюкозы крови при поступлении был выше 7 ммоль/л натощак и/или выше 11 ммоль/л в течение дня (в среднем – 13,3 ± 4,6 ммоль/л) и сохранялся повышенным в период пребывания в отделении кардиореанимации, что требовало его коррекции. У 90,9 % (30 из 33) пациентов уровень НbА1c превышал 6,5 %. Полученные данные позволили диагностировать СД2 в данной группе пациентов.
У 63,3 % (57 из 90) пациентов уровень глюкозы крови при поступлении был повышенным (в среднем 11,6 ± 2,7 ммоль/л): из них у 24,4 % (22 из 90) пациентов в период пребывания в стационаре уровень глюкозы крови сохранялся в пределах более 6,0 ммоль/л натощак и менее 10,9 ммоль/л в течение дня, а у 38,8 % (35 из 90) больных уровень глюкозы крови нормализовался к концу первых суток от момента госпитализации. Этим 57 (63,3 %) пациентам был проведен ОГТТ перед выпиской из стационара. По результатам теста нарушения углеводного обмена выявлены у 55,5 % (50 из 90) пациентов: СД2 – у 42,2 % (38 из 90), нарушенная толерантность к глюкозе – у 13,3 % (12 из 90). Результаты теста свидетельствовали об отсутствии нарушений углеводного обмена у 7,8 % (7 из 90) пациентов на момент госпитализации. ОГТТ, проведенный через 6 месяцев после выписки из стационара у 7 пациентов, не имевших нарушений углеводного обмена на госпитальном этапе, выявил нарушенную толерантность к глюкозе – у четырех, СД2 –у одного пациента.
Согласно полученным в исследовании данным, пациенты с ВВГ на фоне ОКС составляют группу высокого риска по развитию различных нарушений углеводного обмена в течение 6 месяцев после перенесенного коронарного события. Детальное обследование позволило установить различные нарушения углеводного обмена у 97,7 % (88 из 90) пациентов: СД2 – у 80 % (72 из 90), нарушенную толерантность к глюкозе – у 17,7 % (16 из 90).
По данным проведенного исследования, пациенты с ВВГ на фоне ОКС имели все факторы риска развития СД2 и ИБС: возраст старше 60 лет – 62,2 %, избыточную массу тела – 85,6 %, отягощенную наследственность по СД2 – 26,7 %, гестационный СД в анамнезе – 44,0 %, дислипидемию – 75,6 %,
артериальную гипертензию – 95,6 %, макрососудистые осложнения в анамнезе (ИМ, ОНМК) – 41,1 % пациентов. У 50 % пациентов уровень НbА1c был выше 6,5 %, что свидетельствовало о хронической гипергликемии и отсутствии своевременной диагностики нарушений углеводного обмена на догоспитальном этапе. В свою очередь совершенно очевидно, что в случае несвоевременной их диагностики сохраняющаяся хроническая декомпенсация углеводного обмена вызывает опасность развития таких макрососудистых катастроф, как ИМ и ОНМК. У наблюдаемых нами пациентов, несмотря на наличие факторов риска развития СД и ИБС и хронической декомпенсации углеводного обмена, на догоспитальном этапе детального обследования с целью активного выявления возможных нарушений углеводного обмена и назначения соответствующей терапии не проводилось ни в одном случае. Нарушения углеводного обмена были выявлены лишь при поступлении в отделение кардиореанимации с диагнозом ОКС.
На момент госпитализации в отделение кардиореанимации уровень глюкозы крови был высоким (в среднем 12,9 ± 5,5 ммоль/л). Выраженность гипергликемии в основном была обусловлена обширностью поражения миокарда, развитием осложнений и не коррелировала с нарушениями углеводного обмена, выявленными в ходе исследования.
Таким образом, полученные результаты подтверждают раннее приведенные данные о том, что впервые выявленное повышение уровня глюкозы крови в период госпитализации по поводу ОКС требует дальнейшего обследования после регресса острого состояния с целью верификации нарушений углеводного обмена. Судить о степени нарушения углеводного обмена только по уровню гипергликемии при поступлении недопустимо [16, 17]. Обследование должно включать определение уровня тощаковой глюкозы крови в динамике, проведение ОГТТ перед выпиской из стационара и не позднее 6 месяцев наблюдения на постгоспитальном этапе.
Гипергликемия на фоне ОКС требует обязательной коррекции с целью предупреждения возможного развития сердечно-сосудистого события и летальности на госпитальном и постгоспитальном этапах. В настоящее время в качестве метода выбора для коррекции гипергликемии при неотложных состояниях, в частности при ОКС, рассматривается внутривенная инфузия инсулина короткого типа действия [18]. Внутривенная инсулинотерапия считается наиболее эффективной и позволяет осуществлять быструю коррекцию гипергликемии, поддерживать целевые значения глюкозы крови в отделении интенсивной терапии за счет короткого периода циркуляции инсулина в крови и возможности быстро реагировать на изменение уровня глюкозы крови в зависимости от состояния пациента.


